成人哮喘患者血清白介素13与呼出气一氧化氮和ACT评分的相关性
陈晓丽 张秀义 许浩然 景卫革 赵艳光 刘美辰
1 承德医学院,河北省承德市 067000; 2 承德市中心医院呼吸内科
支气管哮喘(简称哮喘)是呼吸系统常见的慢性气道异质性炎症疾病。症状的急性加重是哮喘的表象,控制气道炎症是实现哮喘有效控制的根本。研究表明[1],呼出气一氧化氮(FeNO)的高低与哮喘患者气道炎症类型和炎症水平密切相关,在预判和评估激素治疗方面有着重要的意义。参与Th2型炎症的IL-13在哮喘发病机制中起着核心作用[2],与哮喘潜在的严重程度相关。IL-13可以直接通过过敏性炎症或间接通过嗜酸性炎症途径使气道NO水平升高[3]。哮喘控制测试(ACT)评分表在临床中应用于评估哮喘控制水平。本文旨在探讨哮喘急性发作患者血清IL-13与FeNO、ACT评分的相关性,并分析哮喘急性发作患者血清IL-13、气道FeNO水平的动态变化对气道炎症趋势的评估价值,为临床药物疗效的评价做铺垫。
1 资料与方法
1.1 一般资料 收集并筛选承德市中心医院2021年2—7月哮喘急性发作患者103例为病例组,其中男47例,女56例;平均年龄(56.38±12.50)岁。另选取同期于我院健康体检者95例作为对照组,其中男50例,女45例;平均年龄(53.17±8.39)岁。两组一般资料比较,差异无统计学意义(P>0.05)。纳入标准:(1)病例组均符合支气管哮喘防治指南(2020年版)中哮喘急性加重期特点:呼吸道症状(喘息、气促、咳嗽、胸闷等)突然发生,或原有症状加重,并以呼气流量降低为其特征;(2)年龄及吸烟情况不限;(3)获得患者知情同意,签署知情同意书,并能配合完成整个试验过程。排除标准:(1)呼出气一氧化氮测定不能配合者;(2)合并影响FeNO水平的肺部疾病,如慢性阻塞性肺疾病、阻塞性睡眠呼吸暂停低通气综合征、弥漫性间质肺疾病等;(3)合并影响血清IL-13水平的其他疾病,如溃疡性结肠炎、肺结核、恶性肿瘤等;(4)入组前1周内全身应用糖皮质激素的患者。
1.2 方法
1.2.1 呼出气一氧化氮测定:采用FeNO检测仪(无锡市尚沃医疗电子股份有限公司)收集呼气流速为50ml/s和200ml/s时气道FeNO浓度,即FeNO50、FeNO200。为提高检测结果准确性,要求受试者检测前3h内禁食特殊食物,如西兰花、芹菜、莴笋及腌制食品等含氮或精氨酸的食物;1h内禁吸烟、剧烈运动。FeNO检测的全过程均在同一专业人员指导下规范、正确地完成,单位以ppb表示。
1.2.2 血清IL-13检测:抽取观察对象肘静脉空腹血3ml,室温静置30~60min后,进行离心(3 500r/min,离心时间10min)。采用生物素双抗体夹心法酶联免疫吸附试验(ELISA),试剂盒为人白细胞介素13(IL-13)ELISA检测试剂盒(上海赫湃生物科技有限公司提供),严格参照说明书进行操作。单位以pg/ml表示。
1.2.3 ACT评分问卷:参照《支气管哮喘防治指南2020年版》ACT问卷及评分标准内容,包括针对患者过去4周内哮喘对日常活动的影响、呼吸困难情况、哮喘症状对睡眠的影响、急救药物的使用情况及哮喘控制情况的自我评价5个问题,每个问题对应5个答案选项,每个答案对应不同分值。病例组患者入院当日给予发放ACT评分问卷,指导或辅助其完成作答,并汇总分数。
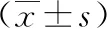
2 结果
2.1 两组呼出气一氧化氮浓度、血清IL-13比较 病例组FeNO50、FeNO200、血清IL-13水平均高于对照组,差异有统计学意义(P<0.001),见表1。
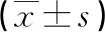
表1 两组呼出气一氧化氮、血清IL-13水平比较
2.2 病例组患者血清IL-13与其他指标的相关性 病例组患者ACT评分为7~21分,平均ACT评分为(15.35±2.77)分。Pearson相关性分析显示,病例组患者血清IL-13与FeNO50、FeNO200呈正性相关(r=0.506、0.439,P<0.01),与ACT评分呈负性相关(r=-0.356,P<0.01),见图1~3。
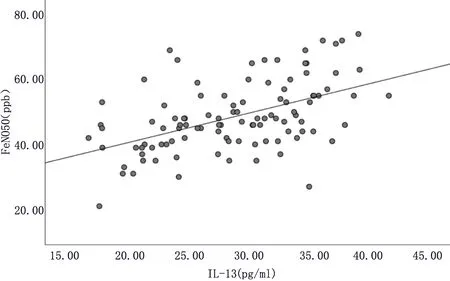
图1 哮喘组IL-13与FeNO50评分的相关性

图2 哮喘组IL-13与FeNO200评分的相关性

图3 哮喘组IL-13与ACT评分的相关性
3 讨论
哮喘患病率呈逐年上升趋势,目前全球约3亿人群罹患哮喘,在国内20岁以上患哮喘的人数达4 570万[4]。哮喘具有不同的潜在疾病过程。过敏性炎症、嗜酸性炎症和气道上皮细胞失调都参与严重哮喘发病机制。痰EOS在支气管哮喘的发病机制中起重要作用,但诱导痰操作复杂。近年,许多研究将痰嗜酸性粒细胞转移到外周血及其他研究上。
内源性NO由人体内一氧化氮合酶催化L-精氨酸产生。当气道受到炎症介质刺激时,存在于气道上皮、内皮细胞的诱导型一氧化氮合酶(iNOS)被激活,从而使气道产生的NO增多。众多研究显示,哮喘患者呼出气一氧化氮(FeNO)显著高于非哮喘人群[5]。FeNO测定依靠、简单快速、非侵入性及可重复操作等优势,在临床应用中较容易被患者接受。哮喘患者气道病变涉及大、小气道和肺泡,导致不同程度的气道高反应性和支气管收缩。使用不同呼气流速可以分别检测到中央气道和外周小气道或肺泡产生的NO的水平:当低流速(50ml/s)口呼气时,检测到的FeNO(即FeNO50)能反映约75%的大气道和25%的小气道炎症水平;高流速(200ml/s)口呼气时,检测到的FeNO(即FeNO200)主要反映小气道及肺泡的炎症水平[6]。本文中两组FeNO50均高于FeNO200,考虑NO扩散可能与气道直径及结构相关。
Th2型炎症以过敏性和(或)嗜酸性炎症参与哮喘过程,是哮喘发病、肺功能下降、气道高反应、急性加重甚至失控的根本原因。IL-13可以通过过敏性及嗜酸性炎症途径促使气道NO水平升高[7],目前关于血清IL-13与小气道NO水平的研究较少,本研究不仅旨在验证血清IL-13能使大气道(中央气道)NO水平升高,也欲探究其与小气道或肺泡NO水平的关系。本文结果显示病例组血清IL-13及大、小气道NO水平均明显高于对照组,提示以上指标可以反映气道存在炎症。病例组血清IL-13与FENO50、FENO200均存在一定的正相关关系(r=0.506、0.439,P<0.01);相对于FeNO200,血清IL-13与能代表大气道炎症的FeNO50的相关性较强,这一结论验证了血清IL-13可以使气道NO水平升高,但其作用机制究竟是通过过敏性炎途径还是通过嗜酸性炎症途径,亦或两途径结合来上调iNOS,需要进一步研究证明。
在缺乏肺功能设备的医院可以依靠ACT大致了解患者病情严重程度,哮喘控制越好,ACT评分越高,但其仅能反映哮喘症状,不能具体反映气道炎症情况。本文中血清IL-13与ACT评分呈负相关关系(r=-0.356,P<0.01),相关系数不高的原因考虑与血清IL-13受全身不可控因素、炎症的个体差异及患者个体主观评价等相关。GIAN指南指出FeNO≥50ppb考虑嗜酸性气道炎症(此处FeNO代表FeNO50)。本文中病例组FeNO50在(45.54±10.70)ppb水平,可见病例组患者存在不同炎症表型。有研究显示,在出现哮喘症状和肺功能下降之前,FeNO就已经开始升高[8]。遂血清IL-13联合大、小气道FeNO检测对哮喘早期诊断以及未来判断治疗效果具有优势,动态监测指标变化对气道炎症趋势的评估及药物疗效的评估价值匪浅。
综上所述,哮喘急性发作患者气道炎症水平与病情严重程度相关,临床上单独依靠呼出气NO指标或血清学指标来评估哮喘急性发作期患者这一群体的病情,都是不完全可靠的,单纯大气道一氧化氮(FeNO50)水平检测易忽略小气道持续炎症的存在,使病情评估不完整,会造成治疗效果大减。至今我国尚无体现小气道或肺泡一氧化氮的参考值及临床应用的相关指南,因此需要大量数据研究来制定适用于国人的截断值及指南,需要多中心、大样本、更全面的研究明确观点。

