circ_HECTD1在癫痫模型细胞中的表达及其对细胞凋亡和炎症反应的影响
吕麦扣,席 聪
癫痫是一种中枢神经系统慢性疾病,由脑部神经元同步化异常放电导致,临床表现的主要特征为短暂性、反复性、发作性和刻板性,目前仍缺乏有效的预防和治疗措施[1]。神经元损伤是癫痫发作的最终结果,也是引起癫痫再发及形成难治性癫痫的主要原因[2]。因此,寻找有效的减轻神经元损伤的方法具有重要意义。环状RNA(circular RNAs,circRNAs)是一类具有5′末端帽子和3′末端 poly A尾结构的单链环状、共价闭合的非编码RNA,可通过多种机制广泛调控多种疾病的进程[3-4]。研究表明,circRNAs与中枢神经系统发生发展密切相关[5]。含HECT结构域的E3泛素链接酶(HECT domain E3 ubiquitin ligase,HECTD1)在多种细胞中均有表达,且发挥多种功能[6-7]。研究显示,在小鼠短暂性大脑中动脉闭塞模型中,缺血脑组织中circ_HECTD1表达升高,急性缺血性脑卒中病人血浆样本circ_ HECTD1表达升高,抑制circ_HECTD1表达可减少梗死面积,减轻神经元损伤[8]。circ_HECTD1对癫痫的影响及机制尚未明确。因此,本研究建立无镁癫痫模型细胞,检测沉默circ_HECTD1表达对海马神经元细胞活力、凋亡率及炎性因子表达的影响,并进一步研究其作用机制。
1 材料与方法
1.1 实验材料 健康的24 h新生SD大鼠,由西安交通大学医学院实验动物中心提供。动物操作按照西安交通大学实验动物伦理要求进行。DMEM/F12培养基、胎牛血清、蛋白酶K均购自美国Gibco公司;四唑盐(MTT)、二甲基亚砜(DMSO)、多聚赖氨酸均购自美国Sigma公司;DNA断裂的原位末端标记法(TUNEL)试剂盒购自德国Roche公司;SDS-PAGE凝胶制备试剂盒、5×蛋白上样缓冲液、BCA蛋白定量试剂盒、ECL发光液均购自碧云天生物技术有限公司;B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、cleaved caspase 3和核转录因子-κB(nuclear factor kappa-B,NF-κB)/p65抗体及辣根过氧化物酶(HRP)标记的二抗均购自美国Abcam公司;酶标仪购自美国Bio-Rad公司;倒置荧光显微镜购自日本Nikon公司;circ_HECTD1小干扰RAN(si-circ_HECTD1)、小干扰RNA阴性序列(si-NC)购自上海生工生物工程有限公司。
1.2 海马神经元的原代培养 取新生24 h的SD大鼠,75%乙醇消毒全身,无菌条件下断头取脑,置于解剖液中,光学显微镜下使用解剖镊分离海马组织,剔除掉脑膜和血管,眼科剪将组织剪成小块(1 mm3),加等体积的胰酶消化5 min,期间轻摇2次,用含10%血清的DMEM/F12完全培养基终止消化,反复吹打至无肉眼可见的团块。细胞经70 μm滤筛过滤,4 ℃离心,弃掉上清,加入神经元培养基,巴氏管吹打混匀,调整细胞浓度为4×105个/mL,接种于经多聚赖氨酸(0.1 mg/mL)包被的培养皿中,置于5%体积分数CO2、37 ℃、饱和湿度的培养箱培养。培养12~24 h后,更换为神经元维持培养基,之后每3~4 d换液1次,倒置显微镜观察细胞形态,将生长良好的神经元细胞作为实验材料。
1.3 实验分组及癫痫模型的建立 实验分为4组。对照组:取培养10 d的海马神经元,正常细胞外液洗涤(1 min×3次),加入正常细胞外液,于5 %体积分数CO2、37 ℃培养箱培养3 h,更换为维持液继续培养24 h。无镁致痫组(无镁组):取培养10 d的原代海马神经元,无镁细胞外液洗涤(1 min×3次),于5%体积分数CO2、37 ℃培养箱培养3 h进行无镁诱导,恢复维持液继续培养24 h。无镁+si-NC组:取培养10 d的海马神经元,加终浓度为100 nmol/L的si-NC,反应30 min进行无镁诱导,恢复维持液继续培养24 h。无镁+si-circ_HECTD1组:取培养10 d的海马神经元,加终浓度为100 nmol/L的si-HECTD1,反应30 min进行无镁诱导,恢复维持液继续培养24 h。
1.4 实时荧光定量逆转录聚合酶链反应(qRT-PCR)检测circ_HECTD1、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)表达 应用Trizol法提取细胞总RNA,ODNano Drop 2000分光光度计检测RNA浓度,OD260/OD280比值在1.8~2.0以内且纯度合格RNA用于实验。按照逆转录试剂盒说明逆转录为cDNA。按照试剂盒说明配置PCR反应体系及设置反应条件,其中反应体系为20 μL,所用引物由上海生工生物工程有限公司设计合成。每组设置5个复孔,以GAPDH作为内参基因,以所得Ct均值,采用2-△△Ct法计算circ_HECTD1、IL-6和IL-1β基因表达。实验重复3次。
1.5 MTT比色法检测细胞活力 以1×105个/mL密度接种各组神经元细胞于96孔板,每孔100 μL细胞悬液,细胞培养至单层铺满孔底时,向每孔中加MTT溶液(5 mg/mL)10 μL,于37 ℃培养箱孵育4 h,吸除孔内培养液,在每孔中加150 μL的DMSO,放置于摇床上低速震荡10 min使结晶溶解充分。酶标仪测定波长为490 nm处的吸光度值(OD)。每组设置5个复孔,实验重复3次。
1.6 TUNEL法检测细胞凋亡 种植海马神经元细胞悬液(1×105个/mL)于包被过的细胞爬片上,按照分组处理培养,然后进行TUNEL染色。细胞爬片样本经固定液固定1 h、蛋白酶K处理15~30 min及封闭液处理10 min后,使用滤纸吸干爬片上的水分。在爬片上滴加50 μL的TUNEL反应液,置于37 ℃、暗室、湿盒加盖孵育1 h,磷酸缓冲盐溶液(PBS)洗涤。在爬片上滴加4′,6-二脒基-2-苯基吲哚(DAPI),5 min后吸出,PBS洗涤。在爬片上滴加15 μL的抗淬灭剂封片。荧光显微镜下计数死亡神经元数目。
1.7 蛋白免疫印迹法(Western Blot)检测Bcl-2、Bax、cleaved caspase 3和NF-κB/p65表达 收集各处理组细胞,每孔加适量含PMSF的RIPA细胞裂解液,放置于冰上反应15 min,转移细胞至离心管,4 ℃离心,收集上清,上清即为细胞总蛋白。应用BCA法测定蛋白浓度。按照4∶1比例将总蛋白与5×上样缓冲液混匀,100 ℃煮沸5 min使蛋白变性。根据蛋白样品浓度计算上样体积,经SDS-PAGE电泳、转膜、封闭后,倒去封闭液,加一抗稀释液(1∶1 000稀释的Bcl-2、Bax、cleaved caspase3和NF-κB/p65抗体),4 ℃孵育过夜,洗膜。加二抗稀释液(1∶2 000稀释的HRP标记抗体),置于摇床上孵育1.5 h,洗膜。膜含蛋白面滴加ECL显色液,曝光、显影、定影,Image J软件分析灰度值。实验重复3次。

2 结 果
2.1 circ_HECTD1在癫痫模型细胞中的表达 与对照组比较,无镁组和无镁+si-NC组circ_HECTD1表达明显升高,差异均有统计学意义(P<0.05);与无镁+si-NC组比较,无镁+si-circ_HECTD1组circ_ HECTD1表达明显降低,差异有统计学意义(P<0.05)。详见表1。
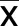
表1 各组circ_HECTD1在癫痫模型细胞中的表达比较 (±s)
2.2 沉默circ_ HECTD1表达对无镁诱导的神经元细胞活力和凋亡的影响 与对照组比较,无镁组和无镁+si-NC组细胞活力明显降低,凋亡率明显升高,差异均有统计学意义(P<0.05);与无镁+si-NC组比较,无镁+si-circ_HECTD1组细胞活力明显升高,凋亡率明显降低,差异均有统计学意义(P<0.05)。详见表2。
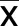
表2 各组神经元细胞活力和凋亡率比较 (±s)
P<0.05。
2.3 沉默circ_ HECTD1表达对无镁诱导的神经元细胞Bcl-2、Bax和cleaved caspase 3表达的影响 与对照组比较,无镁组和无镁+si-NC组Bcl-2表达明显降低,Bax和cleaved caspase 3表达明显升高,差异均有统计学意义(P<0.05);与无镁+si-NC组比较,无镁+si-circ_HECTD1组Bcl-2表达明显升高,Bax和cleaved caspase 3表达明显降低,差异均有统计学意义(P<0.05)。详见图1、表3。

图1 各组神经元细胞Bcl-2、Bax和cleaved caspase 3表达条带图
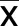
表3 各组神经元细胞Bcl-2、Bax和cleaved caspase 3的蛋白相对表达量比较 (±s)
2.4 沉默circ_ HECTD1表达对无镁诱导的神经元细胞IL-6和IL-1β表达的影响 与对照组比较,无镁组和无镁+si-NC组IL-6和IL-1β表达明显升高,差异均有统计学意义(P<0.05);与无镁+si-NC组比较,无镁+si-circ_HECTD1组IL-6和IL-1β表达明显降低,差异均有统计学意义(P<0.05)。详见表4。
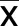
表4 各组神经元细胞IL-6和IL-1β表达比较(±s)
P<0.05。
2.5 沉默circ_ HECTD1表达对无镁诱导的神经元细胞NF-κB/p65表达的影响 与对照组比较,无镁组和无镁+si-NC组NF-κB/p65表达明显升高,差异均有统计学意义(P<0.05);与无镁+si-NC组比较,无镁+si-circ_HECTD1组NF-κB/p65表达明显降低,差异有统计学意义(P<0.05)。详见图2、表5。

图2 各组神经元细胞NF-κB/p65表达条带图
表5 各组神经元细胞NF-κB/p65的蛋白相对表达量比较 (±s)
P<0.05。
3 讨 论
circRNA是一种环形非编码RNA,可通过抑制miRNA的功能参与炎症、神经系统疾病、肿瘤等多种疾病的发生发展[9-10]。研究发现,在人体各组织中,脑组织circRNA含量最高[11]。在神经发育过程中,在大脑的各部位circRNA水平均较高,提示在中枢神经系统发育过程中circRNA可能发挥重要作用[12-13]。神经细胞损伤包括凋亡和坏死,神经细胞损伤是癫痫发生发展的一个重要原因[14-15]。在癫痫发作后,部分神经元损伤可通过调控Bcl-2/Bax、caspase家族等与凋亡相关的基因途径实现[16]。Bcl-2发挥抗凋亡作用抑制细胞凋亡,而Bax发挥促凋亡作用促进细胞凋亡。Bcl-2量大于Bax量时可抑制细胞凋亡,反之细胞凋亡增加[17]。caspase 3是caspase家族成员之一,发挥核心作用,其活化后可引起细胞凋亡[18]。本研究结果显示,无镁诱导的神经元细胞中circ_HECTD1表达升高,细胞活力降低,凋亡率升高,而抑制circ_HECTD1表达细胞活力增加,凋亡率降低,提示circ_HECTD1表达升高可能是引起神经元细胞损伤的原因之一。
多项研究表明,脑部炎症是癫痫形成及发作的一个重要机制,癫痫和炎症间存在相互作用[19]。有研究表明,IL-1β、IL-6、TNF-α等多种炎性因子及相关受体参与癫痫发作[20]。在大脑中IL-1β及其受体分布广泛,尤其在海马中密度最高,有研究报道,在癫痫发作前IL-1β已升高,且持续至癫痫活动结束,提示IL-1β可能通过增加神经元敏感性,从而促进癫痫发生[21]。IL-6是一种糖蛋白,由中枢神经系统产生,在正常状态下,IL-6浓度很低,而在神经元异常活动或中枢神经系统损伤时IL-6可大量产生,有研究显示,在癫痫发作后,血清中IL-6浓度增加,提示IL-6可能通过影响神经元从而提高癫痫的易感性[22]。有研究显示,急性缺血性脑卒中circ_HECTD1表达与IL-6、TNF-α等促炎因子相关[23]。本研究结果显示,抑制circ_HECTD1表达可明显降低无镁诱导的神经元细胞IL-1β和IL-6表达。提示抑制circ_HECTD1表达可降低癫痫炎症反应。
NF-κB是一类可与免疫球蛋白κ轻链基因增强子κB序列结合的蛋白因子,p50/p65异源二聚体是该家族成员之一,也是发挥主要作用的因子,在神经细胞中广泛存在,特别是大鼠海马及皮质区域[24]。多项研究表明,NF-κB的过度活化可参与急性炎症过程,参与突触可塑性变化、神经元凋亡等过程,其过度激活可加重癫痫的发病[25]。本研究结果显示,抑制circ_HECTD1表达可明显降低无镁诱导的神经元细胞NF-κB/p65表达。
综上所述,抑制circ_HECTD1表达可降低无镁诱导的海马神经元细胞凋亡及炎症反应,其机制可能与抑制NF-κB信号的过度活化有关。目前,circ_HECTD1对癫痫的影响研究较少,值得进一步深入探究。

