SD大鼠生殖发育毒性试验背景数据的建立
沈 姣,陆冰冰,卢 凡,高庆发,乔红群,岳 鹏,刘 晶
(1.江苏省药物安全性评价中心,江苏省药物研究所有限公司,江苏 南京 210009;2.南京工业大学药学院,江苏 南京 211816)
在药物研发过程中,生殖与发育毒性评估是药物非临床安全性评价的重要内容,与急性毒性、长期毒性和遗传毒性等毒理学研究有密切联系,是药物进入临床研究及上市的重要环节。生殖毒性研究的目的是通过动物试验反映受试物对哺乳动物生殖功能和发育过程的影响,预测其可能产生的对生殖细胞、受孕、妊娠、分娩、哺乳等亲代生殖功能的不良影响,以及对子代胚胎-胎儿发育和出生后发育的不良影响[1]。生殖毒性研究在限定临床研究受试者范围、降低临床研究受试者和药品上市后使用人群的用药风险方面发挥重要作用。生殖毒性研究主要包括3个试验阶段:生育力和早期胚胎发育试验(Ⅰ段)、胚胎-胎仔发育试验(Ⅱ段)和围产期发育试验(Ⅲ段)。
根据国际人用药物生殖与发育毒性检测(International Council for Harmonization,ICH)(S5)[2]和国家食品药品监督管理总局(China Food and Drug Administration,CFDA)[3]的指导原则,因为其使用范围广且背景数据充分,生殖毒性试验啮齿类动物通常选用大鼠。本文归纳了2018-2020年江苏省药物安全性评价中心生殖毒性(Ⅰ、Ⅱ、Ⅲ段)研究项目并对其中溶媒对照(饮用水)组SD大鼠相关数据进行收集和统计分析,建立了生殖毒性指标的背景数据库,为药物生殖毒性安全评价的开展和结果分析提供数据参考。
1 材料与方法
1.1 动物、药物和仪器
所有试验使用8~9周龄SPF级SD大鼠,均购于北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006,饲养于江苏省药物安全性评价中心SPF级动物房,动物使用许可证号:SYXK(苏)2016-0032,室温控制在20~26℃,相对湿度控制在40%~70%,维持12 h/12 h光/暗循环(工作照明>200 Lux,动物照明15~20 Lux),换气次数≥15次·h-1,噪声≤60 dB,自由饮水,饲喂SPF维持鼠粮(江苏省协同医药生物工程有限公司)。所有研究均用于GLP条件下的生殖毒性安全性评价试验,均经江苏省药物安全性评价中心动物管理与使用委员会审核批准。溶媒对照组均使用实验动物饮用水,均为本中心自制,通过南京市质检所检查合格;大鼠胚胎-胎仔发育毒性试验中阳性对照均使用注射用环磷酰胺(江苏恒瑞医药有限公司,规格为200 mg·瓶-1),用氯化钠注射液配制成0.35 g·L-1溶液。生物显微镜(XSD-24N,南京江南永新光学公司);CO2安乐死系统〔凌云博际(北京)科技有限公司〕;电子天平(AR1530,上海精密科学仪器有限公司);电子计重秤(BT418W,深圳博途电子科技有限公司);连续变倍体视显微镜(XTB-1,南京江南永新光学公司);动物精子活力分析仪(SCA,ESP,西班牙MICROPTIC S.L.公司);电子天平和电子计重秤每年均通过南京市计量监督检测院计量的检定。
1.2 试验方法
Ⅰ段、Ⅱ段和Ⅲ段试验用大鼠在检疫期结束后均为9-10周龄,已达到体成熟和性成熟。溶媒对照组均采用灌胃给予实验动物饮用水,为10 mL·kg-1;Ⅱ段试验中阳性对照组大鼠均灌胃给予环磷酰胺3.5 mg·kg-1,为10 mL·kg-1。依据《药物生殖毒性研究技术指导原则》要求,每组参与统计的动物数需≥20只,实际各试验在剖检后均满足该要求。
Ⅰ段试验中,动物在检疫期结束后依据动物体重随机分为溶媒对照组和受试物组,每组雌雄大鼠各24只;雄鼠给药4周,雌鼠给药2周后按照雌雄比1∶1合笼交配,交配期不超过3个雌鼠发情周期(一个交配周期为5天,包括动情前期、动情期、动情后期和动情间期)。合笼次日后对雌鼠进行阴道涂片检查,查见精子或阴栓确定为妊娠第0日(gestation day 0,GD0)。雌雄大鼠在交配期间持续给药,雄鼠交配成功当日处死剖检,未交配成功雄鼠于交配期结束后剖检;受孕大鼠持续给药至GD6,GD14解剖。
Ⅱ段试验适应完成后雌雄大鼠按照2∶1进行合笼交配,次日查笼,查见精子或阴栓当日定为孕鼠GD0,孕鼠按照随机分组方法分配至溶媒对照组、受试物组和阳性对照组,每组24只孕鼠。孕鼠于GD6-15给药,GD20解剖。
Ⅲ段试验中,亲代(founder 0,F0)雌雄大鼠在检疫期结束后交配、查笼、动物数和体重分组(方法与Ⅱ段试验相同),分为溶媒对照组和受试物组。亲代母鼠定义为F0代,分娩当日记为分娩第0日(postnatal day 0,PND0),于 GD15-PND21给药,PND21解剖,观察F0代母鼠脏器指标。分娩后的子代定义为F1(filial generation 1,F1)代。F0代分娩后于PND4每窝筛选出5雄5雌,共计5对F1代仔鼠,其中1对用于行为学试验;3对用于PND35天解剖,观察仔鼠脏器指标;另外1对用仔鼠出生后10周(Week,W)后的同组不同窝交配,观察子代的生育和交配能力(方法与Ⅰ段试验相同)
1.3 分析指标
1.3.1 体重和体增重检测
Ⅰ段大鼠交配前每周进行2次称重,孕鼠于GD0,GD3,GD6,GD10和 GD14称重。Ⅱ段孕鼠于GD0,GD3,GD6,GD10,GD13,GD16和 GD20称重。Ⅲ段孕鼠于 GD0,GD3,GD6,GD10,GD14,GD17和 GD20称 重 ,Ⅲ 段 哺 乳 期 母 鼠 于 PND0,PND4,PND7,PND14和PND21称重。F1代雄雌仔鼠于PND4,PND7,PND14,PND21和 PND35称重。F1代交配雄鼠、雌鼠W6,W7,W8,W9和W10称量体重。F1代孕鼠于 GD3,GD6,GD10和 GD14称重。邻近 2次体重差值为此段时间大鼠的体增重。
1.3.2 脏器指标
Ⅰ段雄鼠记录睾丸、附睾、前列腺和精囊腺的重量。Ⅰ段雌鼠和Ⅲ段F1代用于交配的雌鼠在交配完成后GD14处死,称子宫重,检查胎盘,计数黄体数、活胎数、死胎数、吸收胎数和着床数。
Ⅱ段大鼠于GD20剖检,取出胎仔,计算黄记录、胎重(连子宫)、胎仔重、胎盘总重、胎盘外观、活胎数、死胎数、吸收胎数、性别比和身长,检查外观、内脏和骨骼检查,并计算着床数。
记录F1代交配雄鼠睾丸和附睾重。记录F0代和F1代雄雌仔鼠心、肝、脾、肺、左肾、右肾、睾丸、附睾、卵巢和子宫重。
1.3.3 F1代生长发育指标检测
检测幼仔的窝产仔数、出生体重和存活率。对幼仔进行标记,并每天观察毒性的临床迹象,直至断奶。
F1代PND筛选后的5对仔鼠,3对用于PND35后解剖,检测内脏的重量及畸形。1对同组不同窝之间交配成功后,F1代雄鼠于交配成功后解剖。F1代雌鼠于交配成功GD14解剖。
1对用于观察仔鼠的生理发育状况和行为学测试,主要包括耳廓分离、门齿萌出、睁眼、张耳、出毛、睾丸下降和阴道张开。检测仔鼠神经反射指标,主要包括平面翻正反射、空中翻正反射、负趋地性反射、视觉定位反射和断崖回避反射。
1.4 统计学分析
根据试验方案和江苏省药物安全性评价中心的标准操作规程,手动收集或用数据采集系统收集原始数据。实验结果数据采用SPSS23.0软件包统计处理。大鼠Ⅱ段试验溶媒对照组与阳性对照组结果对比时,使用t检验方法进行统计分析。除Ⅲ段试验中仔鼠生长发育指标使用中位数进行统计,其余数据均进行±s、95%置信区间(confidence interval,CI)、最大值、最小值和变异系数(coefficient of variation,CV)的统计描述。
2 结果
2.1 生育力和早期胚胎发育试验(Ⅰ段)
2.1.1 孕鼠体增重变化
在大鼠生育力和早期胚胎发育试验中,体增重结果见表1。孕鼠妊娠期体增重均>15 g·d-1,未见异常。
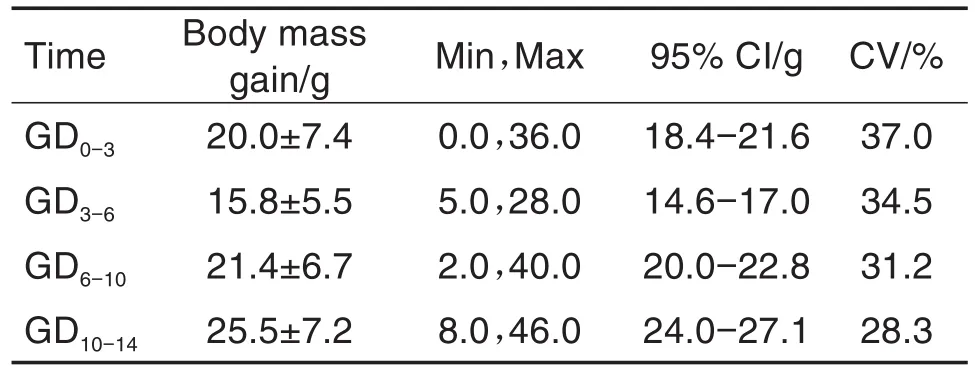
Tab.1 Body mass gain of pregnant rats in segmentⅠduring 2018-2020
2.1.2 SD雌鼠生殖发育指标
雌鼠在交配完成后于GD14处死,各检测指标结果见表2。黄体数为(16.8±1.6)个,变异系数较低为9.3%,表明黄体数变化较小,整体数据趋于稳定;吸收胎数为(0.93±1.3)个,变异系数偏高为139.7%,主要原因是由于多数动物吸收胎数为0,个别动物的吸收胎数较大,导致数据的SD值较高,对生殖发育毒性试验的毒性参考意义较小,其余数据趋于稳定。
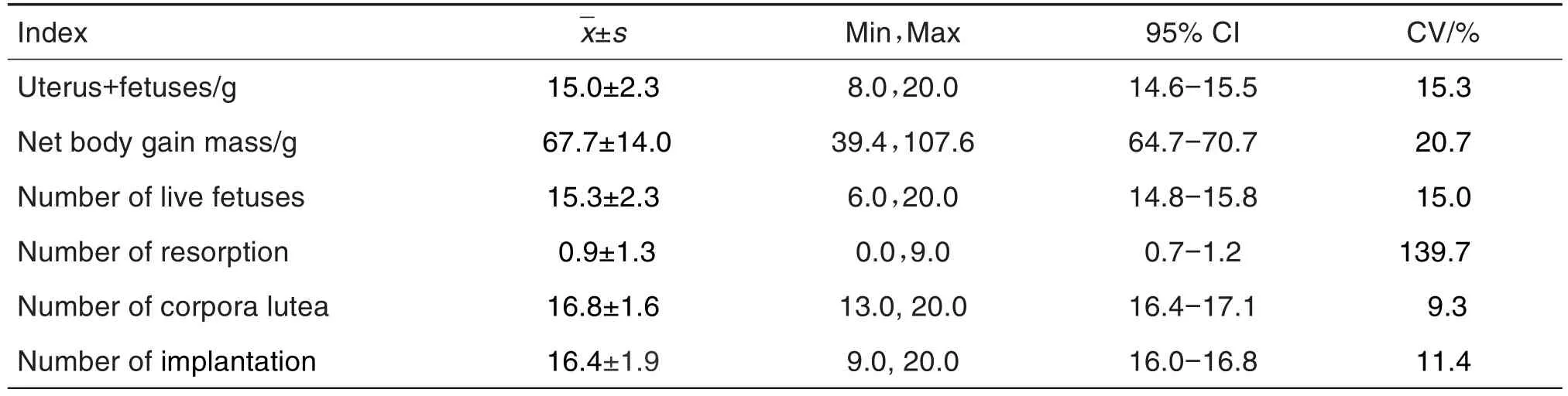
Tab.2 Reproductive indexes of pregnant rats in segmentⅠduring 2018-2020
2.1.3 SD雄性大鼠生殖器官重量
在确认雌鼠妊娠后于GD0处死雄鼠,称取睾丸、附睾、前列腺和精囊腺重量,各检查指标结果见表3。睾丸和附睾平均重量分别为3.4±0.3和(1.1±0.1)g,变异系数均较低,分别为9.5%和9.4%。
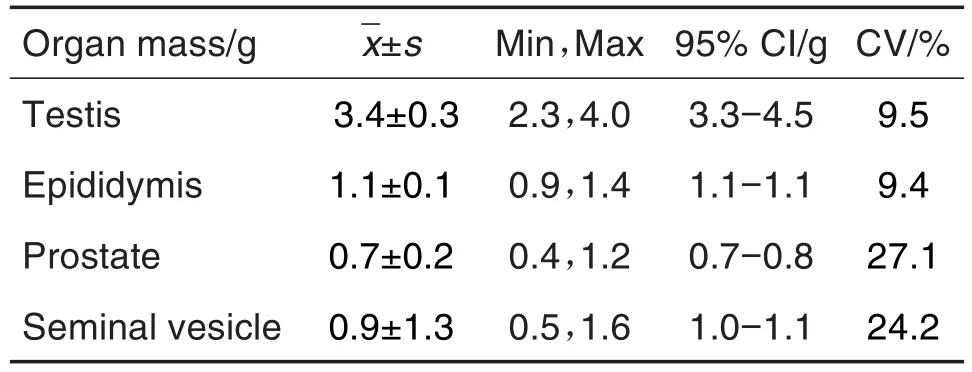
Tab.3 Organ mass of male rats in segmentⅠduring 2018-2020
2.2 胚胎-胎仔发育试验(Ⅱ段)
2.2.1 SD孕鼠体增重变化
胚胎-胎仔发育阶段溶媒对照组和环磷酰胺组孕鼠妊娠期体增重孕前期未见异常,GD16-20期间是胎仔生长发育的关键阶段,环磷酰胺GD16-20孕鼠体增重为(39.2±1.6)g·d-1,溶媒对照组为(55.1±13.7)g·d-1,环磷酰胺组孕鼠体增重显著低于溶媒对照组(P<0.05)(表4)。
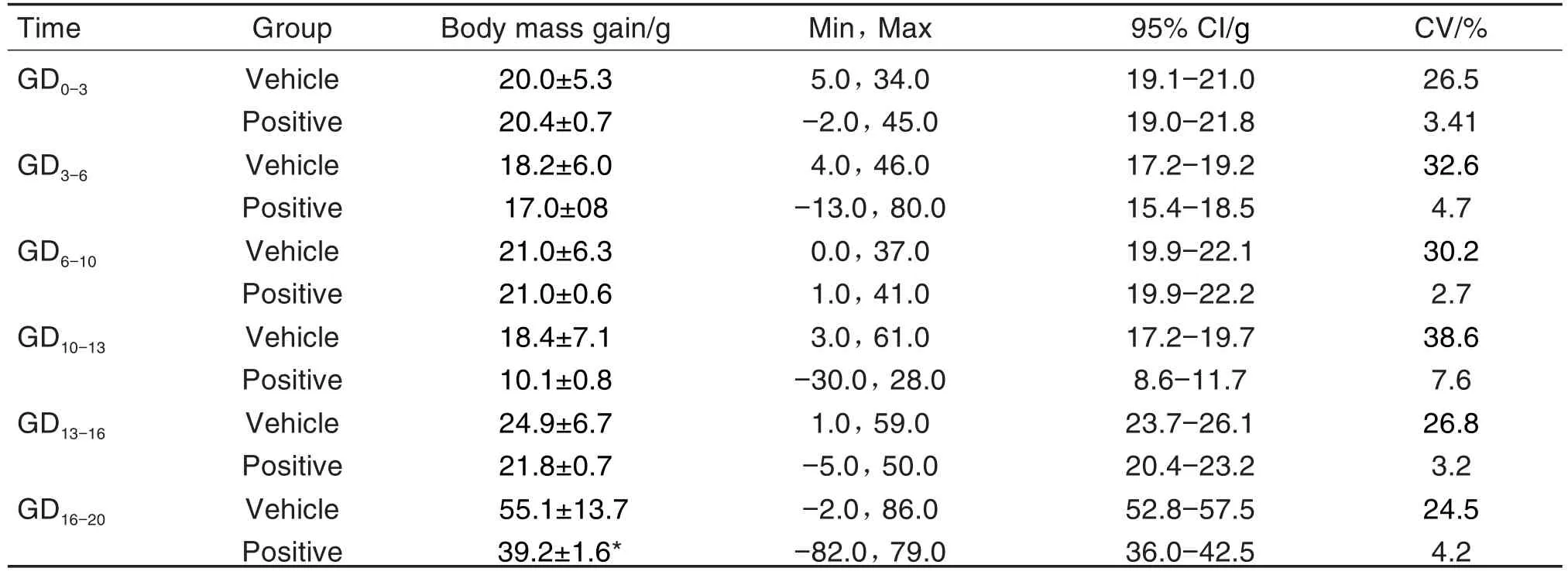
Tab.4 Body mass gain of pregnant rats in vehicle control group and positive control group in segmentⅡduring 2018-2020
2.2.2 SD孕鼠和胎仔生殖发育指标
在GD20处死孕鼠,各检查指标结果见表5。其中,环磷酰胺吸收胎数平均为(1.4±0.2)个,相较于溶媒对照组的(0.5±1.3)个显著升高(P<0.05);子宫总重、胎盘总重、胎仔重和身长阳性对照组分别为(55.4±1.6)g,(5.0±0.2)g,(2.6±0.1)g和(3.1±0.0)cm,均显著低于溶媒对照组的(80.4±17.2)g、(9.0±1.9)g、(3.8±0.4)g和(3.7±0.2)cm(P<0.05)。其余指标无明显差异。溶媒组胎仔体重和身长变异系数分别为11.52%和4.95%,表明胎仔发育较稳定。
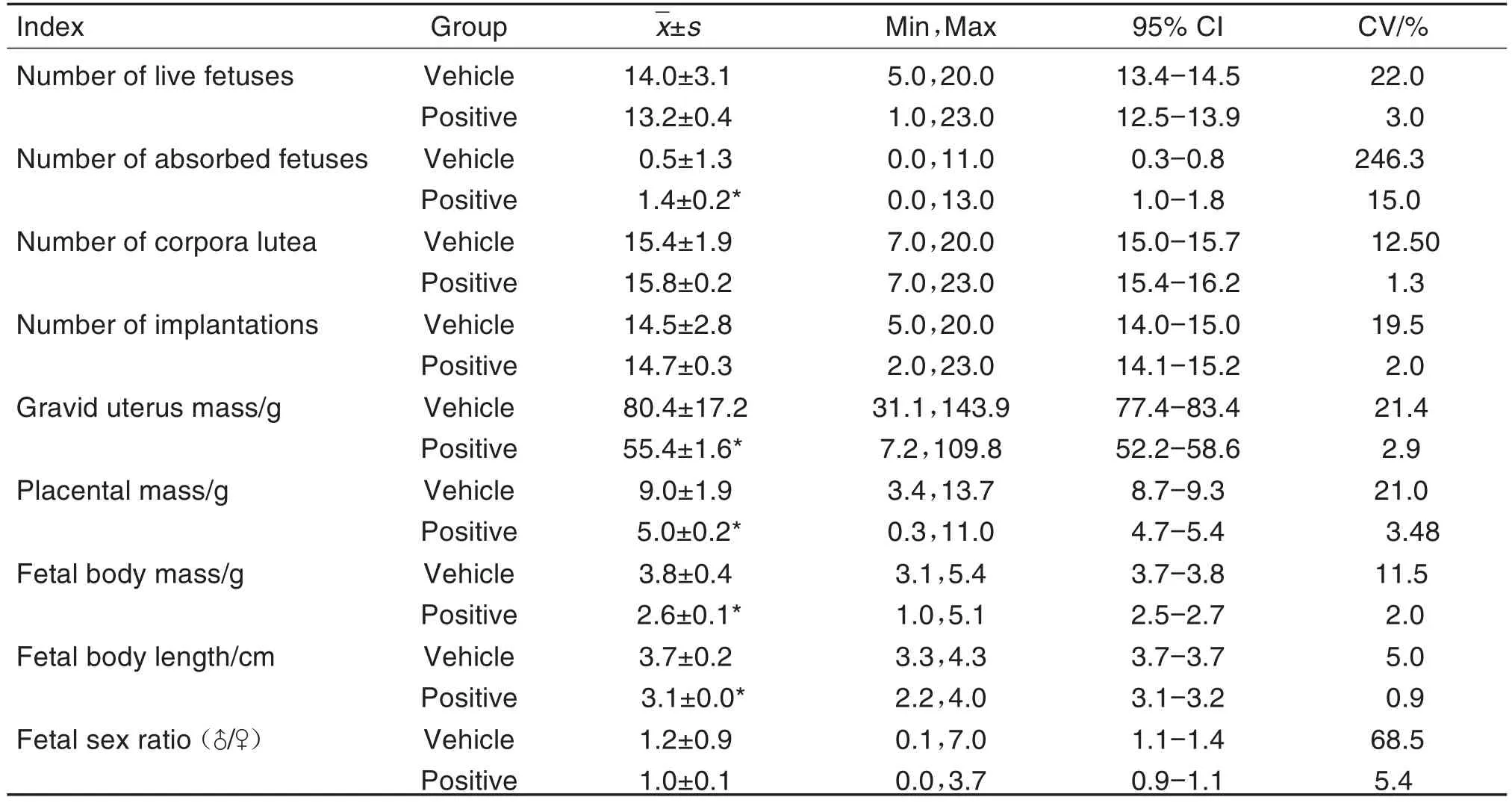
Tab.5 Reproductive indexes of pregnant rats in vehicle control group and positive control(cyclophosphamide)group in segmentⅡduring 2018-2020
2.3 围产生期发育试验(Ⅲ段)
2.3.1 F0代母鼠和F1代仔鼠体重变化
F0代母鼠孕期体增重(表6)未见异常。F0代哺乳期母鼠,由于哺乳,体重降低幅度较大;F1代仔鼠出生后前期PND0-14体重增长较缓慢;PND14后可正常进食,体重和体增重增长较快(表7)。F1代交配雌鼠、雄鼠W6体重和体增重均随着时间变化而稳定增长,并无性别差异。F1代孕鼠在妊娠期GD0-14体重和体增重稳定增加(表8和表9)。
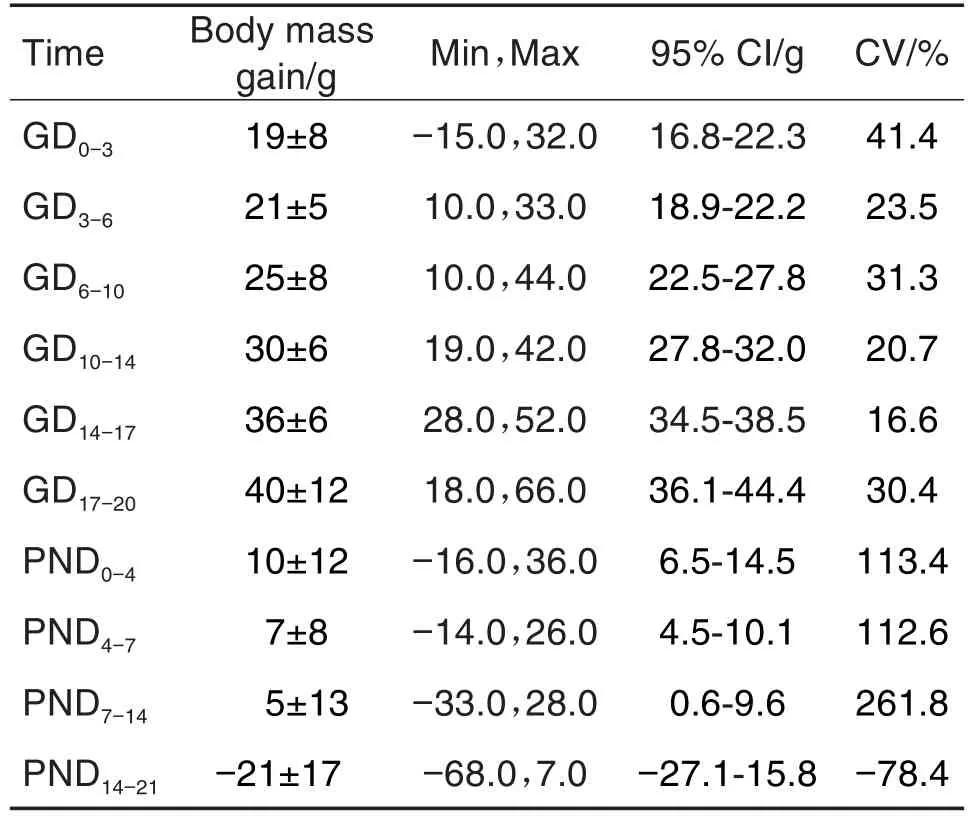
Tab.6 Body mass gain of founder(F0)pregnant rats in segmentⅢduring 2019-2020
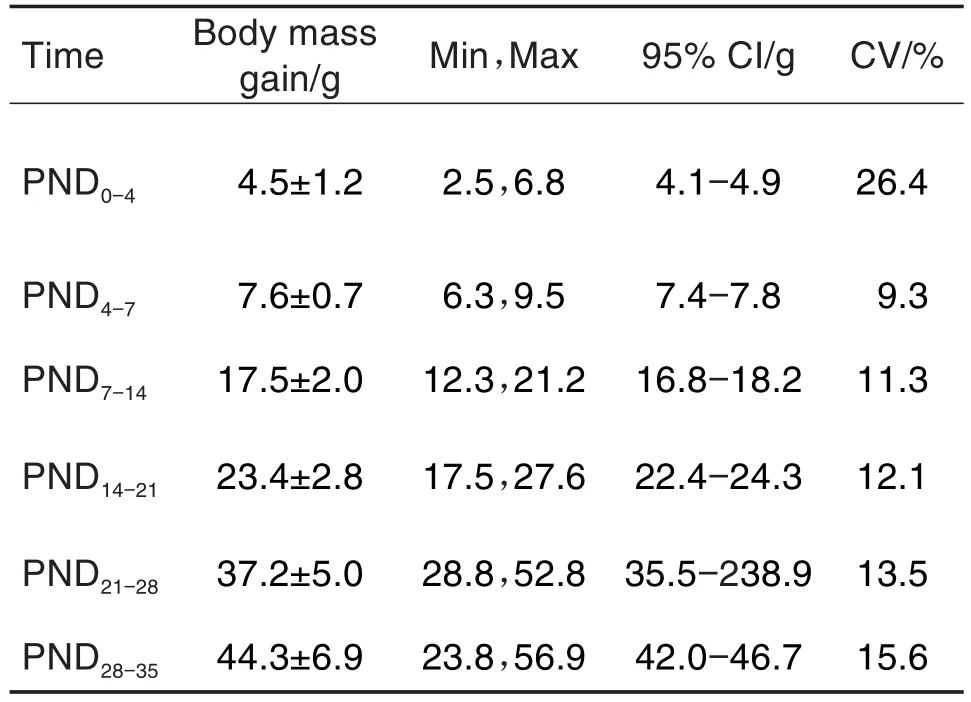
Tab.7 Body mass gain of filial generation 1(F1)offspring rats in segmentⅢduring 2019-2020
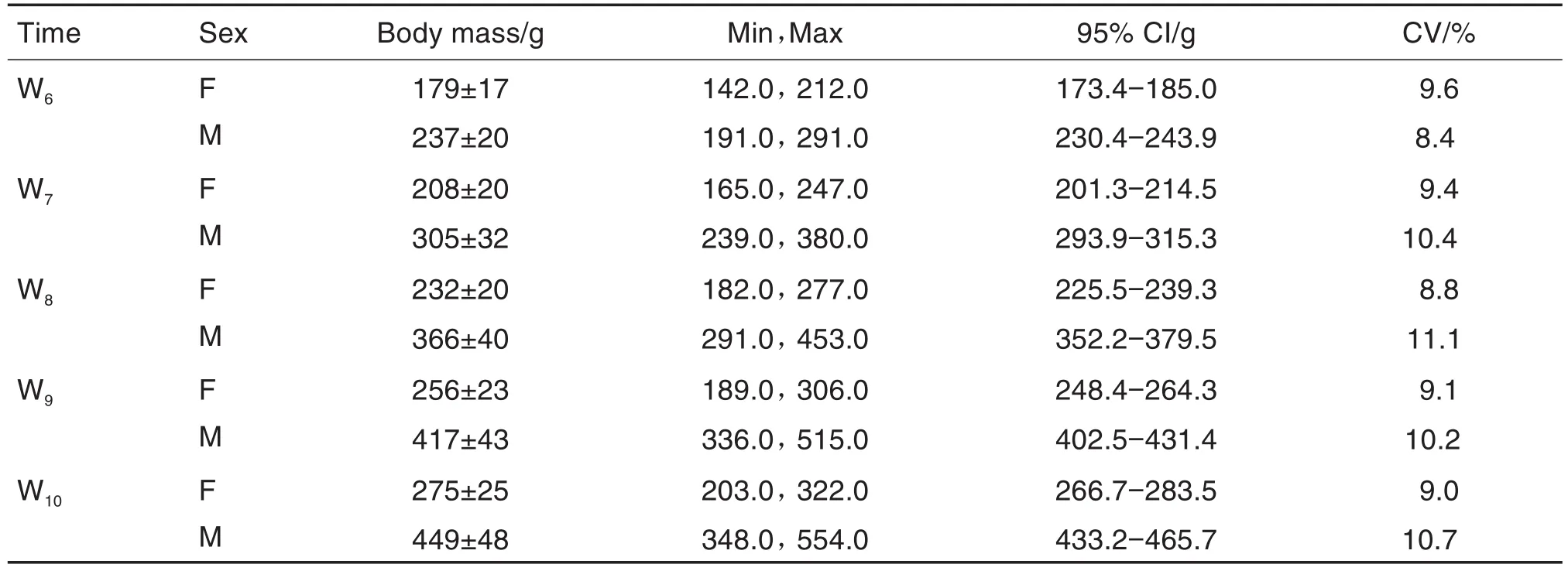
Tab.8 Body mass of F1mating rats and F1pregnant rats in segmentⅢduring 2019-2020
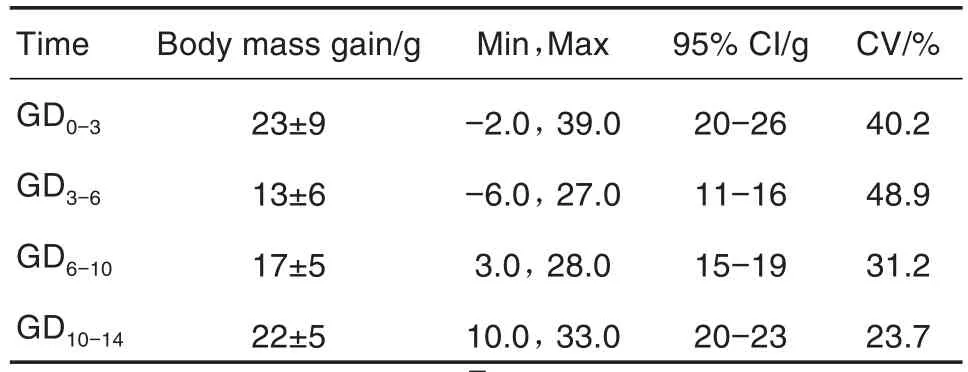
Tab.9 Body mass of F1pregnant rats in segmentⅢduring 2019-2020
2.3.2 F0代母鼠和F1代仔鼠脏器重量变化
哺乳期结束后处死F0母鼠,各项指标见表10,肺平均重量为(1.7±0.6)g,变异系数为35.1%。F1代仔鼠PND35解剖各项指标见表11,雌鼠子宫平均重量为(0.3±0.1)g,变异系数为33.2%,其余各指标结果均较稳定。
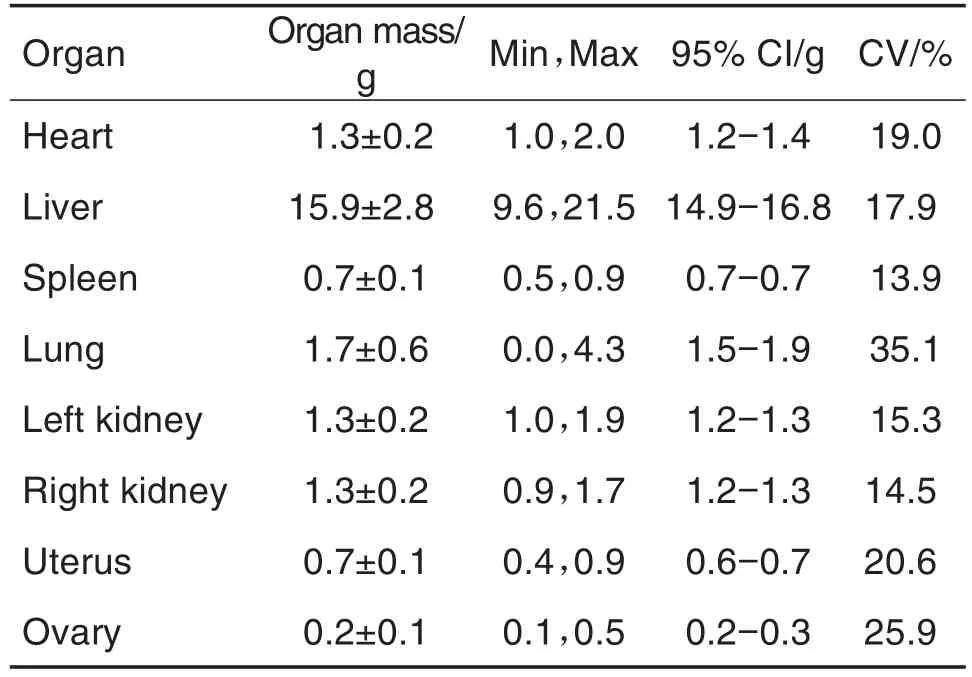
Tab.10 Organ mass of F0female rats in segmentⅢduring 2019-2020
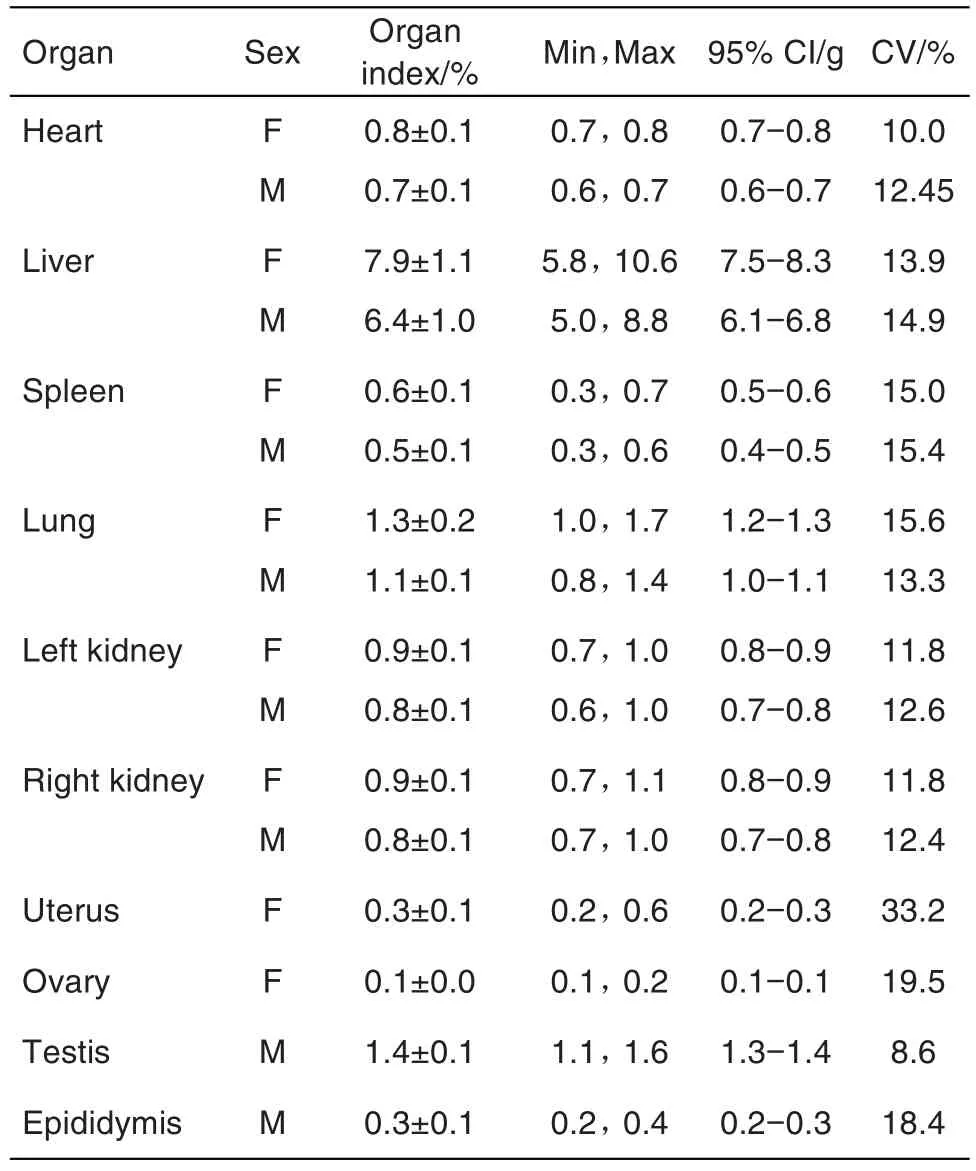
Tab.11 Organ indexes of F1rats in segmentⅢduring 2019-2020
2.3.3 F1代雄鼠和孕鼠生殖指标
在确认雌鼠妊娠后于GD0处死雄鼠,睾丸和附睾的检测结果见表12,睾丸和附睾平均重量分别为3.6±0.3和(1.2±0.1)g,变异系数分别为 8.1% 和10.2%。F1代孕鼠在交配完成后GD14处死,均无死胎,其他各项指标见表13。吸收胎数平均为(1.2±1.5)个,由于个体差异较大,导致变异系数偏高,为122.3%。
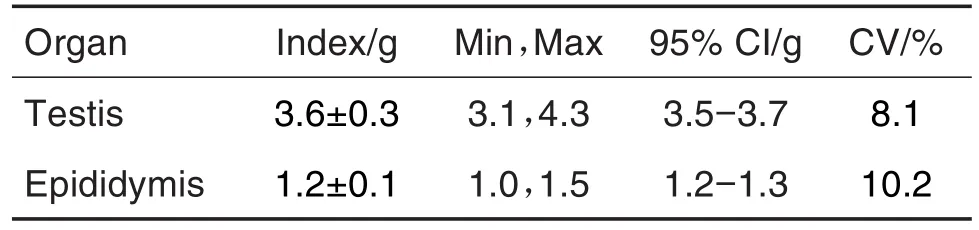
Tab.12 Organ mass of F1mating male rats in segmentⅢduring 2019-2020
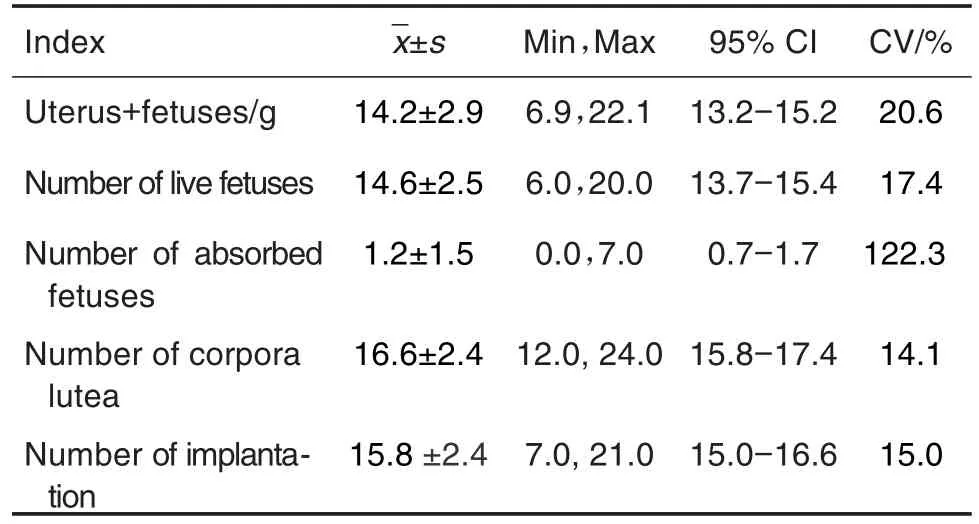
Tab.13 Reproductive index of F1pregnant rats in segmentⅢduring 2019-2020
2.3.4 F1代仔鼠生长发育指标
仔鼠耳廓分离时间中位数2019年为PND3,2020年为PND2;负趋地性反射时间中位数2019年为PND6,2020年为PND5;断崖回避反射时间中位数2019年为PND7,2020年为PND6;触须定位时间中位数2019年为PND12,2020年为PND13;阴道张开中位数时间2019年为PND32,2020年为PND33;其余各项指标这两年的数据均相同,具体各指标检查结果见表14。
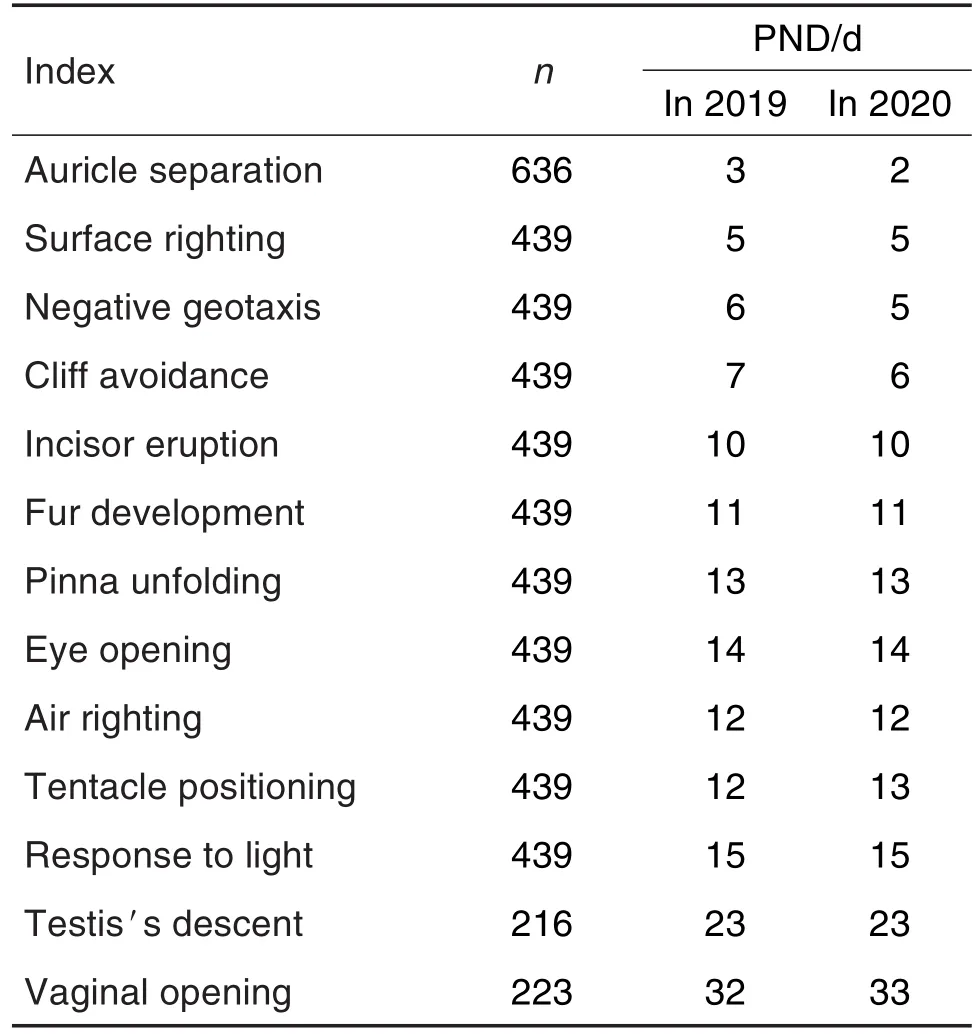
Tab.14 Physiological development and reflection development of F1offspring rats in segmentⅢduring 2019-2020
3 讨论
在生殖毒性试验中,给药动物体重和体增重的变化是评价受试物对动物是否产生毒性的非常重要指标。本GLP实验室研究发现,Ⅰ段、Ⅱ段和Ⅲ段SD孕鼠妊娠期体重变化均为逐渐增加趋势,这与国内外相关报道一致[4-5]。在Ⅲ段试验中,SD母鼠因为哺乳期哺乳,体增重下降幅度较大,同时期的仔鼠体重随着时间增加而增加,反映了大鼠实际的生理情况。
黄体数、着床数、活胎数、吸收胎数和死胎数等指标是衡量胚胎早期和晚期发育毒性的重要指标。本GLP实验室生殖Ⅰ段中的平均黄体数(16.8±1.6)个,平均着床数(16.4±1.9)个,平均活胎数(15.3±2.3)个。王蓉等[6]研究报道,平均黄体数(14.5±1.3)个,平均着床数(13.4±1.3)个,平均活胎数(13.0±1.4)个,与本研究结果相近。生殖Ⅱ段中的平均黄体数(15.4±1.9)个,平均着床数(14.5±2.8)个,平均活胎数(14.0±3.1)个,平均吸收胎数(0.53±1.31)个。贾玉林等[7]、孔卫青等[8]、叶向峰等[9]和Noritake等[10]研究报道,平均黄体数分别为(12.8±2.1),(15.6±2.8),(15.5±2.5)和16.0个,平均着床数分别为(11.8±2.8),(13.6±3.7)和(14.2±3.2)和 14.7个,平均活胎数分别为(11.5±2.8),(12.8±3.7),(13.4±3.5)和14.1个,与本研究结果亦相近。生殖Ⅲ段中的平均黄体数(16.6±2.4)个,平均着床数(15.8±2.4)个,平均活胎数(14.6±2.5)个,平均吸收胎数为(1.2±1.5)个,现有文献少见有关于Ⅲ段以上相关指标的报道。与本中心Ⅰ段和Ⅱ段试验指标相比,Ⅲ段以上指标无统计学显著性差异。同时,与溶媒组相比,Ⅱ段试验中阳性对照组母体生育、胎仔发育各项指标呈现出显著差异,表明了本中心相关技术体系的可靠性。
Ⅱ段试验中,胎仔重、胎盘重、身长和性别比是评价药物对胎仔的生长发育是否产生毒性的指标[7]。本GLP实验室中平均胎盘总重(9.0±1.9)g,平均胎仔重(3.8±0.4)g,性别比为1.0。贾玉林等[7]、孔卫青等[8]、叶向峰等[9]和Noritake等[10]研究报道,平均胎盘总重(7.8±2.0)g,平均胎仔重分别(3.8±0.4)、(3.9±0.3),3.7和(4.0±0.8)g,性别比分别为1.0,0.9,1.0和0.9,与本研究结果相近。
器官重量是最敏感的药物毒性指标之一,其变化往往先于形态变化。Piao等[11]和崇立明等[12]研究表明,雄性大鼠的心、肝、脾、肺和肾等器官的绝对重量均高于雌性大鼠。本实验室Ⅲ段毒性试验中F1代仔鼠雄性的脏器重量均高于雌性,与上述报道一致。在生殖Ⅰ段中睾丸平均重量(3.3±0.3)g,附睾平均重量(1.1±0.1)g;生殖Ⅲ段中睾丸平均重量(3.5±0.3)g,附睾平均重量(1.2±0.1)g,并无显著差别。
仔鼠门齿萌出、皮毛发育、平面翻正、张耳、睁眼、空中翻正、视觉定位、睾丸下降的时间与肖百全等[13]研究报道无显著差别。
通过对本中心2018-2020年各阶段生殖毒性试验结果的研究汇总,各溶媒对照组SD大鼠试验数据分布均一,基本稳定,初步建立了本中心SD大鼠Ⅰ~Ⅲ段生育和发育指标的背景数据。随后将进行继续补充和完善,并使其更加规范化和标准化,保证试验系统的正确性及所获数据的可靠性,为生殖毒性安全性评价提供科学依据,也可为其他同行实验室提供一定参考。

