不同频率电针对内淋巴积水豚鼠耳蜗形态及血浆 cAMP、AQP2的影响
蒋丽元,史莹莺,叶恬恬
(1.杭州市中医院,杭州 310007;2.杭州市丁桥医院,杭州 310022;3.浙江中医药大学,杭州 310053)
梅尼埃病(meniere's disease, MD)是耳源性眩晕病中的常见疾病[1],其病理基础是内淋巴积水(endolymphatic hydrops, EH)[2]。研究普遍认为 MD发病机制与血浆血管加压素(arginine vasopressin,AVP)水平的病理性升高有关[3]。动物实验表明,经AVP诱导产生的EH主要是通过调节AVP-cAMP-AQP2信号通路实现的[4]。MD目前缺乏有效治疗方案。国内临床报道显示电针在改善MD患者眩晕、耳鸣、听力下降、耳闷方面效果显著[5-6]。前期实验发现电针干预能显著降低模型豚鼠的EH,改善耳蜗听觉[7],但当前研究尚未能对电针治疗MD的最佳频率产生统一认识,不同频率电针对MD的疗效及其具体作用机制如何,都是亟待解决的问题。本研究采用临床上较为常用的低频、高频电针研究其对 EH模型豚鼠耳蜗积水程度及螺旋神经节超微结构的影响,旨在探索电针促进EH恢复的优选频率,并从cAMP、AQP2角度分析其关键机制。
1 材料与方法
1.1 实验动物
清洁级健康雄性白毛红目豚鼠共 65只,体质量350 g左右,由浙江中医药大学动物实验研究中心提供[SYXK(浙)2013-0184]。豚鼠均饲养在浙江中医药大学动物实验研究中心,实验室温度 20 ℃~25 ℃,相对湿度40%~65%,每日光照12 h,豚鼠自由摄食、饮水。实验前豚鼠在同等标准环境内适应性饲养1周。实验中对动物的处理符合科技部颁发的《关于善待实验动物的指导性意见》的相关规定。
1.2 主要试剂
醋酸去氨加压素(1-deamino-8-D-arginine vasopressin, DDAVP)(海南中和制药股份有限公司生产,货号 20170701);环磷酸腺苷酶联免疫分析(enzyme linked immunosorbent assay, ELISA)试剂盒(上海江莱生物科技有限公司生产,货号 JL12116);水通道蛋白2 ELISA试剂盒(上海江莱生物科技有限公司生产,货号JL21011)。
1.3 分组与模型制备
65只豚鼠按随机数字表法分为空白组、模型组、针刺组、2 Hz电针组、100 Hz电针组,共 5组,每组13只(8只用于耳蜗HE染色病理形态观察,5只用于透射电镜超微结构观察)。空白组豚鼠不予处理,其余各组豚鼠采用腹腔注射醋酸去氨加压素建立EH模型[8]。先按4 μg/kg给予腹腔注射,连续注射7 d后将剂量增大为 6 μg/kg,连续注射3 d,共10 d。模型评价以耳蜗HE染色病理形态观察为准[9]。
1.4 干预方法
空白组不干预,仅常规饲养。模型组实验时仅将豚鼠进行固定。各电针组于造模结束后进行干预,针刺百会穴及左侧听宫穴,百会穴定位在两耳连线与头顶正中线交点,听宫穴定位在侧面耳屏正前方凹陷处[10]。实验时,固定豚鼠,用0.18 mm×13 mm毫针平刺百会穴,进针深度 2 mm,正刺左侧听宫穴,进针深度 3 mm,连接HANS-100A型镇痛电针仪。电流输出强度为1 mA,频率分别为2 Hz和100 Hz,电针20 min,每日1次,连续干预10 d。针刺组将毫针直接刺入百会穴和左侧听宫穴,除不接电针外,其余按照与电针组相同的操作方法和时间干预处理。
1.5 指标检测
1.5.1 一般情况比较
比较豚鼠精神状态、身型、毛发、步态、自主活动情况、耳廓反应等。
1.5.2 血浆cAMP、AQP2浓度检测
干预结束后麻醉动物,心脏取血,离心得到血浆。采用ELISA法检测血浆cAMP、AQP2浓度。
1.5.3 耳蜗积水程度观察
豚鼠取血后,以 4%多聚甲醛溶液灌注至豚鼠颈项强直、四肢僵硬后,断头,快速取出左侧听泡并打开,取出颞骨,将颞骨标本置于 4%多聚甲醛固定液中,固定过夜后将标本置于 10%乙二胺四乙酸溶液脱钙至针刺无阻力,梯度乙醇溶液脱水,二甲苯透明,石蜡包埋。沿耳蜗蜗轴中央平面切片,每片厚约4.5 μm,行HE染色,光镜下观察并拍片。
1.5.4 中阶面积/(中阶面积+前庭阶面积)变化
通过前庭膜隆起程度,并计算中阶面积/(中阶面积+前庭阶面积)变化评估耳蜗积水程度[5]。正常情况下,耳蜗前庭膜平直,与基底膜约呈45°角(见图1a)。前庭膜将基底膜以上的空间分为两部分,即前庭阶和中阶。当内淋巴液增加时,前庭膜向前庭阶方向聚拢,前庭膜隆起(见图 1b),即表示发生 EH。运用 Image ProPlus 6.0系统测量中轴一侧第二转中阶、前庭阶面积,计算中阶面积/(中阶面积+前庭阶面积)占比。
1.5.5 耳蜗螺旋神经节超微结构观察
豚鼠麻醉后(方法同前),快速取出左侧听泡,用1 mL注射器吸取预冷的2.5%戊二醛固定液灌流。将标本在4 ℃冰箱固定2 d后,经超薄切片机半薄切片,钻石刀超薄切片,染色,用 H-7650透射电镜观察耳蜗螺旋神经节超微结构并拍摄照片。
1.6 统计学方法
采用SPSS19.0统计软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示。若方差齐则组间比较采用单因素方差分析,进一步两两比较采用LSD法。以P<0.05表示差异具有统计学意义。
2 结果
2.1 5组豚鼠一般情况比较
模型组豚鼠精神状态较空白组显著下降,自主活动降低,常群聚蜷缩,对外界声音不灵敏,饮食减少,体质量增加缓慢,毛发蓬乱不柔顺,发黄,曾出现过自发性眼震,时间无规律。各治疗组豚鼠精神状况、皮毛光亮程度、饮食、体质量、自发活动、自发眼震情况与模型组比较无差别,但耳廓反应灵敏度与模型组比较,均有所改善。
2.2 5组豚鼠耳蜗形态观察
空白组豚鼠均未出现 EH,前庭阶、鼓阶、蜗管结构无异常;经醋酸去氨加压素处理后,模型组出现 EH,表现为前庭膜向前庭阶方向隆起扩张;针刺组、2 Hz电针组、100 Hz电针组前庭膜隆起病理情况均较模型组不同程度改善;100 Hz电针组前庭膜隆起程度较2 Hz电针组、针刺组减轻,2 Hz电针组、针刺组前庭膜隆起程度无明显差异。详见图1。
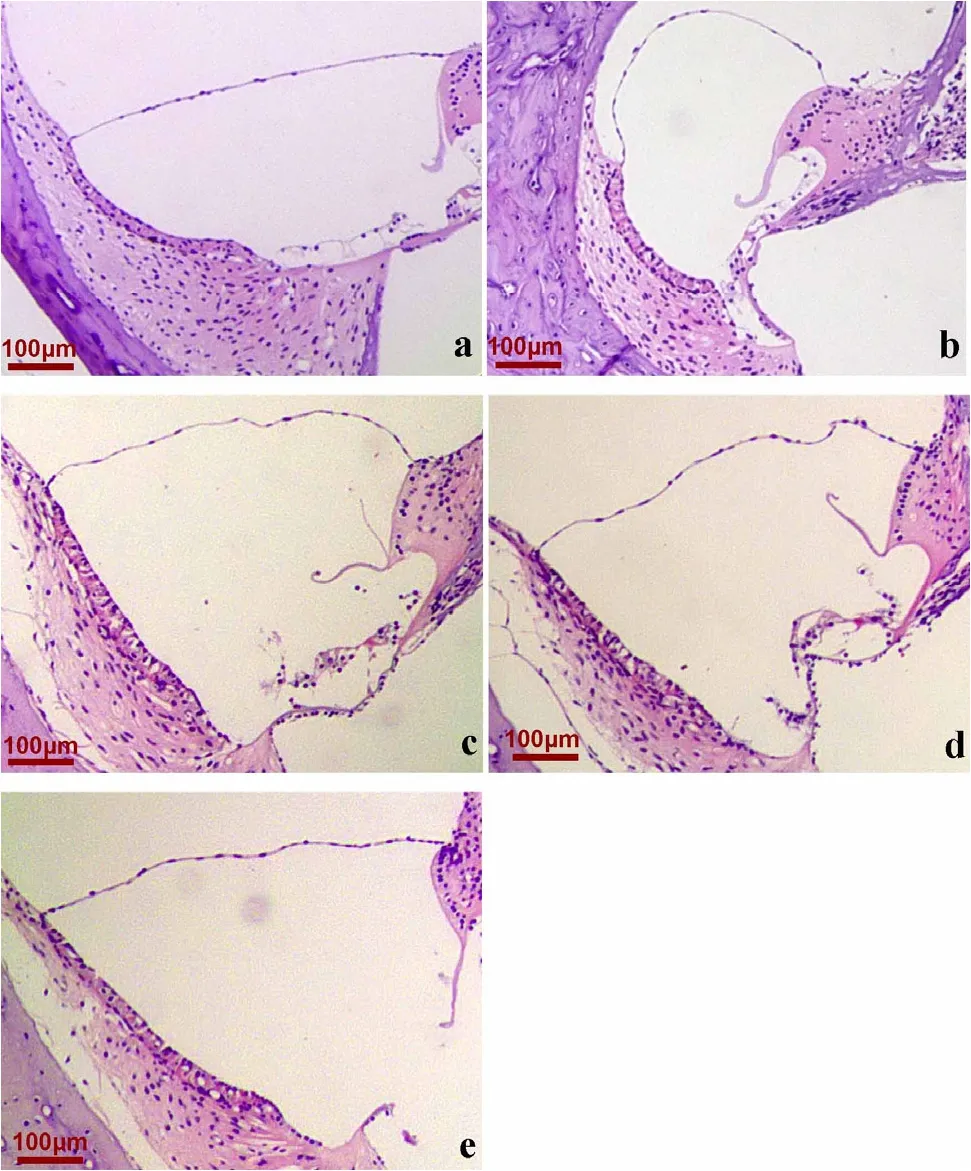
图1 耳蜗形态组织病理学观察(HE染色,×50)
2.3 5组豚鼠中阶面积/(中阶面积+前庭阶面积)占比比较
与空白组比较,模型组豚鼠耳蜗中阶面积/(中阶面积+前庭阶面积)占比升高(P<0.01);与模型组比较,各治疗组豚鼠耳蜗中阶面积/(中阶面积+前庭阶面积)占比均降低(均P<0.01);与针刺组比较,100 Hz电针组中阶面积/(中阶面积+前庭阶面积)占比降低(P<0.05),2 Hz电针组中阶面积/(中阶面积+前庭阶面积)占比与针刺组比较差异无统计学意义(P>0.05);与2 Hz电针组比较,100 Hz电针组中阶面积/(中阶面积+前庭阶面积)占比降低(P<0.05)。详见表1。
表1 耳蜗中阶面积/(中阶面积+前庭阶面积)占比比较(±s)
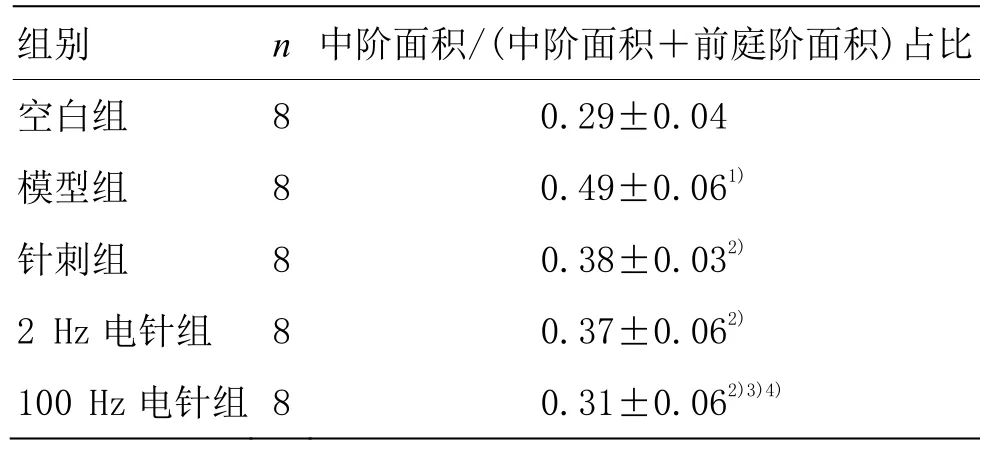
表1 耳蜗中阶面积/(中阶面积+前庭阶面积)占比比较(±s)
注:与空白组比较 1)P<0.01;与模型组比较 2)P<0.01;与针刺组比较 3)P<0.05;与 2 Hz 电针组比较 4)P<0.05
组别 n 中阶面积/(中阶面积+前庭阶面积)占比空白组 8 0.29±0.04模型组 8 0.49±0.061)针刺组 8 0.38±0.032)2 Hz 电针组 8 0.37±0.062)100 Hz 电针组 8 0.31±0.062)3)4)
2.4 5组豚鼠耳蜗螺旋神经节超微结构观察
空白组豚鼠耳蜗螺旋神经节髓鞘完整,细胞内结构整体良好,线粒体内嵴结构清晰,呈卵圆形,无肿胀溶解,内质网均匀分布。模型组螺旋神经节髓鞘严重松解,细胞内结构散乱,线粒体数量减少,内嵴肿胀断裂,呈空泡状,粗面内质网脱颗粒。经干预后,各治疗组螺旋神经节超微结构得到改善,髓鞘小部分松解,线粒体数目与空白组基本无异,内嵴可见,少部分嵴断裂,肿胀程度下降,可见部分粗面内质网,其中100 Hz电针组改善更明显。详见图2。
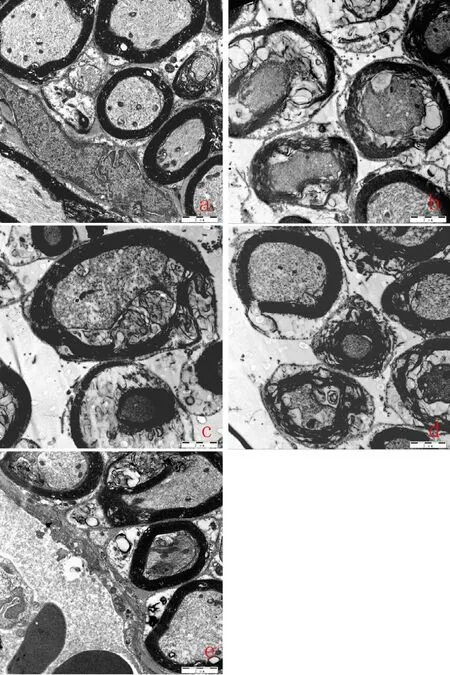
图2 各组豚鼠螺旋神经节超微结构变化(甲苯胺蓝与醋酸铀-枸橼酸铅染色,×4 000)
2.5 5组豚鼠血浆cAMP浓度比较
与空白组比较,模型组血浆 cAMP浓度升高(P<0.01);与模型组比较,各治疗组豚鼠血浆cAMP浓度均降低(P<0.05);与针刺组比较,100 Hz电针组血浆cAMP浓度降低(P<0.01);与2 Hz电针组比较,100 Hz电针组豚鼠血浆cAMP浓度降低(P<0.01)。详见表2。
表2 各组豚鼠血浆cAMP浓度比较 (±s)
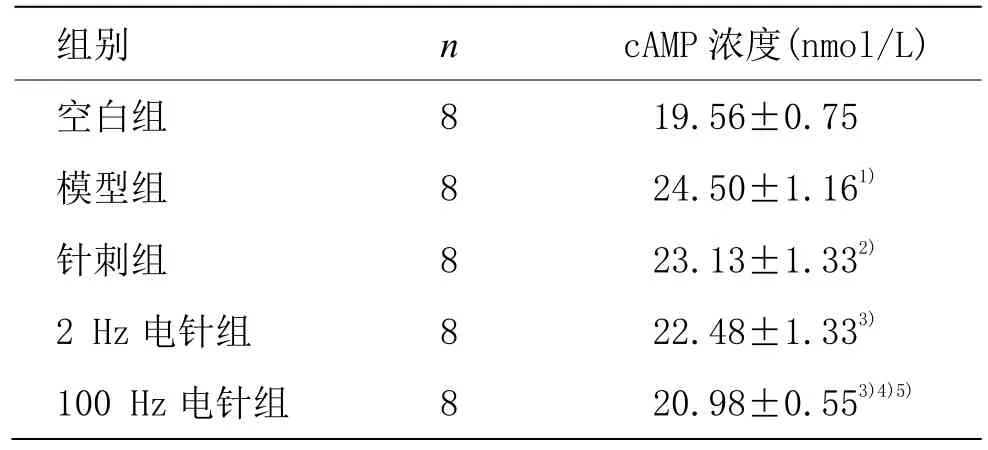
表2 各组豚鼠血浆cAMP浓度比较 (±s)
注:与空白组比较 1)P<0.01;与模型组比较 2)P<0.05,3)P<0.01;与针刺组比较 4)P<0.01;与 2 Hz 电针组比较 5)P<0.01
组别 n cAMP 浓度(nmol/L)空白组 8 19.56±0.75模型组 8 24.50±1.161)针刺组 8 23.13±1.332)2 Hz 电针组 8 22.48±1.333)100 Hz 电针组 8 20.98±0.553)4)5)
2.6 5组豚鼠血浆AQP2浓度比较
与空白组比较,模型组豚鼠血浆 AQP2浓度升高(P<0.01);与模型组比较,各治疗组豚鼠血浆AQP2浓度降低(P<0.05);与针刺组比较,100 Hz电针组血浆AQP2浓度降低(P<0.05),2 Hz电针组血浆AQP2浓度与针刺组比较,差异无统计学意义(P>0.05);与 2 Hz电针组比较,100 Hz电针组血浆AQP2浓度降低 (P<0.01)。详见表3。
表3 各组豚鼠血浆AQP2浓度比较 (±s)
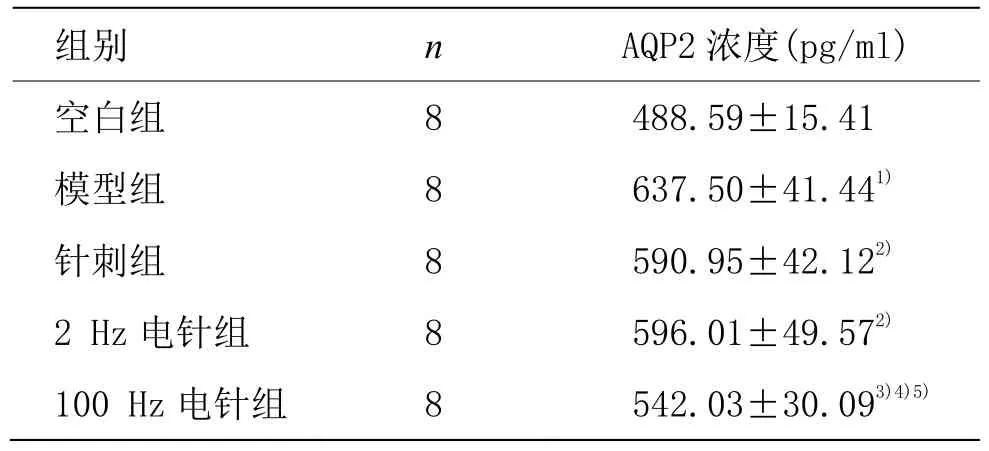
表3 各组豚鼠血浆AQP2浓度比较 (±s)
注:与空白组比较 1)P<0.01;与模型组比较 2)P<0.05,3)P<0.01;与针刺组比较 4)P<0.05;与 2 Hz 电针组比较 5)P<0.01
组别 n AQP2 浓度(pg/ml)空白组 8 488.59±15.41模型组 8 637.50±41.441)针刺组 8 590.95±42.122)2 Hz 电针组 8 596.01±49.572)100 Hz 电针组 8 542.03±30.093)4)5)
3 讨论
有研究发现梅尼埃病(meniere's disease, MD)患者的内淋巴积液分级可以用来预测梅尼埃病患病严重程度[11],但耳蜗结构精细复杂,通过该技术在体观察实验动物耳蜗积水程度仍未得到广泛应用。本实验继续采用离体研究方法观察耳蜗前庭膜隆起程度以评估内耳膜迷路积水程度,进一步比较治疗对MD病理形态的改善作用。
临床研究表明,MD患者在眩晕急性发作前后1周(急性期)伴有血浆血管加压素(arginine vasopressin, AVP)水平的升高[3]。之后的研究证实AVP-cAMP-AQP2信号通路中AVP下游的各个作用因素在内耳中均存在,使 AVP在内耳水液代谢及内淋巴积水(endolymphatic hydrops, EH)发生发展中的作用逐渐得到关注[12]。目前研究普遍认为AVP诱导产生的EH主要是通过调节 AVP-cAMP-AQP2信号通路实现的[4]。研究者通过背皮下植入胶囊微量渗透压泵及腹腔注射给入AVP的方法诱导豚鼠EH模型,病理切片检测提示模型成功率为 100%[9,13]。TAKEDA T等[13]从建立的 EH模型中观察到,模型动物血浆AVP浓度与临床MD患者发作急性期血浆AVP浓度一致。经AVP处理复制的EH模型考虑到了临床中诱发MD发作的危险因素,既可诱导EH病理结果的发生,又能较好地模拟人类MD的病理因素及发病过程,模型也更与MD临床特点相贴近。本实验根据文献,采用腹腔注射给入AVP的方法造模,评价电针对EH的干预效应;同时通过观察AVP下游因子cAMP及 AQP2的表达变化,有利于阐述电针对内耳 EH的干预机制。研究发现模型组豚鼠耳蜗均出现 EH,电子显微镜下表现为前庭膜向前庭阶方向不同程度隆起,计算中阶面积/(中阶面积+前庭阶面积)占比高于空白组,与课题组前期研究结果相符[14-15],同时经 AVP诱导的EH模型豚鼠耳蜗螺旋神经节细胞结构发生损害,并使血浆cAMP、AQP2浓度升高,与空白组比较差异均有统计学意义。
脑功能成像研究提示耳部疾病会促使相关大脑区域的神经元代谢异常。如薛伟等[16]的研究表明,耳鸣患者脑桥、丘脑、颞上回、边缘系统、皮层等脑功能区域连接异常。另有研究[17]发现,MD发作期与间歇期患者均存在静息态双侧海马区域功能连接差异。针刺穴位可通过激活或调整有功能连接的多个靶脑区发挥治疗作用。电针刺激方法的特点是参数可控、明确且稳定,并能代替人做长时间的持续运针,是常用的针灸疗法之一。关于电针的相关研究,课题组已经积累了较多的实践经验。前期的实验研究已证实电针百会、听宫穴能改善EH模型豚鼠的耳蜗积水程度,且优于针刺、艾灸疗法[7]。作为前期工作的延伸,本实验进一步观察电针干预EH的量效关系及其具体机制。电针频率是影响针刺疗效的关键。电针镇痛的相关研究提示,使用不同频率电针刺激相同腧穴,可选择性地激活大脑皮层,发挥特定作用[18]。另有研究表明,低频(2 Hz)电针对坐骨神经分支选择性损伤诱导的神经病理痛早期(造模后 3 d)镇痛效果最明显,而高频(100 Hz)电针对完全弗氏佐剂诱导的慢性炎性痛早期(造模后 3 d)镇痛效果最明显[19]。在慢性传输型便秘的研究中发现,高频(100 Hz)电针刺激对改善慢性传输型大鼠的结肠传输功能优于低频(2 Hz)电针刺激[20]。王颖等[21]研究表明,运用不同频率电针治疗能提高阿尔茨海默病模型大鼠的记忆能力,且高频(50 Hz)电针治疗效果胜于低频(2 Hz、30 Hz)电针。但目前尚未有文献解释治疗 MD的更佳电针频率。本次实验研究中,采用高频(100 Hz)及低频(2 Hz)电针干预EH模型豚鼠以探究结论。结果显示,采用2 Hz、100 Hz电针以每日1次的频次治疗耳蜗积水,均获得良好效果;且与低频(2 Hz)电针比较,高频(100 Hz)电针疗效更佳。
耳蜗螺旋神经节位于耳蜗蜗螺旋小管内,是内耳中离子与水通道蛋白代谢活跃的部位之一[22-23]。研究表明,DDAVP可引起水液代谢相关蛋白如上皮细胞钠离子通道蛋白在耳蜗螺旋神经节表达增加[24],使内耳水液代谢发生变化。本实验研究结果显示,经AVP诱导的EH模型螺旋神经节髓鞘严重松解,线粒体数量明显减少,线粒体肿胀、内嵴断裂,呈空泡状。电针及针刺干预使螺旋神经节超微结构得到改善,髓鞘小部分松解,线粒体肿胀程度减轻,其中100 Hz电针组改善更明显。既往的研究证实,电针刺激穴位可使组织细胞超微结构得到改善,降低线粒体肿胀程度、空泡化及细胞排列不规则程度,电针具有保护线粒体形态结构的作用,改善线粒体结构及功能的破坏,提供能量代谢水平[25],与本研究结果相符合。
近年来,AVP-cAMP-AQP2信号通路与EH发生机制的研究不断深入。研究发现 cAMP参与介导了以 AVP为触发点途径的AQP2表达改变及水液代谢过程。腺苷酸环化酶是cAMP信号通路中的重要一环,研究发现腺苷酸环化酶主要在与内淋巴液循环密切相关的部位(如血管纹、螺旋神经节、纤维细胞等),AVP或V2R激动剂的应用可激活腺苷酸环化酶,增加 cAMP表达[26],说明耳蜗中存在cAMP介导的AVP依赖信号转导机制。研究[27]发现,MD患者血浆AVP水平升高的同时,内淋巴囊 cAMP表达水平上调及活性增强,体外实验显示 MD患者内淋巴囊cAMP对AVP的敏感性增强。有研究[28]应用cAMP拮抗剂碳酸锂治疗MD,结果使患者眩晕发作频率降低,眩晕症状减轻。通过动物实验证实氯化锂可使动物耳蜗及内淋巴囊AQP2 mRNA及蛋白表达水平降低,EH程度减轻。推测锂化物通过减少内耳cAMP生成,减轻cAMP介导的磷酸化作用,使AQP2表达水平及通道开放程度降低,EH程度减轻[29]。本实验研究结果显示,经腹腔注射AVP诱导的豚鼠EH模型血浆cAMP、AQP2浓度增加,电针及针刺干预均可使EH豚鼠血浆内异常升高的cAMP、AQP2水平降低。本课题组之前的研究结果显示,针刺可使EH豚鼠模型耳蜗及内淋巴囊中过度升高的cAMP、AQP2明显降低[30],与本研究结果相符[26]。
综上所述,针刺及电针刺EH模型豚鼠“百会”“听宫”穴均可以调节其cAMP、AQP2血浆含量,减轻螺旋神经节细胞结构损害。这些共同参与了针刺对耳蜗积水的改善作用。针刺可能通过调控AVP-cAMP-AQP2系统使全身 AQP2表达下调,水通道开放程度降低,减轻耳蜗螺旋神经节细胞与细胞间血管水肿及线粒体空泡化变性程度,改善EH模型豚鼠血管纹超微结构的病理状态,减轻 EH。实验结果还提示,无论频率高低,电针治疗均对EH模型豚鼠血浆cAMP、AQP2水平有良性调整作用,但血浆cAMP、AQP2水平的降低及耳蜗螺旋神经节细胞结构的改善在高频电针(100 Hz)的疗效下更为明显,此结果可能为解释 100 Hz高频电针减轻 EH更优于2 Hz低频电针机制提供依据。本实验是仅在相同刺激时间及刺激强度条件下,以频率为 2 Hz(低频)和 100 Hz(高频)的电针进行实验的探究性思考,但除了以上条件,关于电针治疗 MD还存在许多额外的影响。因此在今后的探索中,还应进一步对研究其他电针参数(如电针强度、留针时间、疗程等)的干预效应,并分析其具体机制。同时,轧造影剂增强核磁共振技术已广泛运用于人类内耳疾病的研究,其成像能够清晰显示内耳具体生理结构及病理改变。因此在后续实验中,应关注核磁共振技术对于实验结果成像的反映情况,进一步减少实验误差,验证实验规律。

