TUBB8 基因突变相关女性不孕的研究进展
李曈月,翁静
女性受孕过程涉及多种细胞的多次分裂分化及精细的激素调节。我国学者已对环境、生活习惯、自身抗体、生殖系统疾病与女性不孕的关系进行了丰富的研究[1],但近年研究逐渐明确基因突变是导致多种疾病的最根本因素,至今已发现多种与妊娠过程有关的基因,如透明带1(zona pellucida 1,ZP1)、ZP2和ZP3 基因与透明带的形成直接相关[2],泛连接蛋白1(recombinant pannexin 1,PANX1)基因介导卵细胞死亡[3],WEE2 与受精有关[4]等。王磊团队于2016 年明确了β-微管蛋白8(tubulin beta eight class Ⅷ,TUBB8)基因与女性不孕的关系[5]。之后相关研究不断推进,至今有几十篇关于TUBB8 基因突变可能会导致女性不孕的文献报道。以往女性非生殖器官异常的不孕被认为是由生活方式或身体调节不宜而导致的,而基因突变与女性不孕的关系的明确使不孕相关研究的方向更加精确,可以更好地指导不孕的治疗。
1 TUBB8 的概述
TUBB8 是灵长类动物中一种特有的TUBB。TUBB 与α-微管蛋白(tubulin alpha,TUBA)的异二聚体动态组装成微管,为细长、中空的圆柱管状结构,是真核细胞骨架的关键元件,参与支撑细胞、纺锤体与染色体运动等多种正常生理活动。
现已知人类有8 种TUBA 和9 种TUBB 基因亚型,主要通过蛋白羧基尾部的不同来区分[6]。9 种TUBB 基因亚型分别为TUBB(TUBB5)、TUBB1、TUBB2A、TUBB2B、TUBB3、TUBB4A、TUBB4B、TUBB6和TUBB8。不同微管蛋白亚型的表达存在时间和空间的差异[7]。微管蛋白基因亚型及微管的结构在进化过程中高度保守,在维持细胞形态、胞内物质运输和信号传导过程中均有重要作用[8-9]。若编码微管蛋白的基因有大量、多种的突变,则有些突变会导致一系列破坏性的发育障碍,统称为小管病(tubulinopathies),其中已知TUBB1、TUBB2A、TUBB2B、TUBB3、TUBB4A和TUBB4B 在神经元中高表达,其单个或多个点突变可以涉及神经元缺陷及神经类疾病[10-11]。
编码TUBB8 的基因的功能直到2016 年才开始明确,有研究显示卵母细胞TUBB8 突变可导致微管和运动蛋白无法正确组装或形成分裂两极,使得纺锤体组装与染色体动力学异常,直接影响卵母细胞的减数分裂过程[12]。目前普遍观点认为,女性青春期后,成熟卵泡开始进行减数分裂,发育为成熟卵母细胞,这一过程中会发生一系列形态学和分子事件,包括生发泡破裂、减数分裂纺锤体组装、卵母细胞排出第一极体的不对称分裂等,均需要由正确的微管结构辅助完成。基因突变可能导致微管的行为缺陷,使得卵母细胞成熟停滞,受精或早期胚胎发育失败[13]。
2016 年王磊团队的研究报道中将携带TUBB8突变的卵母细胞主要分为3 类:纺锤体受损的第一次减数分裂中期(MⅠ)卵母细胞(p.S176L、p.T238M和p.V255M 等);功能异常但具有明显纺锤体特征的MⅠ卵母细胞(p.T143Dfs*12 和p.E27A33del 等);形态为第二次减数分裂中期卵母细胞(MⅡ),但缺乏可识别的纺锤体,或含有受损的纺锤体(p.I210V、p.T238M 和p.N348S 等),一些形态上可识别为MⅡ但纺锤体受损的卵母细胞可以受精和分裂,但这些胚胎在后来的发育过程中受阻[5]。因此,TUBB8 若发生非良性突变则可能会影响α/β-微管蛋白异二聚体的折叠和组装途径,改变微管动力学,进而破坏微管在人卵母细胞中的表达,影响微管的正常功能。
后续研究主要通过家谱调查联合基因测序及变异筛选的方法,研究突变的位点及遗传方式;通过光镜和偏光显微镜检查卵母细胞是否排出第一极体及形成纺锤体;通过免疫荧光染色查看纺锤体的完整情况。通过以上方法扩展突变基因库、推理出致病机制。
另有研究报道将TUBB8 的突变引入TUBB5中,研究异常微管表型范围;根据卵母细胞发育过程中mRNA 清除的动态变化认为人类的M-衰变不会受到TUBB8 突变引起的减数分裂缺陷的损害[14];用野生型或突变型的TUBB8 互补RNA(complementary RNA,cRNA)处理小鼠卵母细胞,研究野生型TUBB8 cRNA 的额外表达是否可以改善体外和体内胚胎发育[15],对理论走向临床有重要的指导意义。
2 TUBB8 突变及对生殖的影响
2.1 TUBB8 突变
2.1.1 外显子及结构域改变TUBB8 含有4 个外显子(见图1),核酸改变会发生于不同的外显子区域。2020 年有学者对TUBB8 已发现的所有突变进行统计,其中80%为外显子4 突变,8%为外显子1突变,6%为外显子2 突变,6%为外显子3 突变[16]。
TUBB8 蛋白有2 个重要功能区域(见图1),分别是GTP 酶结构域和微管蛋白羧基端结构域(tubulin C-terminal domain)。其中47%的突变是在GTP 酶结构域,30%突变是在微管蛋白C 端结构域,在这2 个重要功能区域突变的比例很高,因此大部分突变会引起重大的功能缺陷;3%突变位于GTP 酶结构域前,10%突变位于两结构域间,10%突变位于C 端结构域后,虽然这3 个位置突变比例较小,但因为这些位置有重要的介导调控作用,所以突变也会导致疾病[16]。
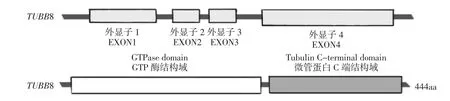
图1 TUBB8 结构示意图[17]
2.1.2 基因突变TUBB8 区域核酸改变,微观上看突变可能发生于不同的外显子或功能区,但宏观上讲,TUBB8 基因突变可以分为错义突变、无义突变、移码突变和同义突变等。错义突变发生最多,其中又包括杂合错义突变、纯合错义突变和复合杂合错义突变。这些突变的来源主要可以分为两类,一类是家庭遗传,另一类是自身突变。
杂合错义突变是指子代含有突变和未突变的一对等位基因,子代为患者,则此种突变常属于显性遗传,突变基因有显性负效应,因为患者母亲可正常受孕,故突变基因常来自于父方(见图2A),此种突变为最常见的突变形式,在至今(2016 至今)的突变个次中占30%[16]。
纯合错义突变指子代含有2 个相同的突变基因,若突变由家庭遗传而来,则父母均含有相同突变基因,为隐性遗传(见图2B),且此种突变很可能有单倍体剂量不足效应,在父母身上不显示出疾病,比如具有纯合p.P70L(c.C209T)和p.C12Y(c.G35A)突变的患者父母具有杂合错义突变,这表明杂合p.P70L 和p.C12Y 突变不影响女性生育能力。即意味着这2 个突变是单倍体剂量不足效应,而不是显性负效应。p.A54V(c.C161T)和p.E108K(c.G322 A)突变有单倍剂量不足效应[17-18]。而此种突变需要父母双方含有相同的突变基因,实际概率较小,1 个或2 个基因的自身突变是此种突变的常见原因。
复合杂合错义突变,指父母各含有1 个不同的突变基因,子代患者基因上有2 个突变位点,子代在受孕过程中可能受到多重影响(见图2C),如2019年报道的1 例患者含有p.E108K(c.G322A)和p.T143Dfs*12(c.426dupG)突变就为复合杂合突变[19]。除了遗传获得的突变基因,有20%患者的突变基因是自身全新突变而来,具有显性负效应[20-21]。

图2 TUBB8 突变类型及遗传方式示意图
另外,还有移码插入、移码缺失、片段缺失和全基因缺失等突变,但这些缺失突变约占所有突变个次的10%;还有个别突变不会产生氨基变化,个体不孕可能是受其他基因的影响[22]。
2.2 TUBB8 基因突变的后果
2.2.1 蛋白质结构改变DNA 的突变可导致其转录的氨基酸变化,如果该变化出现在微管蛋白结构或功能形成的重要部位,就会改变TUBB 折叠、异二聚体组装以及与驱动蛋白和其他微管相关蛋白的相互作用,进而影响纺锤体的组装及减数分裂,导致卵母细胞成熟异常。
TUBB8 突变患者具有p.E108K(c.G322A)突变,谷氨酸变化为赖氨酸,谷氨酸在此位置高度保守,赖氨酸被谷氨酸取代,可以影响TUBA 与TUBB 结合,破坏TUBA/TUBB 的相互作用。p.N347K(c.C1041A)突变患者的第347 天冬氨酸被赖氨酸取代,导致微管蛋白结构异常[22]。2017 年发现的一系列突变体中有7 个(p.R2、p.M330、p.I4L、p.V353、p.P70、p.E205和p.C12)位于TUBB 亚单位内。它们的突变可能影响折叠/蛋白质稳定性,或者在某些情况下影响核苷酸结合(p.C12Y、p.P70L 和p.E205K)[18]。另外2 个受影响的残基p.E194 和p.M415 位于微管表面,可能与微管相关蛋白相互作用,从而干扰调节和稳定性。而在位点c.G1054T 的突变患者蛋白(p.A352S)中的氨基酸从疏水性丙氨酸残基转变为亲水性丝氨酸残基,而p.A352S 位于先前发现的杂合错义突变p.V353I 旁,p.A352 和p.V353 位于TUBB 结构中,这些氨基酸的突变可以影响TUBB 的折叠或稳定性,从而通过显性负效应影响微管行为和纺锤体组装,导致微管形态异常[23]。而有些突变位点会导致TUBB8 表达量显著下降[24]。这些发现均提示位置相近或所处功能结构相同的氨基酸变异可能会导致相似的不良影响,可以作为基因突变影响预测的部分依据。
2.2.2 对生殖阶段的影响目前已发现TUBB8 突变可对整个受孕过程的不同环节产生不良影响。主要包括以下7 种:①卵母细胞在未成熟阶段完全停滞,特别是在MⅠ期(p.P358L、p.F367L、p.M403Hfs*3等);②卵母细胞成熟不完全,极体较大[25];③可以获得成熟卵母细胞,但受精失败(p.E108K、p.Q424*、p.I4L 等);④异常受精,多精子受精或卵母细胞减数分裂失败,产生多原核(multiple pronuclear,p.V175A、p.I4L、p.V349I 等)[26-27];⑤成熟卵母细胞可受精,但受精卵不能发生卵裂(p.V255M、p.P61T、p.V353I 等);⑥成熟卵母细胞可受精,受精卵可发生卵裂,但很快出现异常(p.F200L、p.R391C、p.Q334E 等);⑦有着床潜能的正常胚泡,但着床后不能继续发育(p.D295H、p.D417Y、p.V353I 等)[19]。
值得注意的是,一种突变可能导致多方面的不良影响,说明TUBB8 突变对整个妊娠过程有着重要作用;相同位点突变也可能导致不同的影响,说明除了TUBB8 可能还有其他基因影响卵母细胞成熟及受精过程。目前TUBB8 突变对受孕过程的不同环节的影响机制尚未明确。
3 TUBB8 基因突变研究的临床应用
3.1 疾病诊断及病因探究研究表明,不孕患者中有30%以上的患者TUBB8 发生突变,而正常受孕者突变概率极低。因此,TUBB8 突变可以作为卵母细胞成熟停滞的不孕妇女病因的首要因素[19],且可对患者卵母细胞质量进行临床预测[12]。
3.2 对辅助生殖技术的帮助因为TUBB8 突变也显示出较强的遗传性。因此在施行辅助生殖技术前可对配偶双方该基因突变情况进行检测,并尽量在胚胎的筛选中选择无突变的优质胚胎植入母体,以避免遗传性基因突变遗传给后代的情况。
人工卵母细胞激活技术(artificial oocyte activation,AOA)可以适度提高Ca2+浓度以促进纺锤体微管的分解,并通过机制调节染色体移向纺锤体极点[28],使卵细胞质内单精子注射(intracytoplasmic sperm injection,ICSI)失败的患者获得临床妊娠[29]。因此,因TUBB8 突变而不孕的个体可以考虑AOA 技术的辅助。
3.3 改善不孕症有研究表明,在表达突变体TUBB8 的小鼠卵母细胞中额外表达野生型TUBB8 cRNA,可以成功地挽救胚胎发育缺陷,生产足月子代[5]。但该方面的应用现阶段仍处于理论和实验阶段,向TUBB8 突变且发生成熟停滞的卵母细胞中介入正常蛋白质是否可以改善其停滞状况仍需要更多符合伦理学规定的实验进一步探讨。
4 结语和展望
目前已发现TUBB8 多种突变形式及百余个突变位点;涉及7 种导致不孕的机制,包括MⅠ期停滞、不能受精、异常受精、合子不能分裂、早期胚胎停滞和着床后未能继续发育。TUBB8 在女性生殖中的重要作用已经明确,但目前对于TUBB8 的研究还远远不足。首先,大量不孕患者TUBB8 位点没有突变,表明人类卵母细胞成熟停滞可能是由其他基因缺陷引起的,也可能是由多种基因突变共同作用所致,但这些基因仍未被发现。其次,几乎所有报道均只针对TUBB8 的编码区甚至外显子区域,并未研究内含子区域以及非编码区的突变情况对卵母细胞成熟的影响。再次,对于已经发现的诸多不孕相关基因,这些基因的相互联系作用机制也尚未清晰建立。最后,不孕的TUBB8 突变患者病例报道较少,突变位点也常各不相同,很难对某一种突变的影响有靶向的深入研究,需要更多动物实验的补充。
由于TUBB8 基因是灵长类动物特有的基因,若应用鼠类作为实验动物则需要采取复杂的注入TUBB8 cRNA 等方式,且小鼠和人类之间在生殖方面存在巨大的形态和遗传差异,为解决这些问题,近期有研究提出了干细胞衍生模型可以成为代替人类胚胎的模型系统,可为人类早期发育提供最有用的见解[30]。随着用于产生干细胞衍生的胚胎样结构的技术的改进,这些生物结构将更接近地模仿人类胚胎,并可以大量获得,但随之也会产生胚胎伦理问题需要学者们的思考和约束。

