卵巢中肾样腺癌伴交界性肿瘤一例并文献复习
张世凯,刘晓慧,朱可欣,左香灵,田庚
卵巢中肾样腺癌(mesonephric-like adenocarcinoma)是一种表现为中肾分化的腺癌,有研究表明其可能来源于苗勒管上皮,然后沿中肾途径分化。卵巢中肾样腺癌在临床上十分罕见,国内外相关报道极少,其治疗无相关诊治指南。该病临床表现与卵巢癌其他类型并无明显差异,早期常无症状,晚期主要症状为腹胀、腹部肿块、腹腔积液及其他消化道症状。术后病理为卵巢中肾样腺癌确诊的金标准,首选手术治疗,术后辅助化疗,本研究分析1 例双侧卵巢中肾样腺癌合并交界性浆黏液性肿瘤,讨论其病理来源,诊断、治疗及预后,旨在提高临床医生对该病的认识,为临床诊治提供依据。
1 病例报告
患者 女,67 岁,因发现盆腔肿物4 个月,于2021 年1月18 日入院。4 个月前彩色多普勒超声检查提示盆腔肿物,未行治疗。因近1 个月尿频症状加重就诊,行妇科检查:外阴发育正常,阴道通畅,宫颈光滑,萎缩。子宫正常大小,子宫右侧可触及一直径约13.0 cm 的囊实性包块,质硬,活动良,左侧附件区触诊不满意。遂住院治疗,查妇科彩色超声:子宫右侧方见一个囊实性回声,大小12.2 cm×9.2 cm×9.9 cm,与子宫分界不清,回声不均匀,其内可见液性暗区,实质内可见点状血流信号,其内可见动脉频谱,动脉阻力指数(resistive intex,RI)0.48,子宫左侧方见囊实性回声,大小5.4 cm×3.5 cm×3.1 cm,边界欠清(与右侧囊实性回声分界不清),其内未见明显血流信号。肿瘤标志物检查:癌胚抗原(carcinoembryonic antigen,CEA)14.00 μg/L,糖类抗原125(CA125)为269.10×103μg/L,CA19-9>1 200 kU/L,人附睾蛋白4(human epididymis protein 4,HE4)573.8 pmol/L,绝经前卵巢癌风险评估模型(risk of ovarian malignancy algorith,ROMA)值96.98%,绝经后ROMA值93.16%。行剖腹探查术,术中见:右附件区见一囊实性肿物,约12.0 cm×11.0 cm×10.0 cm,与部分肠管及右盆壁盆底致密粘连,活动差。分离粘连过程中肿物破裂,流出淡黄色黏稠液体约30 mL,分离粘连后见肿物来源于右侧卵巢。左侧卵巢另见一大小约6.0 cm×5.0 cm×4.0 cm 囊实性肿物,与肠管、左侧盆壁及盆底粘连致密,子宫萎缩,双侧输卵管未见明显异常。切除双侧附件送检快速病理,结果回报为:(双侧卵巢)内见有异型腺体,考虑为腺癌,局部上皮呈黏液样。与患者家属沟通后,行全子宫、双侧附件、大网膜、阑尾切除术+盆腔淋巴结清扫术。术后病理:符合(双侧卵巢)中肾样腺癌(见图1),伴交界性浆黏液性肿瘤及子宫内膜异位症,其他组织均未见癌转移(其中1 枚淋巴结内见苗勒管包涵腺体)。免疫组织化学染色结果:雌激素受体(estrogen receptor,ER)阴性,孕激素受体(progesterone receptor,PR)局灶弱阳性,细胞角蛋白7(cytokeratin 7,CK7)部分阳性,CK20 散在阳性,Ki-67 增殖指数40%,PAX-8(染色结果不明确),P16 部分阳性,P53 部分阳性,CDX2、WT1 阴性,CK(AE1/AE3)、甲状腺转录因子1(thyroid transcription factor-1,TTF-1)和GATA3 阳性,钙视网膜蛋白(calretinin)、α 抑制素(α-inhibin)、波形蛋白(vimentin)、肝细胞核因子1β(hepatocyte nuclear factor 1 beta,HNF1β)、NapsinA和P504s 阴性。明确临床诊断:卵巢中肾样腺癌,卵巢交界性肿瘤,子宫内膜异位症。术后患者恢复良好,由于缺少该病术后具体治疗规范,为减少复发,拟给予紫杉醇+卡铂方案化疗6 个疗程。相关检查未见明显化疗禁忌证,术后给予紫杉醇(力朴素)270 mg+卡铂600 mg 化疗,拟于21 d 后行下次化疗。患者第1 次化疗完成后,自行停止后续化疗,现密切随访4 个月余,未见明显复发迹象,无不适主诉,继续随访中。
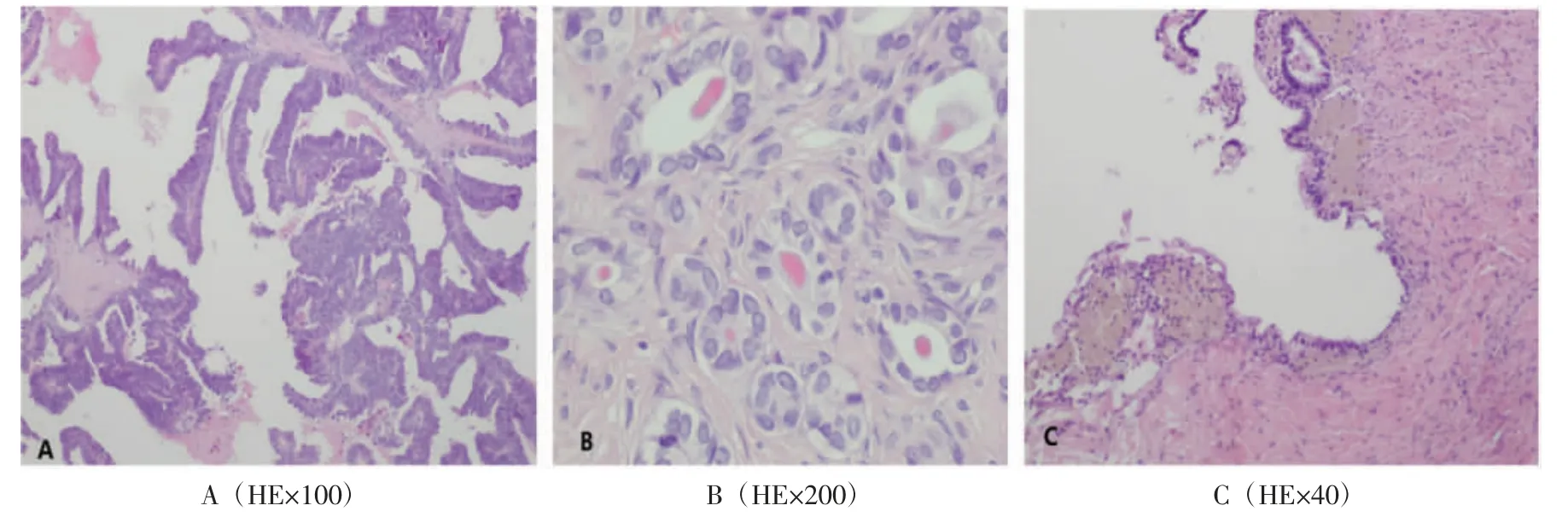
图1 中肾样腺癌患者术后病理图
2 讨论
2.1 中肾样腺癌起源中肾管腺癌(mesonephric adenocarcinoma)是一种罕见的恶性肿瘤,被认为来源于中肾残余,发生在已知有中肾残余的解剖位置,如宫颈和阴道侧壁。而中肾样腺癌相对于中肾管腺癌更为罕见,但关于中肾样腺癌是否也来源于中肾残余尚不确定。据卵巢中肾样腺癌与交界性或恶性浆液性肿瘤同时存在的相关病例报道[1-2],证实了卵巢中浆液性成分和中肾样成分之间是克隆相关的,表明卵巢中肾样腺癌可能起源于苗勒管。但中肾样腺癌在形态学、免疫表型和分子水平上表现为中肾分化,故可以理解为中肾样腺癌起源于苗勒管上皮,然后沿中肾途径分化[3]。本例患者病变相对较早,极具典型性,且左侧盆腔淋巴结中见一枚苗勒管包涵腺体,可以进一步证实其可能来源于苗勒管上皮。
2.2 中肾样腺癌诊断与鉴别诊断卵巢中肾样腺癌与其他类型卵巢癌在临床表现上并无区别,其诊断与鉴别需依靠病理学检查。研究表明卵巢恶性肿瘤患者的CA125、CA19-9 与CEA 联合检测有助于提高卵巢癌早期诊断的准确性[4]。本例患者因尿频就诊发现盆腔肿物,彩色超声提示囊实混合回声,边界不清,且存在血流信号,CEA、CA125、CA19-9、HE4、ROMA 值明显升高,考虑可能为卵巢来源的恶性肿瘤。故行剖腹探查术,术中送快速病理提示腺癌,但未明确具体类型。术后病理回报为卵巢中肾样腺癌伴交界性浆黏液性肿瘤。中肾样腺癌镜下形态包括管状、腺状、导管状、乳头状或实心形态,细胞质少,腔内可见嗜酸性胶体样物质,圆形至椭圆形细胞核以及核凹槽和凹痕[5-6]。中肾样腺癌仅依靠镜下形态学难以鉴别,尤其与子宫内膜样腺癌鉴别,需依靠免疫组织化学染色分析,中肾样腺癌以ER 和PR 阴性、GATA3 和TTF-1 表达为特征[7-8],但ER 和PR 的完全阴性对子宫内膜样腺癌来说是不常见的[5]。据报道,在良性中肾残余中没有TTF-1 的表达[9],更进一步说明中肾样腺癌可能并非来源于中肾残余。
2.3 卵巢中肾样腺癌的治疗与预后本例患者双侧卵巢肿物行手术治疗,术中为防止肿瘤播散,应尽量避免肿物破裂,并送检快速病理,明确病变性质,确定手术范围,避免二次手术治疗。病理诊断为该病诊断的金标准,但由于该病理类型罕见,应加强病理科医生对本病的认识,避免造成误诊和漏诊。本例患者因粘连较重,分离粘连过程中肿物破裂,按照国际妇产科联盟(FIGO)手术病理分期诊断为卵巢癌ⅠC期[10]。卵巢癌治疗手术为主,化疗为辅,因目前缺乏针对卵巢中肾样腺癌的术后特定治疗规范,可参照《2021 NCCN 卵巢癌包括输卵管癌及原发性腹膜癌临床实践指南》,Ⅰ期患者除了高级别浆液性癌推荐6 个疗程化疗外,其他组织类型给予3~6 个疗程化疗[11]。由于中肾样腺癌侵袭性未知,故按照卵巢癌常见类型给予化疗,至少应给予术后6 个疗程化疗。目前卵巢中肾样癌的文献报道的病例数量有限,关于其侵袭性及术后复发率缺乏充分的证据,无法对其预后做出结论。该患者手术后第1 疗程化疗后未继续规律化疗,随访4 个月余无明显转移复发迹象,可初步推断本病侵袭性尚可,但对该病给予规律化疗后复发率仍有待研究,可为临床工作提供参考。

