脉冲电场提取丹参脂溶性成分
周 程 闫泽垚 刘克富
脉冲电场提取丹参脂溶性成分
周 程 闫泽垚 刘克富
(复旦大学光源与照明工程系 上海 200433)

脉冲电场 电穿孔 提取 丹参酮
0 引言
丹参又名红根、赤参,为唇形科植物Salvia miltiorrhiza Buge的干燥根和根茎,是一种传统中药,其主要成分包括脂溶性丹参酮类化合物(如丹参酮ⅡA、隐丹参酮和丹参酮Ⅰ等)和水溶性丹酚酸类化合物(如丹酚酸、原儿茶醛、迷迭香酸、咖啡酸等),具有抗炎、抗菌、抗氧化、扩张冠状血管、抗肿瘤等多方面的药理作用[1-3]。丹参酮的传统提取法包括浸泡法、渗漉法和回流法等,这些方法耗能耗时,效率较低。近年来一些新的方法被引入,如微波法[4-5]、超声法[6]、索氏提取法[7]、超临界流体CO2提取法[8-10]、酶法[11]等,与传统方法相比,在效率和成本上有大幅度提高,但基本都属于加压升温类技术,各自存在一定的局限性。例如,微波法可导致局部温度过高。酶法引入新的物质,影响提取液的纯度,增加分离与纯化难度。运用现代科学理论与方法,开展新的更有效的中药有效成分提取方法研究显得十分必要,这对于利用传统中药资源,继承和发展我国传统中医药事业具有重要意义。鉴于此,脉冲电场(Pulsed Electric Field, PEF)方法作为一种新型处理方法,被应用到中药成分提取中。PEF方法最早用于液体食品灭菌,如今其应用领域不断扩展,已广泛应用于基因传导[12-14]、肿瘤消融[15-21]、成分提取[22-24]等。PEF在极短的时间(ms)内作用于细胞膜上,使跨膜电压达到临界值,磷脂分子发生重排,形成贯穿细胞膜的孔道,从而实现成分溶出与提取。目前,应用于丹参成分的PEF提取技术尚未见报道。
本文研究目的在于使用该提取方法进行脂溶性丹参酮类成分的提取。为此,首先研制了固态脉冲电源和基于非对称平板电极的静止式处理器。对于影响提取的关键参数如电场强度、脉宽、脉冲数等进行单因素实验,并使用液相色谱(High Perfor- mance Liquid Chromatography, HPLC)方法进行结果表征。同时,使用正交优化方法获得了丹参酮的最优提取条件。对于外加热与PEF的协同作用也做了考察,分析了热敏性丹参酮成分在加热条件下的不稳定性及热-电协同提取条件。
1 提取机制
PEF提取方法是将固液混合物置于两电极之间,反复施以高压脉冲(典型值20~80kV),从而产生细胞膜的传导率和通透性增大的生物电磁效应。PEF作用时间非常短,通常在1s以内[25]。目前主要使用电穿孔(electroporation)理论来解释该效应。
在外电场作用下,离子在细胞膜两侧不平衡分布,形成跨膜电压,其定义[26]为
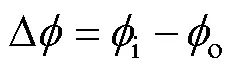
跨膜电压示意图如图1所示。

图1 跨膜电压示意图
在球形细胞模型中,跨膜电压可以通过求解Laplace方程得到,即
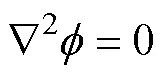
该方程的解可表示为Schwan方程[27],有

式中,为细胞半径;为与电场方向形成的夹角;为外电场大小;m为细胞膜充电时间常数,可估算为
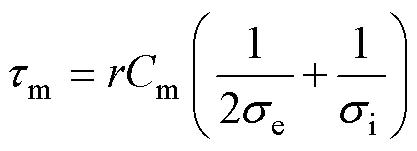
式中,为细胞半径;m为细胞膜的膜电容;e为外介质的电导率;i为细胞质的电导率。
细胞膜穿孔机理如图2所示。当外电场逐渐增大,细胞膜两侧离子浓度差将增大并使得跨膜电压增大,如图2a所示。当达到临界穿孔电压(约1V)时,膜厚度压缩且磷脂头部向内弯折形成贯穿性孔道,并使得细胞膜通透性增加。典型的跨膜电压变化如图2b所示,由图可以看出,一旦达到临界值,跨膜电压将迅速跌落并逐渐稳定,直到外加电场消失;而未达到临界穿孔电压时,其跨膜电压表现出典型的膜电容充电与放电特性。
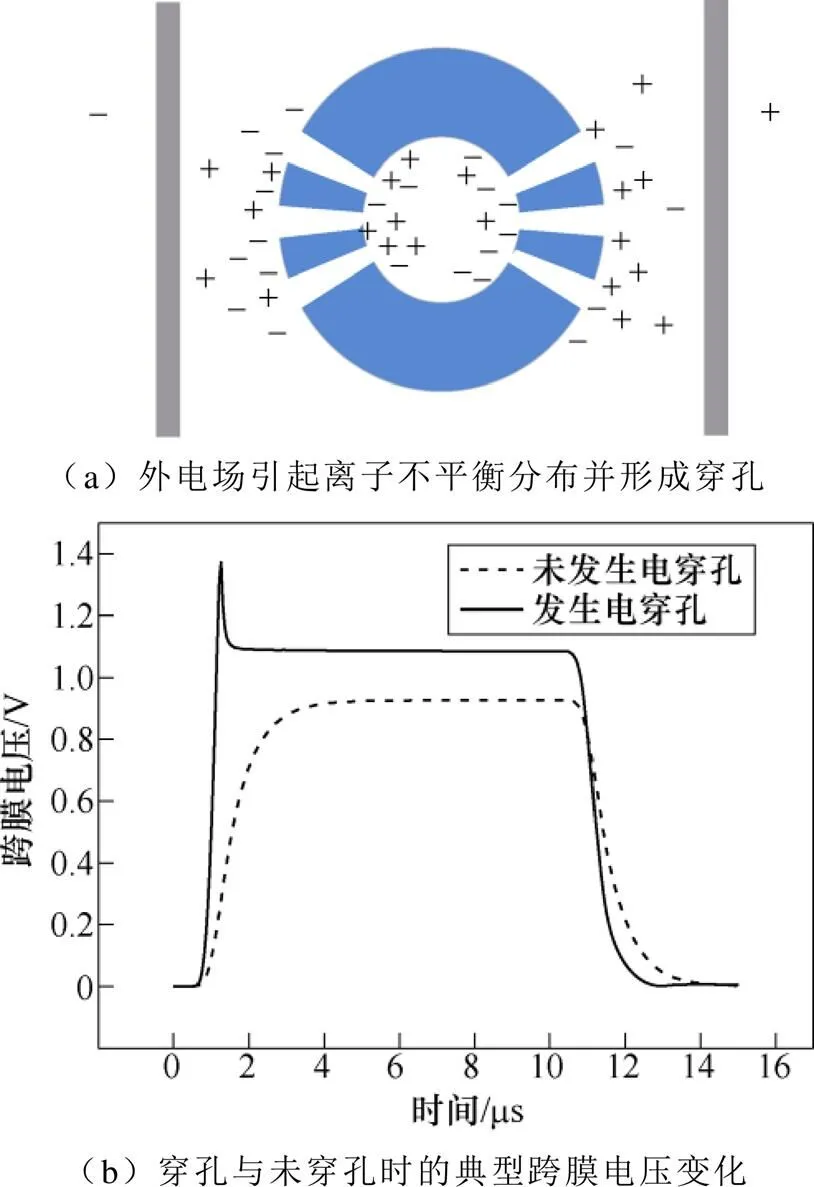
图2 细胞膜穿孔机理
与此同时,形成的孔道将允许可溶性成分溶出。此扩散过程可以用Fick定律描述为

式中,为浓度;为时间;为扩散系数;为位置或距离。
2 高压脉冲发生器和处理室
PEF方法通常使用指数衰减波、方波和双极性波三种波形。在本研究中,使用效率更高的方波,因其在脉冲作用时间内均对细胞膜产生作用,而其他波形仅在临界值以上部分有效。高压脉冲电源采用自行研制的固态Marx发生器,其具有波形易于调制、重复频率高、上升时间短等优点。通过控制开关的导通时序,可以产生所需方波。该发生器共26级,每级3个5mF并联电容。放电时总等效电容为576nF。最高输出电压20kV,最大通流200A。重复频率0.1~10Hz。脉宽范围0.5~10ms。
同时,设计静止式处理器,其截面如图3所示。该处理室电极采用非对称结构,由于无三相点处的电子发射,故可以有效减小沿面闪络的可能性。为减小电极的边缘效应,提高处理的匀质性和可靠性,电极边缘应予以倒圆。该处理室有效处理面积约为50cm2。

图3 静止式处理器截面
3 实验方法
3.1 实验材料与仪器
实验中使用的试剂与仪器见表1。
表1 实验试剂与仪器

Tab.1 Experimental reagents and equipments
注:*含丹参酮ⅡA、隐丹参酮和丹参酮Ⅰ。
3.2 丹参粉碎与预浸泡
预处理除去杂质,并将如图4所示的丹参生药粉碎约30s。粉碎可使丹参粉粒大小均匀且具有代表性,提高测量结果的准确度。由于药材比表面积增大,提取率将进一步增大。粉碎过细会使得药材颗粒之间产生吸附和聚集,溶剂难于穿透。

图4 丹参
取丹参粗粉,过200目(74mm)筛网。取筛后丹参细粉末,精密称定。在烧杯中加入40mL无水乙醇(分析纯)溶剂,使丹参和乙醇充分混匀,制成悬浊液。
预浸泡30min。浸泡能够去除药材中的空气,增大溶剂与药材的接触,并防止电场作用期间气泡的击穿。此外还能够使细胞膨胀,组织软化并提供一定的初始离子浓度,便于建立跨膜电压。
3.3 脉冲电场处理
PEF提取系统如图5所示。图中,高压脉冲电源用电容器和开关串联的形式表示,当驱动电路驱使开关管闭合时,Marx发生器将所储存的能量向负载释放。高压探头用来测量记录处理室两端的脉冲电压波形。罗氏线圈用来测量回路电流。该线圈接于低压端(或近地端)。示波器分别记录电压和电流波形,实时监测提取系统运行情况。
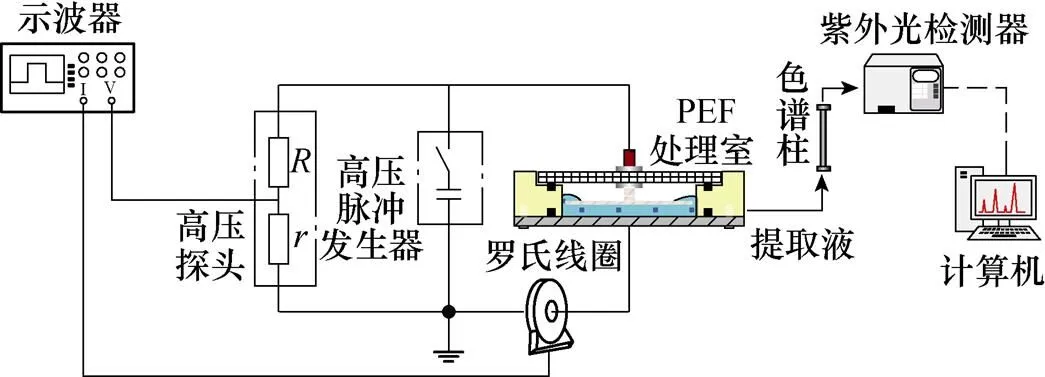
图5 PEF提取系统

停止脉冲电场处理后,将提取液用滤纸进行过滤,获得所需提取溶液。再经过0.22mm尼龙滤膜过滤取样备检。提取液不可于溶液状态久置,因丹参酮成分具有不稳定性,会在温度、湿度、光线等的影响下随时间变化,可能造成外观(颜色)变化、成分降解等。
脉冲Marx发生器放电时负载电压电流的典型波形如图6所示。电压幅值(稳定值)=10kV,电流(平顶)=5A。在电流上升阶段(峰值m= 30A),电源主要向膜电容充电,实现跨膜电压的建立;而在平顶段(=5A)主要是阻性电流,通过膜电阻或溶液等效电阻产生焦耳热。
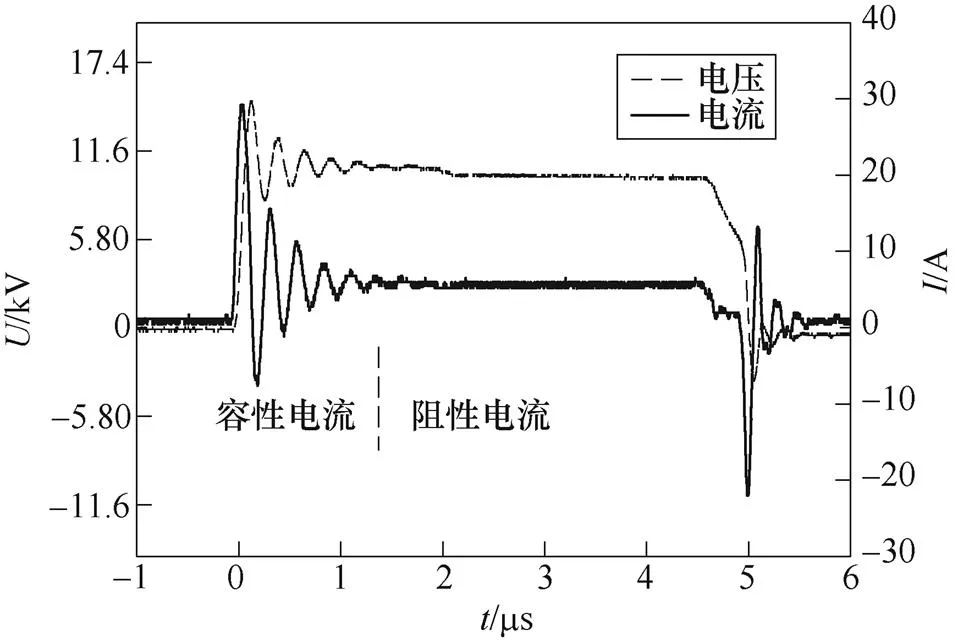
图6 负载典型波形

由于采用乙醇溶剂,负载呈高阻抗特性,因此处理室具有低能量消耗的特点,即主要利用负载电容性效应进行电场处理而不是电阻电流。此处能量传递估算为2.6J/mL,由PEF引起的提取液温升通常小于6℃。
3.4 HPLC分析
以水为流动相A,以甲醇为流动相B,按表2中的规定进行梯度洗脱。流速0.8mL/min,紫外检测波长270nm,进样体积10mL。色谱柱以十八烷基硅烷键合硅胶为填充剂,选用安捷伦Eclipse Plus C18反相柱,粒径5mm,内径4.6mm,柱长250mm。所有流动相均经超声波除气泡。所有的色谱检测均在恒定温度(26.5℃)下测定,数据由Empower软件记录与处理。
表2 梯度洗脱条件

Tab.2 The gradient elution protocol
为获知提取液中每种成分的含量,使用外标法进行计算。首先建立各对照品的标准曲线。精密称定1.56mg丹参酮ⅡA分析对照品,置于10mL量瓶中,同时用乙酸乙酯伴超声溶解,定容至刻度,摇匀,则配置成0.156mg/mL的母液。分别配制梯度浓度的标准溶液,待0.22mm尼龙滤膜滤过后用移液器取约2mL入样品瓶,备用进样。同理,称定分析对照品隐丹参酮和丹参酮Ⅰ,超声促溶后,配制梯度浓度的标准溶液,滤过,待进样。使用前述液相色谱条件分别测定,进样体积均为10mL。以丹参酮ⅡA(和隐丹参酮、丹参酮Ⅰ)的吸光峰面积和质量浓度进行线性拟合。经整理,以上三种对照品的标准曲线方程(为吸光峰面积;为质量浓度)分别为
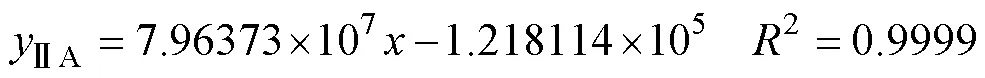


结果显示,各对照品在相应取值范围内线性关系良好。图7为分析对照品的HPLC,丹参酮ⅡA、隐丹参酮和丹参酮Ⅰ的保留时间依次为13.634min、11.462min和11.115min。

根据峰面积,采用提取所得到的目标成分的质量与所用原料的质量之比计算提取率,即


图8 提取液的典型HPLC色谱
每组平行实验至少3次,并分别求其平均值和标准差。
4 结果与讨论
4.1 电场强度的影响
图9描述了不同的电场强度下,在施加1 000个3.5ms宽度脉冲的PEF处理之后获得的丹参酮产率。结果表明,电场强度对丹参酮的提取率有较为明显的影响。即使在相对低的电场强度(1.2kV/cm)下,提取率也有一定提升,并且随着外部电场强度的增加,三种组分的提取率均增加。与低电场强度下不同,从5kV/cm开始,提取率的斜率趋于平坦。当电场强度为35kV/cm时,丹参酮ⅡA的提取率达到最大值约4.36mg/g,比对照组(2.46mg/g)高出77.2%。
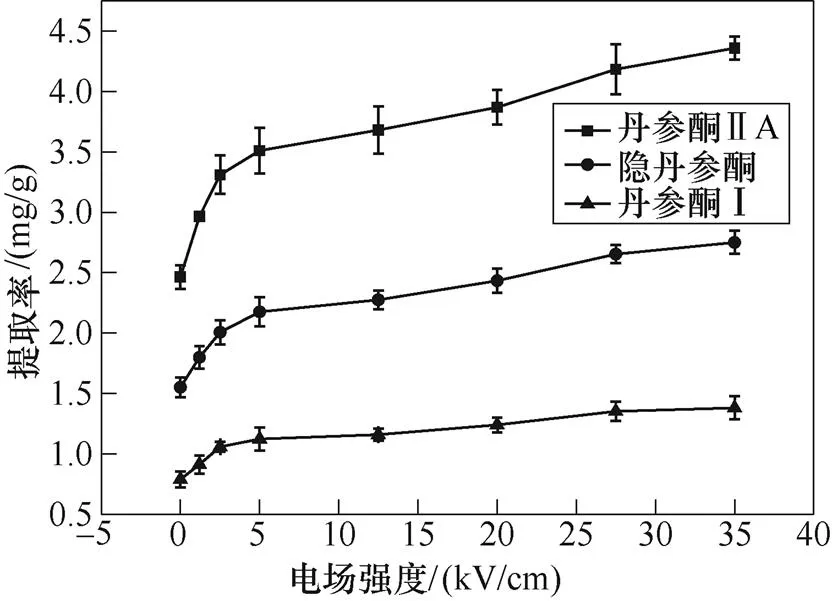
图9 电场强度的影响
提高的提取率是由丹参细胞的通透性增加引起的,其允许额外的丹参酮通过形成的孔道释放至细胞外。此外,提取产率与电场强度的正相关性与施万(Schwan)方程一致,即较高的电场强度会感应出较大的跨膜电压,更容易、更快地达到细胞损伤的临界条件。在高电场强度下,穿孔范围分布更广,数量也将更多,如Smoluchowski方程所述[28-32]。在电场中,除了带电粒子的高速运动和分布对跨膜电压的建立和提取率有巨大影响,溶剂分子也有一定影响。随着电场强度的增大,极性溶剂分子的移动速率亦加快,故导致更多的溶剂进入细胞内部,增大细胞内外的浓度差并加速提取进程。
4.2 脉冲数的影响
脉冲数也是影响提取率的重要因素,在30kV/cm,脉宽为3.5ms时研究脉冲数对提取率的影响,结果如图10所示。结果表明,1 500个脉冲前,提取产量随着脉冲数的增加而增加,且在1 500个脉冲时丹参酮ⅡA获得最大产率(3.86mg/g)。然而,当脉冲数继续上升至2 500时,提取产率逐渐降低至3.74mg/g。隐丹参酮和丹参酮Ⅰ的提取率均呈现相似的趋势。在1 500个脉冲内提高的提取产率可以通过在极短的时间内(在几个脉冲内)形成孔而增加的孔存在时间来解释,并且随后的脉冲作用增加总处理时间以维持孔道的存在,温度的升高也会促使丹参酮扩散到溶剂中。随着温度的升高,细胞膜中的磷脂分子会产生相变,从低温下的填充凝胶状结构转变为高温下的松散液晶相,从而减小了细胞膜的厚度和机械阻力,因此,PEF与同时产生的欧姆热效应相耦合会增大对细胞膜的损伤。丹参酮提取率的增加可能表明这种相变的发生,以及升温条件下膜流动性的变化,其中,细胞膜变薄将使之更容易受到电场的破坏。另一方面,超过1 500个脉冲的提取率下降则可能是由于连续脉冲电场作用导致的断键和温度的增加,因为累积的热量亦可导致热敏性丹参酮的少量降解。

图10 脉冲数的影响
4.3 脉宽的影响
脉宽对于电穿孔亦存在影响,此处在实验条件为电场强度30kV/cm,脉冲数1 000下研究脉冲宽度的影响。脉冲宽度的影响如图11所示。可以看出,在1.5ms之前,丹参酮ⅡA的提取率呈逐渐上升趋势;1.5ms之后其提取率在3.77~4.02mg/g的小范围内波动,其他两种组分也是如此。由此可以推断,一旦脉冲足够长,细胞膜电容充电过程(约为1ms)即可达到穿孔效应。脉冲宽度对提取速率没有显著影响。也就是说,电压波形的上升阶段,主要代表膜电容的充电过程,在跨膜电压(即膜电容的电压)建立和孔隙形成中起着关键的作用;而在随后的脉冲平坦阶段,电流主要通过膜电阻或溶液杂散电阻转换为焦耳热。对于0.5ms脉宽,由于尚未达到平均充电时间,电穿孔仅在极少数半径较小的细胞中发生,因细胞膜充电时间常数正比于细胞半径(见式(4)),故导致丹参酮提取率较低,其中,丹参酮ⅡA仅为2.7mg/g。
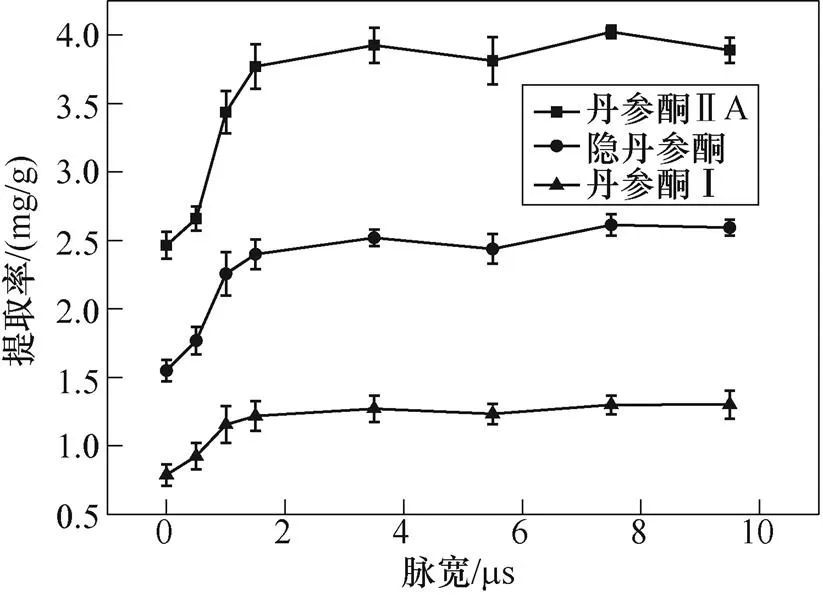
图11 脉冲宽度的影响
4.4 液料比的影响


图12 液料比对提取率的影响
4.5 温度与PEF的协同作用
图13显示了PEF与温度(使用水浴保持恒温)协同作用时,提取前后(30min和70min)的吸光度变化。由图可知,当未施加PEF时,提取率随温度逐渐增加,但增长率较低。大体而言,每升高10℃,浓度增加约10%。施加PEF作用时,随着温度从20~70℃上升,丹参酮ⅡA浓度(即吸光度表示)呈现出先升后降趋势,吸光度从0.750 3(au)增长至1.770 7(au),随后逐渐下降,在70℃降至1.212 8(au)。也就是说,超过50℃时,PEF与热协同作用下产生拮抗作用,丹参酮ⅡA发生降解。50℃时比未处理时增加104%。丹参酮ⅡA具有菲醌结构,对光照、潮湿和高温均具有不稳定性,对高温尤为敏感,降解反应始终存在于提取过程中。加热时,丹参酮的溶出与降解是一个相互“博弈”的动态过程。在温度较低(50℃以下)时,丹参酮以溶出为主导,由于温升使得丹参微观结构变化[33]和孔道加速形成,以及溶质扩散速率大于降解速率,丹参酮ⅡA提取率逐渐上升。50℃后,随着温度的继续升高,虽然电穿孔程度逐渐增大,溶出比例增大,但降解速率亦逐渐增大,表现为丹参酮ⅡA提取率的减小。吸收的热量引起的分子动能的增加意味着更大比例的分子具有碰撞和反应所需的活化能(活化能不随温度升高而变化),分子间有效碰撞次数增大,故降解反应速率增大,丹参酮ⅡA的半衰期缩短。此外,升温使得分子能级升高,运动速率和分子间碰撞频率增加,亦加剧了降解反应的发生。

图13 PEF与温度协同提取前后吸光度变化
相对于常温,加热在带来更高程度细胞损伤的同时,也可能产生其他“副作用”,如杂质将一同释放至细胞外,使得下游分离与纯化工序更加困难,并可能对丹参酮的结构和功能造成不利影响。因此,适当提高温度(如选择50℃临界点处)并引入PEF,克服了过高的温度带来的丹参酮降解效应,较好地保持了其品质,增大了溶质向溶剂的扩散速率,进一步提高了提取率。
4.6 提取工艺的优化
为获得多参数下的最佳提取条件,使用正交方法进行优化。脉冲电场提取丹参酮的正交实验结果见表3。
表3 正交实验
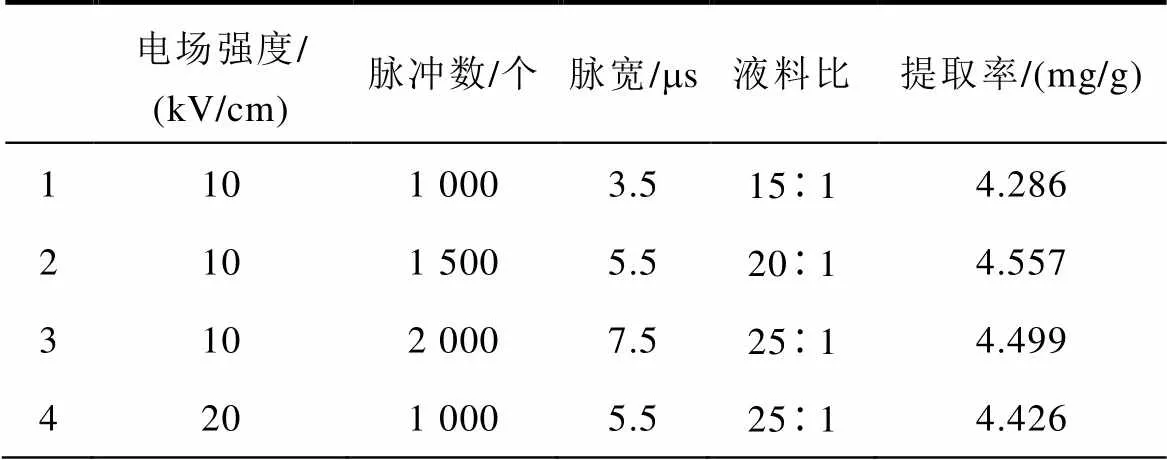
Tab.3 Orthogonal method design

(续)

4.7 电镜表征
图14为丹参样品表面的扫描电镜图像。图14a中经PEF处理的丹参样品,其表面较为粗糙与坑洼,多处出现内凹缺陷,其截面大体呈圆形。图14b丹参样品未经电场处理,可保持其完整性,表面大部分较为平坦,粗糙处亦未观察到穿孔缺陷。

(a)35kV/cm处理组 (b)对照组
5 结论

采用PEF技术提取丹参酮类化合物的方法是可行的,且具有较高的提取率,能耗低、时间短、对下游工序污染少。PEF为提取中药成分尤其是热敏性成分提供了新思路,并展现出良好的应用前景。
致谢:感谢复旦大学药学院昌军老师提供的HPLC分析协助。
[1] Gao Si, Liu Zhiping, Li Hong, et al. Cardiovascular actions and therapeutic potential of tanshinone ⅡA[J]. Atherosclerosis, 2012, 220(1): 3-10.
[2] Wang Xiujie, Wei Yuquan, Yuan Shulan, et al. Potential anticancer activity of tanshinone ⅡA against human breast cancer[J]. International Journal of Cancer, 2005, 116(5): 799-807.
[3] Fu Jiajia, Huang Heqiang, Liu Jiajun, et al. Tanshinone ⅡA protects cardiac myocytes against oxidative stress-triggered damage and apoptosis[J]. European Journal of Pharmacology, 2007, 568(1-3): 213-221.
[4] Pan Xuejun, Niu Guoguang, Liu Huizhou. Microwave- assisted extraction of tanshinones from Salvia miltiorrhiza bunge with analysis by high-performance liquid chromatography[J]. Journal of Chromatography A, 2001, 922(1-2): 371-375.
[5] Pan Xuejun, Niu Guoguang, Liu Huizhou. Com- parison of microwave-assisted extraction and conventional extraction techniques for the extraction of tanshinones from Salvia miltiorrhiza bunge[J]. Biochemical Engineering Journal, 2002, 12(1): 71- 77.
[6] Liu Hongjun, Wan Jianjian, Ai Yan. Optimizing extraction technique of liposoluble constituent in Baihua Danshen and determining it by HPLC method[J]. Qilu Pharmaceutical Affairs, 2006, 25(7): 405-407.
[7] Ong E S, Len S M. Evaluation of pressurized liquid extraction and pressurized hot water extraction for tanshinone I and ⅡA in Salvia miltiorrhiza using LC and LC-ESI-MS[J]. Journal of Chromatographic Science, 2004, 42(4): 211-216.
[8] Ling S H I. Study on tanshinone extracted from Salvia miltiorrhiza Bge. Dregs[J]. Journal of Anhui Agricultural Sciences, 2010, 38(9): 4539-4541.
[9] Dean J R, Liu B, Price R. Extraction of tanshinone ⅡA from Salvia miltiorrhiza bunge using super- critical fluid extraction and a new extraction technique, phytosol solvent extraction[J]. Journal of Chromatography A, 1998, 799(1-2): 343-348.
[10] Wang Longhu, Song Yanting, Cheng Yiyu, et al. Orthogonal array design for the optimization of supercritical fluid extraction of tanshinones from Danshen[J]. Journal of Separation Science, 2008, 31(2): 321-328.
[11] Ge Xiuchun, Wu Jianyong. Tanshinone production and isoprenoid pathways in Salvia miltiorrhiza hairy roots induced by Ag+ and yeast elicitor[J]. Plant Science, 2005, 168(2): 487-491.
[12] Aihara H, Miyazaki J. Gene transfer into muscle by electroporation in vivo[J]. Nature Biotechnology, 1998, 16(9): 867-870.
[13] Neumann E, Schaefer-Ridder M, Wang Y, et al. Gene transfer into mouse lyoma cells by electroporation in high electric fields[J]. The EMBO Journal, 1982, 1(7): 841-845.
[14] Saito T, Nakatsuji N. Efficient gene transfer into the embryonic mouse brain using in vivo electro- poration[J]. Developmental Biology, 2001, 240(1): 237-246.
[15] 刘红梅, 董守龙, 宁郡怡, 等. 纳秒脉冲高频透膜效应优先杀伤化疗抗性肿瘤细胞的仿真与实验研究[J]. 电工技术学报, 2019, 34(22): 4839-4848.
Liu Hongmei, Dong Shoulong, Ning Junyi, et al. Simulation and experimental study on preferential killing of chemoresistance tumor cells induced by the high-frequency permeation effect of nanosecond pulse field[J]. Transaction of China Electrical Technology, 2019, 34(22): 4839-4848.
[16] 姚陈果, 宁郡怡, 刘红梅, 等. 微/纳秒脉冲电场靶向不同尺寸肿瘤细胞内外膜电穿孔效应研究[J]. 电工技术学报, 2020, 35(1): 115-124.
Yao Chenguo, Ning Junyi, Liu Hongmei, et al. Study of electroporation effect of different size tumor cells targeted by micro-nanosecond pulsed electric field[J]. Transaction of China Electrical Technology, 2020, 35(1): 115-124.
[17] 米彦, 李盼, 刘权, 等. 纳秒脉冲电场联合多壁碳纳米管对皮肤癌细胞活性的剂量效应研究[J]. 电工技术学报, 2019, 34(22): 4849-4857.
Mi Yan, Li Pan, Liu Quan, et al. Dose effect of the activity of skin cancer cells treated by nanosecond pulsed electric field combined with multi-walled carbon nanotubes[J]. Transaction of China Electrical Technology, 2019, 34(22): 4849-4857.
[18] 米彦, 彭文成, 芮少琴, 等. 高频纳秒脉冲串作用下皮肤肿瘤热效应的多参数有限元仿真与实验[J]. 电工技术学报, 2017, 32(22): 264-274.
Mi Yan, Peng Wencheng, Rui Shaoqin, et al. Thermal effects in skin tumor exposed to high-frequency nanosecond pulse bursts: multi-parametric finite element simulation and experiment[J]. Transaction of China Electrical Technology, 2017, 32(22): 264-274.
[19] 姚陈果, 郑爽, 刘红梅, 等. 面向临床多针消融肿瘤的不可逆电穿孔量效关系模型[J]. 电工技术学报, 2020, 35(11): 2491-2498.
Yao Chenguo, Zheng Shuang, Liu Hongmei, et al. Model of irreversible electroporation dose-effect relationship for clinical multi-needle ablation tumors[J]. Transaction of China Electrical Tech- nology, 2020, 35(11): 2491-2498.
[20] 刘红梅, 姚陈果, 董守龙, 等. 基于测量信号的不可逆电穿孔动态过程数值模拟及分析[J]. 电工技术学报, 2019, 34(18): 3732-3740.
Liu Hongmei, Yao Chenguo, Dong Shoulong, et al. Dynamic numerical modeling and analyzing on the process of irreversible electroparation based on measurement signal[J]. Transaction of China Elec- trical Technology, 2019, 34(18): 3732-3740.
[21] Kingham T P, Karkar A M, D'Angelica M I, et al. Ablation of perivascular hepatic malignant tumors with irreversible electroporation[J]. Journal of the American College of Surgeons, 2012, 215(3): 379- 387.
[22] Sack M, Sigler J, Frenzel S, et al. Research on industrial-scale electroporation devices fostering the extraction of substances from biological tissue[J]. Food Engineering Reviews, 2010, 2(2): 147-156.
[23] Kotnik T, Frey W, Sack M, et al. Electroporation- based applications in biotechnology[J]. Trends in Biotechnology, 2015, 33(8): 480-488.
[24] Meglic S H, Marolt T, Miklavcic D. Protein extraction by means of electroporation from E. coli with preserved viability[J]. The Journal of Membrane Biology, 2015, 248(5): 893-901.
[25] Barbosa-Canovas G V, Pierson M D, Zhang Q H, et al. Kinetics of microbial inactivation for alternative food processing technologies[J]. Institute of Food Technologists, 2000, 65(S8): 65-79.
[26] Nicholas Sperelakis. Cell physiology source book: essentials of membrane biophysic[M]. San Diego: Elsevier, 2012.
[27] Weaver J C, Chizmadzhev Y A. Theory of electro- poration: a review[J]. Bioelectrochemistry and Bioenergetics, 1996, 41(2): 135-160.
[28] DeBruin K A, Krassowska W. Electroporation and shock-induced transmembrane potential in a cardiac fiber during defibrillation strength shocks[J]. Annals of Biomedical Engineering, 1998, 26(4): 584-596.
[29] DeBruin K A, Krassowska W. Modeling electro- poration in a single cell. I. effects of field strength and rest potential[J]. Biophysical Journal, 1999, 77(3): 1213-1224.
[30] DeBruin K A, Krassowska W. Modeling electro- poration in a single cell. Ⅱ. effects of ionic concentrations[J]. Biophysical Journal, 1999, 77(3): 1225-1233.
[31] Krassowska W. Effects of electroporation on trans- membrane potential induced by defibrillation shocks[J]. Pacing and Clinical Electrophysiology, 1995, 18(9): 1644-1660.
[32] Mouritsen O G, Jørgensen K. Small-scale lipid- membrane structure: simulation versus experiment[J]. Current Opinion in Structural Biology, 1997, 7(4): 518-527.
[33] Zimmermann U. Electrical breakdown, electroper- meabilization and electrofusion[M]. Berlin: Springer, 1986.
Pulsed Electrical Field-Assisted Extraction of Tanshinones from Salvia Miltiorrhiza
(Department of Light Sources and Illuminating Engineering Fudan University Shanghai 200433 China)

Pulsed electric field, electroporation, extraction, tanshinone
10.19595/j.cnki.1000-6753.tces.L90195
TM89
周 程 男,1988年生,博士研究生,研究方向为脉冲功率技术与生物电磁应用。E-mail: chengzhou16@fudan.edu.cn
刘克富 男,1963年生,教授,博士生导师,研究方向为高功率电子学及其生物医学应用。E-mail: kfliu@fudan.edu.cn(通信作者)
2020-06-30
2020-10-29
国家自然科学基金(51877046)和广东省季华实验室(18002U100)资助项目。
(编辑 崔文静)

