L-酪氨酸对泰和乌骨鸡胸腺肥大细胞数量的影响
司 雨,肖 红,楚 萌,刘洋铨,余 航,叶亚琼,周作红,张 晖,*
(1. 佛山科学技术学院 生命科学与工程学院,广东 佛山 528231;2. 宜春市畜牧科学研究所,江西 宜春 336000;3. 江西农业大学 动物科学技术学院,江西 南昌 330045)
泰和乌骨鸡是中国特色家禽,其肉和蛋具有很高的营养和医疗保健价值[1-2]。此外,该鸡种外貌秀丽奇特,体型优美,赏心悦目,具有较高的观赏价值,是一种集药用、滋补、观赏于一体的珍贵禽类种质资源。目前泰和乌骨鸡养殖技术的研究较多,但有关其组织学方面的研究较少[3-5]。泰和乌骨鸡最独特的表型是其体内含有大量的黑色素。已有研究表明,动物机体内的黑色素具有包括射线保护和抗氧化等诸多重要生理作用[6-8]。因此,乌骨鸡体内的黑色素也可能是其发挥药效作用的物质基础。黑色素是反映乌骨鸡肉质的重要标志,也是影响市场价格的重要因素。对机体黑色素沉积细胞学机理的研究,有助于调控黑色素沉积量,提高乌骨鸡的药效作用和经济价值[9]。
在机体中,皮肤黑素细胞以L-酪氨酸为底物合成黑色素[10-13]。但L-酪氨酸影响黑色素合成的具体细胞学机理仍然不清楚。肥大细胞是一种广泛分布的间质细胞,能够分泌多种细胞因子[14]。研究表明,肥大细胞分泌的5-羟色胺和儿茶酚胺也是黑色素合成的前体物[15-16]。而且L-酪氨酸也是儿茶酚胺合成的底物[17]。然而,有关L-酪氨酸与肥大细胞之间的相关性并不清楚。本试验通过在饲料中添加不同浓度的L-酪氨酸,检测胸腺内肥大细胞的数量变化,揭示饲粮L-酪氨酸对胸腺肥大细胞的影响,为阐明禽类黑色素生成的机理提供细胞学依据。
1 材料与方法
1.1 试验动物和方法
选用健康、体重均匀的1日龄泰和乌骨鸡180只,随机分成6个组,即对照组和5个试验组。试验组饲料中添加不同浓度的L-酪氨酸,分别为0.2%、0.4%、0.6%、0.8%和1.0。基础日粮组成及营养水平参见文献[18]。试验期为4周。
1.2 组织切片
不同组乌骨鸡处死并解剖,取胸腺,剪成小块,PBS清洗, Bouin氏液中固定。自来水冲洗固定后的胸腺小块,上行梯度乙醇脱水,二甲苯透明,透蜡,包埋,常规石蜡切片(5 μm厚)。切片二甲苯脱蜡,复水,HE染色,乙醇脱水,透明,中性树胶封片。BM2000型光学显微镜(江南永新)观察和拍照。
1.3 甲苯胺蓝组织化学染色
试剂:甲苯胺蓝、高锰酸钾、蒸馏水、二甲苯、乙醇、中性树胶等。
染色步骤:胸腺石蜡组织切片二甲苯脱蜡至水,入甲苯胺蓝染液30 s。染液配制见文献[19]。蒸馏水洗切片,95%乙醇分色,无水乙醇脱水,二甲苯透明,中性树胶封片,温箱烘干。BM2000型光学显微镜观察、拍照和计数。
1.4 观察及细胞计数
BM2000型光学显微镜观察肥大细胞,并对每个组织切片随机取10个400倍视野(物镜40×,目镜10×)计数。
1.5 数据统计分析
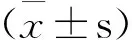
2 结果与分析
2.1 泰和乌骨鸡胸腺显微结构
泰和乌骨鸡胸腺表面被覆薄层被膜,被膜结缔组织到达胸腺深部,将实质分成许多小叶,每一小叶均由外周颜色较浅、淋巴细胞较少的皮质和中央颜色深、淋巴细胞密集的髓质两部分构成,且界线较为清晰(图1)。髓质可见近圆形的胸腺小体,细胞较少,常见嗜酸性强呈深红色的粒细胞(图1b)。此外,在乌骨鸡胸腺内分布有黑色素(图1)。
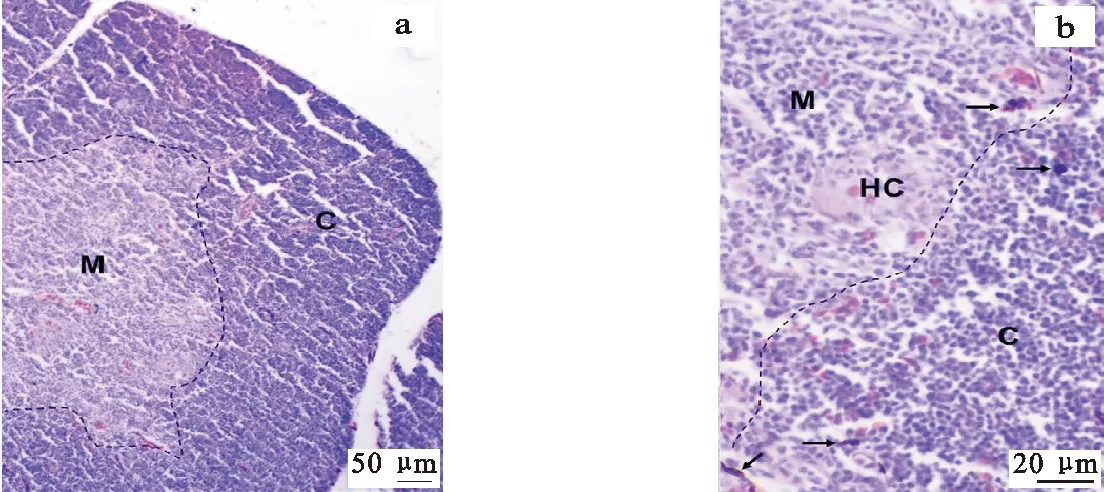
图1 泰和乌骨鸡胸腺显微结构和黑色素分布(HE染色)a.胸腺小叶;b.胸腺小叶局部放大 C.皮质;M.髓质;HC.胸腺小体;→指向黑色素颗粒;┄为皮质和髓质分界Fig. 1 Microstructure and melanin location of thymus in the silky fowl (HE staining)a. thymic lobule; b. thymic lobule at high magnification C. cortex; M. medulla; HC. hassall corpuscle; → shows melanin;┄ shows the boundary between cortex and medulla
2.2 肥大细胞形态与分布特点
甲苯胺蓝组织化学染色显示,泰和乌骨鸡胸腺中存在大量胞质为紫红色的肥大细胞,多数呈近圆形,少量呈锥体形(图2)。胸腺中肥大细胞主要位于髓质,特别是胸腺小体附近(图2a,2c)。在胸腺皮质和髓质交界处也有肥大细胞分布。胸腺髓质血管周围肥大细胞较为密集(图2b,2e)。
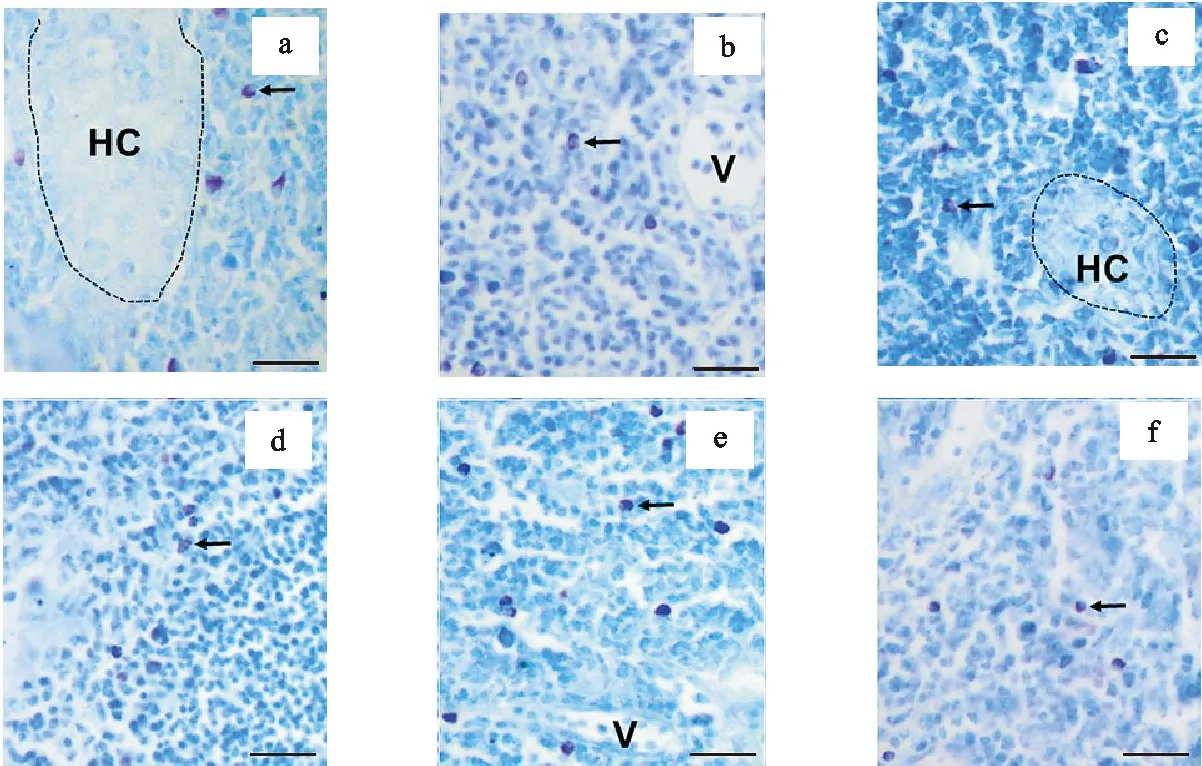
图2 不同浓度L-酪氨酸饲喂后胸腺肥大细胞的分布与形态(甲苯胺蓝组织化学染色)a~f.分别为对照组、0.2%、0.4%、0.8%和1.0%的L-酪氨酸浓度组 HC.胸腺小体;V.血管;→示肥大细胞;┄ 为胸腺小体。标尺=20 μmFig. 2 Location and morphology of thymic mast cells after feeding different concentrations of L-tyrosine (toluidine blue staining)a~f are the control group,L-tyrosine groups with concentration of 0.2%,0.4%,0.8%和1.0%, respectively HC. Hassall corpuscle; V. blood vessels; → indicate mast cells;┄ indicates hassall corpuscle. scale plate=20 μm
2.3 胸腺肥大细胞数量
组织化学染色显示,各试验组泰和乌骨鸡胸腺中均有肥大细胞分布(图2)。随着饲料L-酪氨酸浓度从0.2%开始逐渐增加,试验组胸腺肥大细胞的数量也逐渐增加;饲料L-酪氨酸浓度0.4%~0.8%组肥大细胞数显著高于对照组(P<0.05),0.8%组肥大细胞数量最多,可达28.8±6.5个/视野);然而,当饲料L-酪氨酸浓度达到1.0%时,与0.8%组比较肥大细胞数量明显下降(P<0.05),但与对照组相比差异不显著(P>0.05)(表1)。

表1 不同L-酪氨酸浓度对胸腺肥大细胞数量的影响Table 1 Effects of L-tyrosine concentrations on the number of thymic mast cells
3 讨 论
肥大细胞通过分泌化学递质和细胞因子,在机体内发挥重要的生理作用[20-21]。先前有研究表明,鸡胚胸腺中有数量较多的肥大细胞,且分布位置主要在髓质,特别是胸腺小体周围[22]。在鸡胚孵化至第16或17日时,胸腺中肥大细胞数量最多,随后逐渐减少[22]。在人类胸腺中,肥大细胞仅限于胸腺髓质和结缔组织间隔中,且成人的数量比胎儿数量多[23]。在海赛克斯褐鸡中研究表明[24],与0、7、30和120日龄鸡相比,21日龄鸡胸腺肥大细胞数量显著增加。胸腺肥大细胞的数量可能随着生理状态改变而发生变化,然而肥大细胞在胸腺中的具体生理功能仍需进一步探索。
本试验中,胚后4周龄的泰和乌骨鸡胸腺中仍有大量肥大细胞分布,数量可达14.1±2.8个/视野。分布位置也多位于髓质的胸腺小体或血管周围。动物胚胎期胸腺肥大细胞可调控造血干细胞的发育和分化[22],并通过释放细胞因子调控淋巴细胞的发育和成熟,也可调控胸腺上皮细胞的功能[25]。泰和乌骨鸡胚后4周龄,胸腺中仍有大量肥大细胞存在,且分布位置与胸腺功能位点相一致,提示泰和乌骨鸡胸腺肥大细胞在胚后仍可能继续调控胸腺的生理功能。研究表明,L-酪氨酸是黑色素和儿茶酚胺合成的底物[10,17]。肥大细胞可分泌吲哚胺(5-羟色胺)和儿茶酚胺等多种生物胺[14],且5-羟色胺是黑色素合成的前体物质[15]。5-羟色胺也能够通过调控黑色素合成通路相关因子,影响黑色素的生成[26-27]。此外,儿茶酚胺物质——多巴胺可通过黑素细胞的β2-肾上腺素受体和cAMP信号促进黑色素合成[16]。这些研究结果提示,肥大细胞可通过释放多巴胺或/和5-羟色胺影响黑色素的合成。本试验研究结果表明,在适宜的浓度范围内,L-酪氨酸浓度与胸腺肥大细胞数量正相关。饲喂较多的L-酪氨酸,一方面L-酪氨酸可直接作为黑色素合成的底物;另一方面可能导致肥大细胞具有充足的底物合成和分泌儿茶酚胺或5-羟色胺,这些物质也可作为黑色素合成的前体物,给黑色素合成提供充足的原料,促进黑色素生成量。
4 结 论
饲料L-酪氨酸添加浓度在0~0.8%范围内,随着L-酪氨酸浓度增加,胸腺肥大细胞的数量也增加,并在浓度0.8%时肥大细胞达到峰值,提示在适宜浓度范围内,L-酪氨酸可促进胸腺肥大细胞的成熟和发育。肥大细胞可合成和释放儿茶酚胺,这些物质是黑色素合成的前体物质,因此L-酪氨酸可能通过增加肥大细胞数量,提升儿茶酚胺水平,促进黑色素的合成。本试验结果有助于理解禽类体内黑色素生成的细胞学机理。

