奶山羊乳铁蛋白的原核表达及其多克隆抗体的制备
钟玉玲,代邦国,杜伟伟,张华文,李 纯,史怀平
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
乳铁蛋白(lactoferrin, LF)的大小约为80 kDa,属于转铁蛋白家族的一种,也被叫做转铁蛋白。其最初是在牛奶中以铁结合糖蛋白的形式被发现,后来在人乳中被纯化为含铁的红色蛋白,因此也被称为红蛋白。研究表明,LF广泛存在于诸如泪液、唾液、精浆和鼻、胰、胃肠、支气管的分泌物中,但主要还是存在于哺乳动物乳汁中,且初乳中含量较高,常乳中含量较低。研究表明,LF在生物体的免疫调节、生理代谢、稳态维持等方面具有重要的功能,是先天免疫的重要组成部分,可以刺激宿主免疫系统的发育,作为生长因子刺激细胞的增殖与分化。同时,LF还具有抗癌和抗氧化活性,能够调节癌细胞凋亡相关基因的表达和细胞周期蛋白激酶的活性,抑制癌细胞的生长。此外,LF能够调节体内铁元素的动态平衡,促进组织和细胞的生长,还可以作为肉类产品保鲜剂和动物饲料添加剂。
目前在牛和人上对基因相关研究及其抗体制备的相关研究较多,而对于奶山羊LF蛋白抗体制备的研究报道较少,王建等通过用纯化的牛LF蛋白直接免疫家兔,得到了牛LF蛋白的特异性多抗。鉴于此,本试验用奶山羊LF蛋白序列片段构建了原核表达载体并诱导表达,并用纯化后蛋白免疫4月龄雌性新西兰大耳兔,制备出能够特异性识别奶山羊LF蛋白的多克隆抗体,并检测该抗体的效价和特异性,为奶山羊LF蛋白功能的研究提供试验材料。
1 材料与方法
1.1 试验材料
奶山羊乳腺上皮细胞(GMEC) 、pcDNA3.1-LF质粒、pET-32a(+)原核表达质粒、pMD19-T质粒由西北农林科技大学动物科技学院奶山羊实验室提供;TOP10感受态细胞、BL21感受态细胞(北京天根生物公司);通用性DNA回收试剂盒、质粒小提试剂盒、Ni-NTA Resin 蛋白纯化试剂盒(南京金斯瑞生物公司);限制性内切酶I、d III,Prime STAR MAX-DNA 酶,T4 DNA连接酶及其buffer(大连宝生物工程公司); DL 2000 DNA Maker、Trans2K Plus II DNA Maker与GenStar Color Prestained protein maker(北京全式金生物技术公司);β-Actin鼠单克隆抗体、抗His-Tag鼠单克隆抗体、山羊抗兔IgG HRP和山羊抗鼠IgG HRP(北京CWBIO生物公司);异丙基-β-D-硫代半乳糖苷(IPTG)、TMB底物显色剂(北京天根生物公司)。
1.2 试验方法
1.2.1基因分析 将山羊()与兔()的基因序列进行比对(NCBI blast),筛选出差异性较大的片段。利用 DNASTAR 软件及在线分析网站进行分析:根据有无跨膜区段、灵活区域、抗原指数与表面可及性等指标选取目标片段;经综合分析,选取制备多克隆抗体的最适氨基酸序列,基于目的蛋白的特性选择合适的表达体系。
1.2.2 原核表达载体构建 通过1.2.1中的分析结果选取基因CDS区第930~1209位序列共279 bp片段做原核表达,选择pET-32a(+)质粒并根据合适的酶切位点设计引物LFF、LFR扩增片段。
LFF:5'-CCCAAGCTTATGCCAGAAGGCCGGAGGGACCTGCTAT-3',LFR:5'-CCGCTC GAGTTAACCAGGGCGATGCAGTCGTCGGTGG-3',下划线部分分别为Ⅲ和Ⅰ酶切位点。以实验室之前构建的pcDNA3.1-LF质粒为模板,扩增奶山羊LF第930~1209位序列,反应体系为:2×Prime STAR MAX 10 μL, pcDNA3.1-LF质粒0.2 μL,LFF primer 0.5 μL, LFR primer 0.5 μL,ddHO 8.8 μL,总体积20 μL。常规PCR后,将产物于 12 ℃保存。电泳检测并回收目的片段。
将空白质粒与目的片段的双酶切产物连接,组成原核表达载体pET-32a(+)-LF。将原核表达载体转入TOP10感受态细胞,提取菌液中的质粒进行双酶切鉴定。根据鉴定结果,将鉴定正确的质粒送测序公司做进一步测序。
1.2.3 诱导及鉴定 将测序正确的质粒和空载质粒分别转入BL21大肠杆菌,接种于固体培养基,挑菌于液体LB培养基中继续培养6 h。 取100 μL菌液与10 mL液体LB培养基混合培养,检测菌液OD值在0.4~0.6。将上述2种菌液以有无加入IPTC(0.5 mmol/L)各自分为处理组和对照组,37 ℃继续诱导培养4 h,离心取其沉淀,制备成蛋白样并进行电泳和染色检验。用免疫印迹法鉴定重组蛋白,用鼠单抗(抗His-tag)为一抗,羊抗鼠多抗(HRP标记)为二抗,通过ECL曝光显影观察是否具有His标签,确定重组蛋白的表达。将上一步收集的菌体沉淀进行超声破碎,离心,将沉淀和上清分别置于离心管中,用5×SDS laoding buffer混合,制备成蛋白样进行电泳分析。
1.2.4 LF蛋白的纯化 将目的蛋白菌液1 000 mL离心弃上清,加入超声保护液混匀后进行超声破碎,再次离心后非变性重组蛋白存在于上清中,用亲和层析介质纯化该蛋白。将重组蛋白于配制好的洗涤液(pH 8.0)中洗脱,取Ni柱吸附前后溶液及3次洗脱液进行聚丙烯酰胺凝胶电泳与考马斯亮蓝染色,检测蛋白纯化的程度,并对其进行透析和浓度测定。
1.2.5 LF纯化蛋白的免疫注射 将弗氏完全佐剂(Freund complete adjuvant,FCA)和LF纯化蛋白进行等体积混合乳化,皮下6点注射免疫4月龄雌性新西兰大耳兔,第1次注射2周后再用LF纯化蛋白和弗氏不完全佐剂(Freund incomplete adjuvant,FIA)等体积混合乳化,进行第2次注射,10 d后用FIA与LF纯化蛋白混合物进行第3次注射,之后每隔10 d注射1次,方法与2次免疫相同,每次每只兔接受注射蛋白的量均为0.8 mg。第5次注射后1周,采集足够的血液,离心后收集上层血清,用于检测抗体效价与特异性。用上述步骤中的洗脱液注射对照兔,其他条件与试验组保持一致。
1.2.6 LF多克隆抗体的效价和特异性检测 将对照兔血清和LF蛋白抗血清按照1:10,1:10,1:10,..., 1:10的比例稀释作为一抗。将LF纯化蛋白调整到浓度为10 μg/mL, 96孔板内各孔的操作如下:(1)加100 μL LF纯化蛋白,4 ℃放置12 h;(2)再加150 μL 封闭液, 37 ℃恒温放置2 h;(3)将96孔板内液体弃去,洗涤后加入100 μL先前制备好的血清,37 ℃保存1 h;(4)弃去孔内液体,PBS洗涤3次,加入150 μL IgG-HRP(1∶1000稀释),37 ℃,30 min;(5)拍干孔内液体,PBS 3次,加入200 μL TMB显色液,37 ℃避光1 h;(6)加入终止液,用酶标仪检测各孔OD值, 处理组吸光度/对照组吸光度>2.5可确定抗体有效。
以LF原核表达蛋白、奶山羊乳腺上皮细胞蛋白为样品,以β-Actin作为内参,用半干转膜法转膜后,常温封闭4 h,洗脱3次, 4 ℃过夜孵育β-actin鼠单抗,洗涤后用山羊抗鼠多抗室温孵育2 h, 洗涤后用ELC进行结果观察;用一抗稀释液将血清稀释500倍,用来孵育转有LF原核表达蛋白、山羊乳腺上皮细胞蛋白的膜,4 ℃孵育12 h。同时,对照组为用阴性血清孵育转有GMEC蛋白的膜,以山羊抗兔多抗作为二抗,将其在室温条件下孵育到洗净的NC膜上,孵育时间为2 h,最后通过ELC曝光观察结果。
2 结果与分析
2.1 LF基因的生物信息学分析
蛋白跨膜结构预测分析结果见图1。由于山羊基因全长无跨膜区段,因此整段序列都适合用来制备抗体。根据该序列的表面可及性分析及其灵活性的分析图谱显示,N端25~100位氨基酸、中间240~450位氨基酸及C端540~670位AA序列的表面可及性良好,更有可能暴露在蛋白表面,便于被抗原识别(图2)。而通过抗原指数分析结果表明,基因全长的抗原指数都较高,全部序列都具有明显的抗原决定簇特征(图3)。
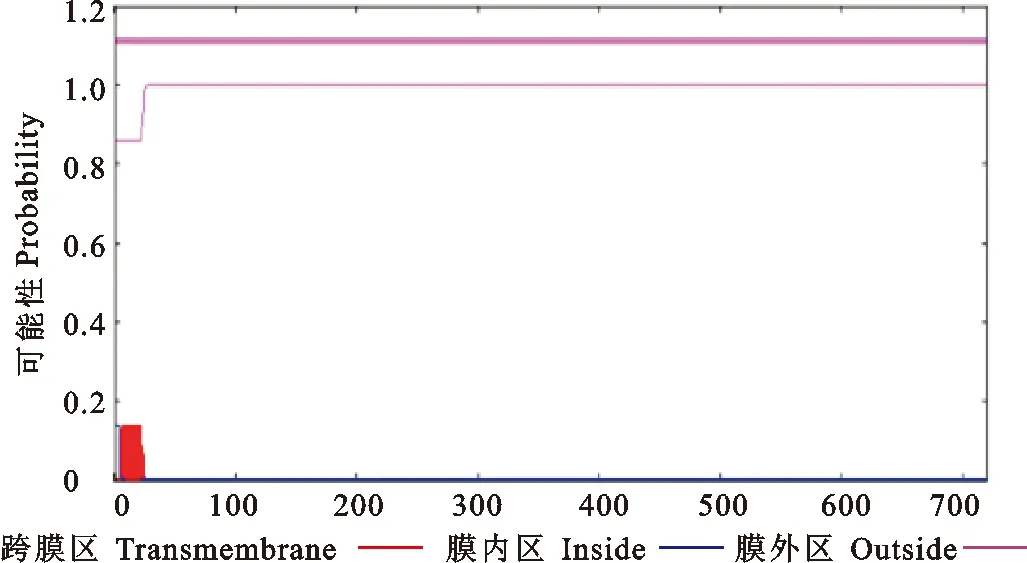
图1 LF蛋白的跨膜结构域Fig.1 Transmembrane domain of LF protein
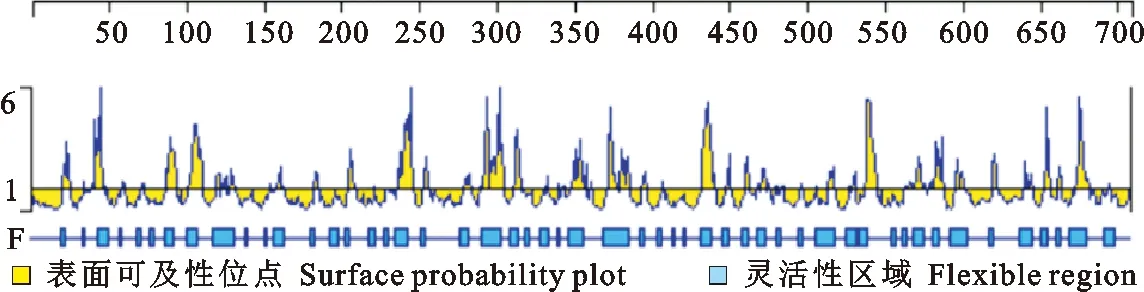
图2 LF序列的表面可及性与灵活性分析Fig.2 Surface probability and flexibility plot for LF
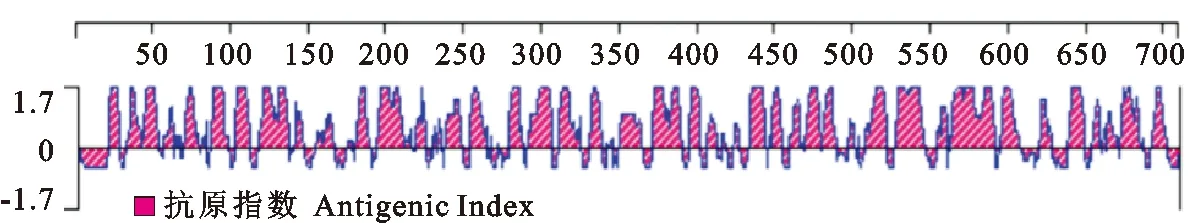
图3 LF蛋白抗原决定簇Fig.3 The prediction of antigenic index for LF
在NCBI上将奶山羊的LF序列与兔子的LF序列进行比对,结果显示二者序列的同源性为74%,其中LF两端的序列与兔的同源性较高,不能用来制备抗体。因此选择中间第311~403位氨基酸序列来进行抗体制备。对该段序列中潜在的稀有密码子筛查结果表明,序列中有4个稀有密码子(图4),可能会对蛋白的表达造成限制,而Rosseta系列菌株可以补充这一缺陷,能够提高真核质粒在原核体系中的表达效率。该段所选序列表达的蛋白大小预测值为10.1 kDa。

图4 LF蛋白序列的稀有密码子稀有密码子Fig.4 The analysis of rare coden for LF Rare codon
2.2 pET32a(+)-LF原核表达载体的构建
用实验室保存的pcDNA3.1-LF质粒当底物,用带酶切位点的引物进行目的片段的克隆,电泳结果显示,在297 bp(含有18 bp的酶切位点)处有目的条带 (图5A)。对pET32a(+)-LF重组质粒进行Ⅰ、Ⅲ双酶切鉴定,在约300 bp处显示有载体片段(图5B)。测序结果显示,片段已成功与原核表达载体连接。

图5 奶山羊LF片段扩增(A)及pET32a(+)-LF重组质粒鉴定(B)M1. DL 2000 DNA Maker; 1. LF片段PCR产物;M2. Trans2K Plus II DNA Maker; 2. pET32a(+)-LF质粒酶切产物Fig. 5 PCR amplification of LF fragment (A) and identification of pET32a(+)-LF recombined vector (B)M1. DL 2000 DNA Maker; 1. PCR product of LF fragment;M2. Trans2K Plus II DNA Maker; 2. Enzymatic digestion of recombined vector pET32a(+)-LF
2.3 奶山羊LF截短蛋白的诱导表达及鉴定
通过聚丙烯酰胺凝胶电泳结果显示,转入pET32a(+)-LF重组质粒的3~8泳道检测到29 kDa左右的LF重组蛋白条带,而对照组的空载体蛋白样在相同的大小无融合蛋白条带,仅出现19 kDa大小的标签蛋白条(图 6A)。利用anti-His tag鼠单抗作一抗,山羊抗鼠IgG做二抗,通过蛋白免疫印迹法检测目的蛋白的His tag,结果表明LF截短型蛋白在BL21大肠杆菌中正确表达(图6B)。
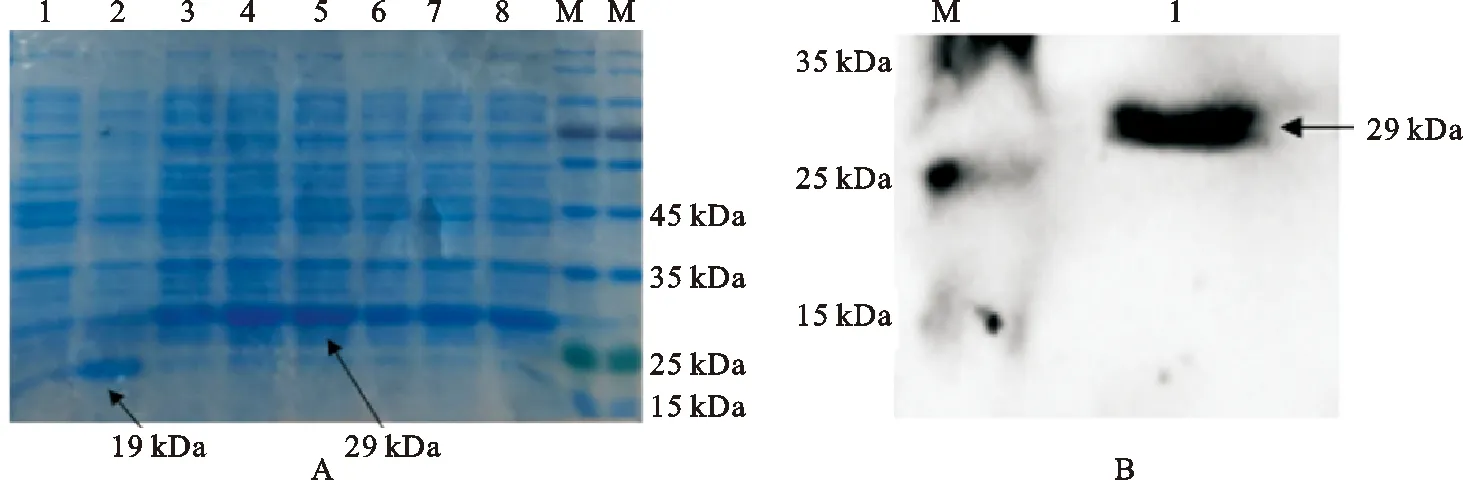
图6 奶山羊LF重组蛋白的SDS-PAGE鉴定(A)及Western blot检测(B)M. GenStar Color Prestained蛋白maker;1. 重组质粒菌液诱导前;2. 空载体菌液诱导后;3~8.重组质粒菌液诱导后; 9. pET32a (+)- LF原核表达蛋白样品Fig. 6 SDS-PAGE (A) and Western blot identification of LF recombinant protein from dairy goat M. GenStar Color Prestained protein maker; 1. pET32a (+)- LF before induction; 2. pET32a (+) after induction;3~8. pET32a (+)- LF after induction; 9. prokaryotic expression protein of pET32a (+)-LF
2.4 奶山羊LF重组蛋白的纯化
在16 ℃、26 ℃和37 ℃ 3个温度,2 h、4 h、6 h、8 h、10 h 5个诱导时长,0.1 mmol/L、0.5 mmol/L、1.0 mmol/L、1.5 mmol/L和2.0 mmol/L 5种浓度IPTG的诱导下表达目标蛋白,并对不同条件下得到的蛋白进行SDS-PAGE分析,结果表明:在温度为37 ℃,IPTG浓度为0.5 mmol/L,诱导时长为4 h的条件下,诱导表达的效果最佳。
在最适条件下,诱导出大量的LF菌液,并将其离心,倒掉上清,在沉淀中加入超声保护液混匀后进行超声破碎,并再次离心,将离心后的上清和沉淀分别制备成蛋白样进行蛋白电泳后用考马斯亮蓝染色,脱色后发现,目的蛋白大部分都以可溶形式存在于上液清中(图7A),并未形成难溶的包涵体。使用Ni-NTA Resin进行蛋白纯化发现,在29 kDa处出现一条明显的蛋白条带(图7B);进一步纯化后检测,LF重组蛋白纯度在98%以上,蛋白浓度为2.2 mg/mL。
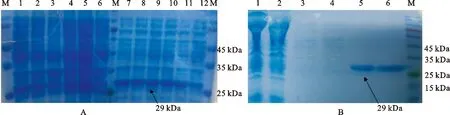
图7 奶山羊LF重组蛋白的纯化
2.5 奶山羊LF蛋白多克隆抗体的效价检测
免疫流程结束后,采集新西兰大耳兔全血,使用iELISA方法对试验组和对照组兔子的血清效价进行测试,测试结果表明制备的血清抗体效价达1:10(图8)。
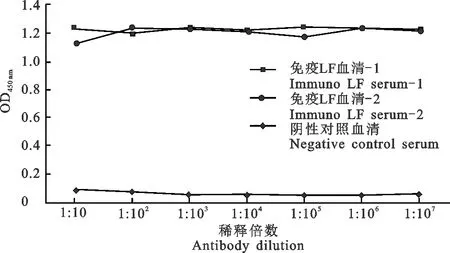
图8 iELISA测定LF蛋白多克隆抗体效价Fig. 8 iELISA determined the titer of polyclonal antibody against LF protein
2.6 奶山羊LF蛋白多克隆抗体的特异性检测
将制备好的多克隆抗体用脱脂奶粉5%稀释500倍后进行Western blot分析检测。以原核表达的截短LF重组蛋白为样品检测发现,在分子量29 kDa处出现明显的条带(图9A)。以乳腺上皮细胞蛋白样为样品检测发现,在大概80 kDa处检测到单一的蛋白条带(图9B),这表明制备的抗体不仅能够识别选取片段表达的截短蛋白,也能够识别奶山羊乳腺上皮细胞中LF蛋白。同时对照组的NC膜在相同位置则没有显示(图9C)。以上结果显示,制备的山羊LF抗体对奶山羊乳腺上皮细胞中的LF蛋白具有较好的特异性。
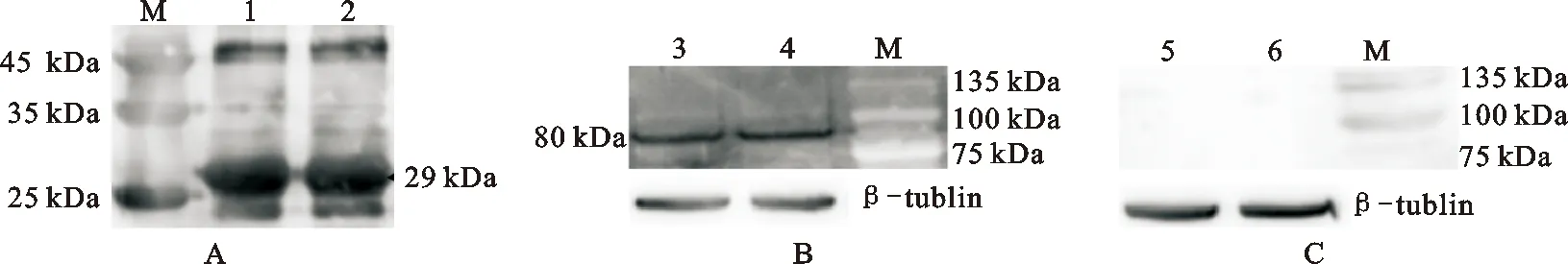
图9 LF蛋白多克隆抗体的特异性检测A. 原核表达的LF重组蛋白(以抗血清为一抗);B. 山羊乳腺上皮细胞蛋白样(以抗血清为一抗);C. 山羊乳腺上皮细胞蛋白样(以阴性血清为一抗);M. GenStar Color Prestained 蛋白maker;1~2. 原核表达的LF重组蛋白;3~4. 山羊乳腺上皮细胞蛋白样;5~6. 山羊乳腺上皮细胞蛋白样Fig. 9 Specific detection of LF protein polyclonal antibodiesA. Prokaryotically expressed LF recombinant protein (rabbit positive serum as primary antibodies); B. Goat mammary epithelial protein (rabbit positive serum as primary antibodies); C. Goat mammary epithelial protein (rabbit negtive serum as primary antibodies) M. GenStar Color Prestained protein maker; 1~2. Prokaryotically expressed LF recombinant protein;3~4. Goat mammary epithelial protein; 5~6. Goat mammary epithelial protein
3 讨 论
羊奶中含有多种生物活性物质,LF就是其中一种重要的多功能乳蛋白,它能够利用自身特殊的蛋白结构结合铁离子,维持机体内铁的动态平衡,还具有强大的防止细菌真菌感染作用、抗炎作用和抗癌作用。在机体发生感染时,LF在宿主对传染源的防御中起重要的作用。相关研究报道,LF可以通过与细胞内毒素主要成分-脂多糖的lipid A结合,来抑制TLR4信号通路,降低IL-8、IL-6、IL-1β等促炎症因子的分泌,提高抗炎因子IL-10的水平,达到抑制炎症反应的效果。由于LF具有许多重要的生物学功能,因此对LF基因在体内的表达调控的研究具有重要的意义,目前的研究结果显示,LF的表达受到营养、发育和生长因子等外源性因子以及转录因子、核受体等内在性因子的影响,但LF表达的转录后调控的研究十分稀少。因此,制备针对LF蛋白的有效抗体显得十分必要。
本研究在选择作为抗原进行表达的序列时,对LF全长序列进行了跨膜区域、表面可及性、灵活性及抗原指数等方面的详细分析。结果表明,N端311-403位共92个氨基酸序列与兔的乳铁蛋白序列差异较大,且亲水性、表面可及性、灵活性较好,并且通过后续的免疫试验证明,所选的抗原具有良好的免疫原性,满足作为抗原制备抗体的条件。
在原核表达载体的选择上,与pQE、pMAL、pBV、pGEX等系列表达载体相比较,最终选择了pET系列载体中的pET-32a (+)表达体系,因为该体系表达出重组蛋白的能力较高且该载体的酶切位点与目的序列中的酶切位点相匹配。同时该载体上还带有6个His标签,能够附着在所表达的蛋白尾部,这一特点在下一步的蛋白鉴定和纯化试验中提供了极大的便利。在对目标蛋白进行诱导表达时,发现在未进行诱导的蛋白泳道,也会在相应位置出现少量蛋白条带,可能是由于液体培养基的成分之一——胰蛋白胨中含有少量的乳糖,可以与IPTG一样对原核表达载体进行诱导表达,因此电泳时也会出现少量本底表达。
在对LF重组蛋白进行Western blot检测时发现,蛋白被检测到的大小的位置略小于预测值,而被检测蛋白预测的分子量为29 kDa,可能是由于电泳显示的蛋白大小与理论计算值存在偏差,此外,蛋白样的不同上样体积也可能对蛋白电泳速度造成影响。在对制备的抗体进行特异性检测时,使用奶山羊乳腺上皮细胞蛋白进行Western blot,结果发现在乳铁蛋白全长80 kDa处出现了清晰单一的条带,而使用对照组血清作为一抗时,在相同位置没有出现条带,这表明本次试验制备的LF兔抗山羊多克隆抗体能够对奶山羊乳腺组织中的LF蛋白进行特异性识别。
4 结 论
本试验对基因序列进行生物学分析,选择了最适合制备抗体的序列并进行克隆,用鉴定正确的序列构建原核表达载体。在BL21大肠杆菌中以最适的条件(37 ℃, IPTG 0.05 mmol/L, 4 h)成功诱导表达出了LF截短型蛋白。以该蛋白为抗原制备出了针对奶山羊LF蛋白的多克隆抗体,效价检测结果显示该抗体效价达到1:10, Western blot 结果显示该抗体的特异性良好,可以用作LF基因功能研究的试验材料。
——一道江苏高考题的奥秘解读和拓展

