一种席夫碱Zn2+荧光探针的设计合成与即时Zn2+标记成像
冯凯茵, 尉祎雯, 李旭安, 雷舒萍, 张雪娇, 成 昭
(西安医学院 药学院, 陕西 西安 710021)
以锌为代表的d族元素与人类认知活动密切相关,是脑部具有最高浓度与活度分布的金属[1]。在脑部锌的主要存在形式中,含量约占总锌数值10%的游离Zn2+表现快速浓度变化与较高活跃度,以自由离子形式实现快速转运、参与脑部动态锌调控及分布。在以阿尔茨海默症(AD)为代表的认知障碍疾病发生发展进程中,离子稳态致病理论目前普遍认为,游离Zn2+浓度水平异常[2-3]初见于血液,继而引发血脑屏障损伤、引起脑脊液中Zn2+信号异常,最终通过跨膜转运[4-5]并结合功能性蛋白质分子,转化为结合Zn形式,影响神经元功能,加速疾病进程,引起认知障碍[6]等典型的AD临床症状。临床数据显示,AD患者脑部斑块锌含量可达1 000 mmol/L[7],远高于同年龄段健康人群约300 mmol/L的数值。但是,现阶段临床检测方法不能区分游离Zn2+、结合Zn,锌含量临床测定方法只能给出将两者简单加和的总锌数值,无法反映作为AD早期阶段重要指征之一的游离Zn2+动态浓度异常,也无证据显示游离Zn2+与总锌数值的变化趋势是否一致。
在此现状下,如何在游离Zn2+浓度异常与AD等认知障碍疾病指征的研究中构建合理模型,示踪游离Zn2+转移、储存及分布的动态过程[8],将是回答AD早期阶段游离Zn2+作用的关键。本文基于键合-信号输出型探针的结构特点[9-10],引入席夫碱结构作为目标探针的识别基团[11],构建新型Zn2+荧光探针P1(图1),并将其进一步应用于Zn2+的定性检测和定量分析。探针P1结合待测物Zn2+后,荧光基团的光学信号输出因分子结构改变而出现显著增强[12],呈现荧光快速激发与发射、Zn2+特异选择性、荧光稳定性良好等特点,可用于Zn2+的定量检测,具有进一步应用于生命体环境中Zn2+荧光标记的良好前景。
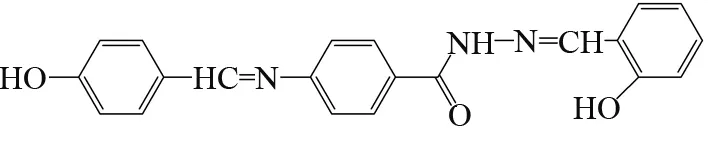
图1 探针P1的结构Fig.1 Structure of probe P1
1 实验部分
1.1 仪器及试剂
XT-4显微熔点仪,北京泰克科技有限公司;TENSOR T-27红外分光光度计,美国布鲁克科技有限公司;AVANCE III 400MHz超导核磁共振波谱仪,美国布鲁克科技有限公司;microTOF-QⅡ ESI-Q-TOF LC/MS/MS飞行时间-质联仪,美国布鲁克科技有限公司;varioEL Ⅲ元素分析仪,德国艾力蒙塔仪器有限公司;LS-55荧光分光光度计,美国铂金埃尔默仪器有限公司;U-LH 100 hG IX73倒置荧光显微镜,日本奥林巴斯仪器有限公司;1510 Mwltiskan Go多功能酶联检测仪,美国赛默飞世尔科技有限公司。
对氨基苯甲酸、水合肼、水杨醛、对羟基苯甲醛等试剂均为市售化学纯,实验中未进行进一步纯化处理。
1.2 合成
以对氨基苯甲酸、水合肼、水杨醛、对羟基苯甲醛为原料,经三步合成得到席夫碱结构的新型Zn2+荧光探针P1,探针合成路线如图2。
1.2.1 对氨基苯甲酰肼的合成
将1.81 g (13.2 mmol)对氨基苯甲酸溶于20 mL无水乙醇,再向上述溶液中缓慢滴加1.00 mL (19.8 mmol) 98%水合肼,回流4 h,旋干得粗品,柱层析分离得到对氨基苯甲酰肼(展开剂为体积比1∶1的乙酸乙酯-石油醚),白色固体,1.67 g,产率83.7%。
对氨基苯甲酰肼:熔点225~227 ℃;IR(KBr压片):3 345.84 cm-1(υ-NH-),1 715.30 cm-1(υC=O),1 281.52 cm-1(υC-N);1H NMR (400 MHz, CDCl3)δ:8.73 (m, 1H, -NH-),7.21 (m, 2H, Ar-H),6.76 (d,J= 7.1 Hz, 2H, Ar-H),4.66 (s, 2H, -NH2),3.16 (s, 2H, -NH2)。
1.2.2 水杨醛-对氨基苯甲酰腙的合成
将1.51 g(10.0 mmol)对氨基苯甲酰肼溶于20 mL无水乙醇,再向上述溶液中缓慢滴入1.30 mL(11.0 mmol)98%水杨醛,回流0.5 h,冷却至室温后、以乙醇重结晶,得到水杨醛-对氨基苯甲酰腙,黄色片状晶体,2.19 g,产率85.9%。
水杨醛-对氨基苯甲酰腙:熔点139~140 ℃;IR(KBr压片):3 433.40 cm-1(υ-OH),1 716.13 cm-1(υC=O),1 623.14 cm-1(υC=N),1 280.06 cm-1(υC-N);1H NMR (400 MHz, CDCl3)δ:12.16 (s, 1H, -OH),11.27 (s, 1H, -NH-),8.73 (s, 1H, =CH-),8.14 (m, 2H, Ar-H),7.72 (m, 2H, Ar-H),7.14 (m, 2H, Ar-H),6.77 (m, 2H, Ar-H),6.05 (s, 2H, -NH2)。
1.2.3 探针P1的合成
将2.17 g (8.50 mmol)水杨醛-对氨基苯甲酰腙与1.24 g (10.2 mmol)对氨基苯甲醛溶于30 mL无水乙醇中,于80 ℃下回流反应12 h,蒸除溶剂得探针粗品,柱层析分离得到探针P1(展开剂为体积比3∶2的乙酸乙酯-石油醚),黄色固体,2.54 g,产率83.1%。
探针P1:熔点260~262 ℃;IR(KBr压片):3 424.49 cm-1(υ-OH),1 715.40 cm-1(υC=O),1 598.10 cm-1(υC=N),1 280.98 cm-1(υC-N);1H NMR (400 MHz, CDCl3)δ:12.66 (s, 1H, -OH),9.01 (s, 1H, -NH-),8.04 (m, 4H, Ar-H),7.71 (d,J= 7.7 Hz, 4H, Ar-H),7.56~7.41 (m, 4H, Ar-H),7.01 (s, 2H, 2×=CH-),3.87 (s, 1H, -OH);HRMS:探针P1的分子式为C21H17N3O3,理论相对分子质量为359.378 0,飞行质谱实测[M+Na+]峰m/z= 382.623 8,与其理论相对分子质量[M+Na+] = 382.367 8基本吻合;EA:C 70.16%,H 4.69%,N 11.77% (calc. for C21H17N3O5: C 70.18%, H 4.77%, N 11.69%)。
2 结果与讨论
2.1 结构表征
合成中间体对氨基苯甲酰肼与水杨醛-对氨基苯甲酰腙的红外光谱中,官能团氨基、羟基、羰基与碳氮键均呈现其特征吸收,此外,两种中间产物的特征氢位移均能由1H NMR进行归属,与文献所述的结构表征数据相符,证明其结构正确。另由探针P1的IR、1H NMR、EA与MS等表征数据可知,探针结构正确,符合实验预期设计,可以进行进一步的光学性质研究。
2.2 光学性质研究
2.2.1 探针P1的荧光光谱
分别配制1)浓度为1×10-5mol/L的探针P1溶液,2)P1与Zn2+终浓度分别为1×10-5mol/L与2×10-5mol/L的P1-Zn2+混合溶液,进行375~525 nm波段扫描,得到如图3所示的P1与P1-Zn2+荧光激发与发射光谱。

图3 P1与P1-Zn2+体系的荧光激发与发射光谱Fig.3 Excitation and emission spectra of P1 and P1-Zn2+
由图3可知,P1与P1-Zn2+体系均呈现良好的镜像对称关系[13](λex= 401 nm,λem= 483 nm);体系P1与P1-Zn2+的斯托克位移保持一致,均为82 nm。
2.2.2 探针P1的金属离子选择性
设计以Ni2+、Hg2+、Fe3+、Pd2+、Zn2+等17种常见金属离子,考查探针P1对金属离子的选择性。于编号0的10 mL比色管中加入探针P1溶液,于编号1~17的10 mL比色管中,分别加入探针P1与金属离子溶液,使P1与金属离子的终浓度均为1×10-5mol/L,混匀后进行440~520 nm波段扫描,得到图4。
17种金属离子:Ni2+、Hg2+、Fe3+、Pd2+、Pb2+、Al3+、Mg2+、Ca2+、Mn2+、Cd2+、 Sn2+、Cu2+、Cr3+、Na+、Ag+、Ba2+、Zn2+图4 探针P1的离子选择性(Tris-HCl,pH = 7.4)Fig.4 Fluorescence intensity changes of probe P1 upon the addition of various metal ions inmixed solvents (Tris-HCl, pH = 7.4)
由图4可知,加入Zn2+后,探针P1的荧光强度显著增强,Zn2+之外的其他金属离子则未引起探针P1荧光强度的明显变化。说明探针P1对Zn2+呈现特异性的选择,能够进行水系Zn2+的高选择性识别与荧光标记。
2.2.3 探针的Zn2+荧光滴定曲线
于一系列10 mL比色管中加入探针P1溶液,使其终浓度为1×10-5mol/L,再分别加入浓度依次递增的Zn2+溶液,使其终浓度为0.1~100 μmol/L,混匀后扫描440~520 nm波长范围,得图5。
如图5所示,当Zn2+浓度从0.1至100 μmol/L递增时,探针P1的荧光强度随Zn2+浓度升高而依次增强。以Stern-Volmer方程进行荧光强度峰值与Zn2+浓度的相关性分析[14-15],得到F/F0与[Zn2+]的线性关系:y= 0.610 4x+ 1.042 7(R2= 0.966 8,F:P1-Zn2+体系荧光强度峰值,F0:P1荧光强度峰值,图6)。当Zn2+浓度范围处于0~10 μmol/L时,探针荧光强度与Zn2+浓度具有良好的线性关系,能够进行Zn2+浓度的准确定量分析,络合常数Ka= 1.64 × 106,检出限为0.592 μmol/L,能够初步满足mmol/L数量级的生理Zn2+浓度检测。

图5 Zn2+对探针P1的荧光滴定曲线Fig.5 Fluorescence titration curve of probe P1 with Zn2+

图6 探针P1与Zn2+的线性关系Fig.6 Linear relationship of P1-Zn2+
2.2.4 探针P1与Zn2+的络合比
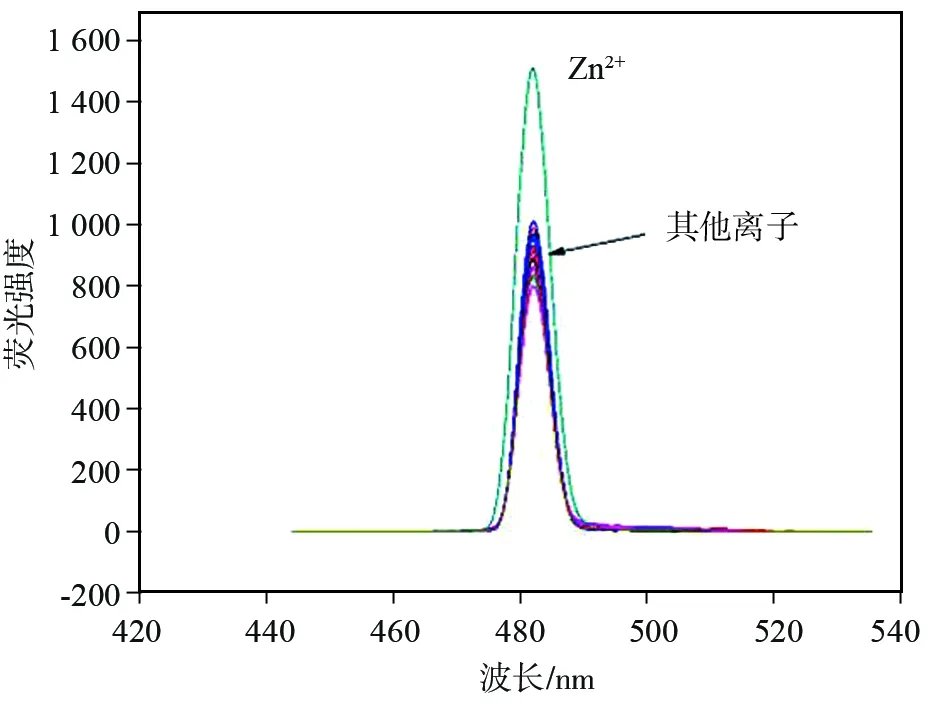
为了更好地确定P1与Zn2+结合的定量关系,设计测定探针P1与Zn2+的络合比,分别于编号1~11的10 mL比色管中,加入体积依次递增的Zn2+溶液和体积依次递减的探针P1溶液,保持探针P1与Zn2+的总浓度为1×10-4mol/L,使其中Zn2+的物质的量分数分别为0、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,进行荧光强度峰值分析,得到探针荧光强度与Zn2+物质的量分数的关系,即图7所示的Job’s曲线。
结果显示,Zn2+的物质的量分数为0.5时,在其荧光最大发射波长483 nm处,探针P1-Zn2+络合物出现荧光强度的最大值,表明探针与Zn2+的定量结合比例是1∶1。
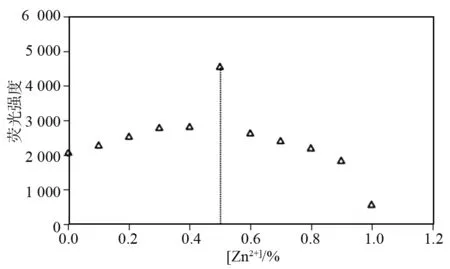
图7 探针P1与Zn2+的Job’s曲线Fig.7 Job’s plot of P1-Zn2+
2.2.5 荧光强度对pH的稳定性
生命体中的Zn2+,多存在于水系的体液、血液中,水系游离Zn2+的配位能力,可能受pH环境的影响[16],进而可能影响探针-Zn2+的特征荧光响应。为了验证探针应用于生命体中Zn2+标记时的荧光稳定性,设计以浓度为0.01 mol/L、pH = 6~9的Tris-HCl缓冲溶液体系,考查P1-Zn2+体系的荧光强度在pH变化时的稳定性。分别配制pH为6~9、间隔0.2个pH单位的一系列Tris-HCl缓冲溶液,对终浓度为1×10-5mol/L的P1-缓冲溶液和P1与Zn2+终浓度为1×10-5与2×10-5mol/L的P1-Zn2+-缓冲溶液体系,分别进行荧光最大发射波长483 nm处的荧光强度分析,得到图8。
图8 P1与P1-Zn2+体系荧光强度随pH的稳定性Fig.8 pH dependence of P1 in the absence and presence of Zn2+
从图8中P1-缓冲溶液与P1-Zn2+-缓冲溶液体系的荧光强度变化趋势可以看出,在与血液等体液生理pH相近的 pH = 6~9的弱酸性至弱碱性环境中,体系P1-缓冲溶液与P1-Zn2+-缓冲溶液的荧光强度几乎不受溶液pH波动的影响。在生理pH波动的环境中,探针P1对Zn2+的检测表现出较好的稳定性,具有进一步应用于细胞环境及生物体中Zn2+荧光标记的良好前景。
2.2.6 荧光强度对时间的稳定性
配制浓度为1×10-5mol/L的探针P1溶液,置于37 ℃恒温,以1 h为取样间隔、进行0~24 h的连续取样,分别进行探针P1荧光最大发射波长483 nm处的荧光强度分析,得到荧光强度对时间的稳定性(图9)。
由图9可知,探针P1在483 nm处的荧光稳定性良好,24 h内几乎不受时间影响,能够满足进一步进行生命中Zn2+延时标记成像的要求。
2.3 探针识别机制
基于键合-信号输出型探针结构特点,进行探针P1的分子结构设计,构筑共轭结构、以柔性链连接识别基团与荧光基团,探针的席夫碱识别基团在结合Zn2+之后,分子结构扭转,刚性增强,荧光基团的光学信号输出因而出现显著增强。因席夫碱识别基团形成了对目标物Zn2+的特定包合空腔[17-18],探针P1呈现对目标物Zn2+的1∶1特异性结合,能够很好地进行Zn2+的定性检测和定量分析,可能识别机制如图10所示。
对探针P1与Zn2+反应后的结构进行飞行质谱分析,得到图11,以进一步验证探针P1对目标物Zn2+的识别机制。

图9 探针P1荧光强度随时间的稳定性Fig.9 Time dependence of P1 (10 μM)
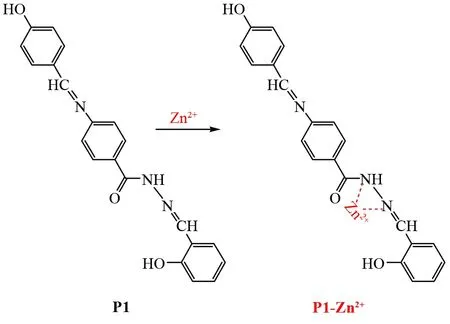
图10 探针P1识别Zn2+的可能作用机制Fig.10 Recognition mechanism of probe P1 to Zn2+
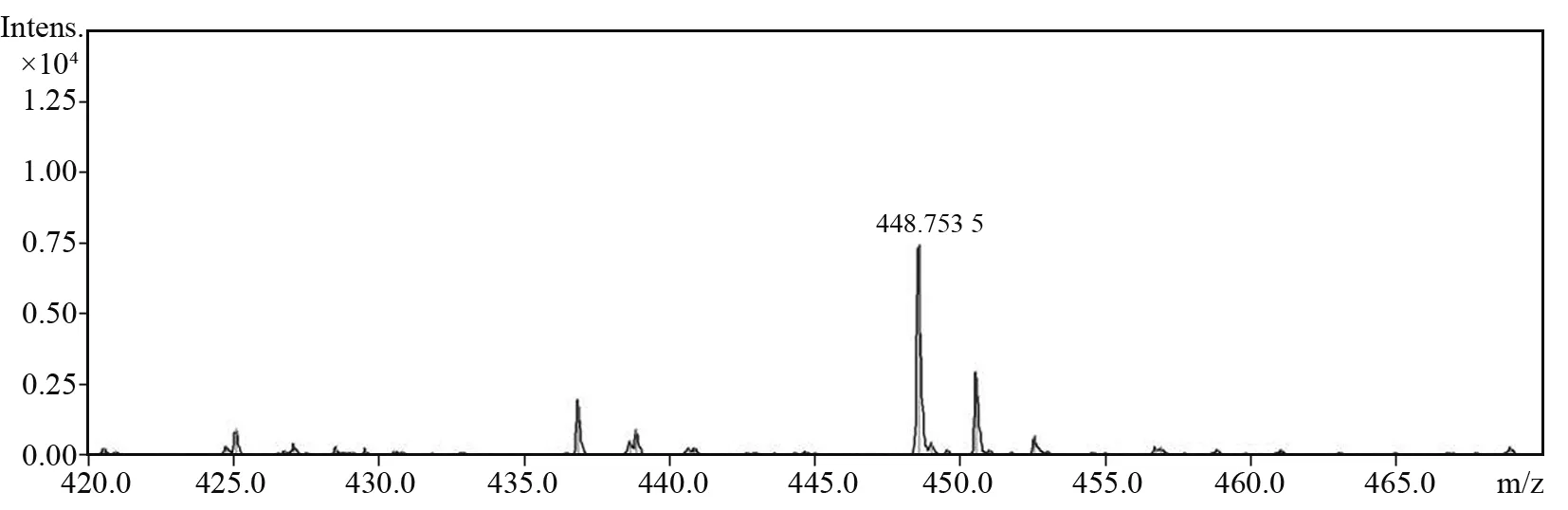
图11 P1-Zn2+络合物的高分辨质谱Fig.11 HRMS analysis of the complex P1-Zn2+
由图11中P1-Zn2+的飞行质谱实测[M+Na+]峰:m/z=448.753 5,与其理论相对分子质量[P1-Zn2++Na+]m/z= 447.757 7基本吻合,有效地论证了反应的机理。
2.4 细胞毒性评价
采用MTT法[19]进行探针P1的体外细胞毒性评价,取对数生长期的人脐静脉内皮细胞株ECV304制备细胞悬液,密度约为5×104个/mL,加入96孔板中,每孔细胞数约8 000~10 000个,待细胞贴壁后,探针P1样品按50、25、12、6、3、1.5 μmol/L浓度依次递减,加入各自组中,每组为2个平行孔,设定0.1% DMSO为溶剂对照。加药后置于37 ℃、5% CO2的细胞培养箱中培养24 h。实验终止前4 h每孔加入100 μL浓度为5 g/L的MTT溶液,再培养4 h,测定前彻底弃去培养液,每孔加入150 μL DMSO,使用酶标仪在490 nm处测定OD值,计算得到细胞增殖抑制率% = [(1-OD药液/OD对照)×100%](图12)。

图12 探针P1对ECV304细胞的24 h增殖抑制作用Fig.12 Cytotoxicity of the probe P1 on ECV304 at 24 h
图12结果显示,探针P1对EVC304细胞未显示显著抑制作用。探针P1在ECV304细胞中的增
殖抑制作用随自身浓度增加而增大,就其浓度增幅的整体趋势而言,探针P1呈现低毒性。
2.5 体外ECV304细胞成像
取对数生长期的ECV304制备细胞悬液,保证细胞密度约为5×104个/mL,加入6孔板中,使每孔细胞数约为8 000~10 000个。待细胞贴壁后,将50 μmol/L探针P1溶液加入各孔中,加药后置于37 ℃、5% CO2的细胞培养箱中培养30 min后用PBS buffer清洗三次,倒置荧光显微镜观察,可看到清晰的细胞荧光表达。100倍下,在明场中拍摄聚集生长且形态完整良好的细胞,并在暗场中拍摄荧光成像(图13)[20]。
从图13中可看到,荧光共聚焦显微成像实验中,探针P1作用下的ECV304细胞形态完整、荧光信号清晰、成像效果良好,说明探针P1对Zn2+的荧光标记产物具有较好的透膜性与低毒性,探针P1具有进一步应用于生命体中Zn2+标记示踪的良好前景。

图13 探针P1在体外ECV304细胞中对Zn2+的荧光成像:(a) P1暗场;(b) P1-Zn2+暗场;(c) P1-Zn2+明场Fig.13 (a) Fluorescent images of ECV304 in vitro incubated with 10 μM P1 for 30 min at dark field; (b) a further incubation with 10 μM Zn2+ for 2 h at dark field; (c) bright-field image of (b)
3 结论
创新性地引入席夫碱母核结构与具有特征性吸收的C=N键,通过三步合成、得到对Zn2+表现特征荧光响应的一种新型席夫碱Zn2+荧光探针P1。光学性质实验显示,探针P1对Zn2+具有特异性响应、荧光性能稳定,探针与Zn2+表现良好的线性关系,两者络合比为1∶1,络合常数Ka= 1.64 × 106,探针对Zn2+的检出限为0.592 μmol/L,探针P1能够进行水体系中Zn2+的定性检测和定量分析,初步满足mmol/L数量级的生理Zn2+浓度检测。进一步的体外活细胞荧光成像实验证明了探针-Zn2+荧光标记产物的良好透膜性与低毒性,对生物学、医学等学科领域的生命体Zn2+动态标记研究均具有一定应用前景。

