长链非编码RNA HIF1α-AS1在血管内皮细胞缺氧损伤中的作用研究
王 微,王 岩,王超君,卢芳芳,凌 静
0 引 言
长链非编码RNA(long non-coding RNAs,lncRNA)与癌症发生、血栓形成、动脉粥样硬化等疾病过程均有一定的相关性[1-5],并通过多种不同机制调节转录因子的功能[6-8]。机体缺氧可能导致内皮功能障碍、系统性炎症及氧化应激等,进而产生的氧自由基能够介导脂质过氧化损伤,是血管内皮损伤的主要诱因之一。为探讨lncRNA在缺氧后血管内皮损伤及修复过程中的机制,通过原代培养的人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC)建立氧糖剥夺模型,筛选95种lncRNA在缺糖缺氧后的含量变化情况。其中长链非编码RNA缺氧诱导因子-1alpha-反义链1(long non-coding RNA hypoxia-inducible factor-1alpha-antisense RNA-1,lncRNA HIF-1α-AS1)表达量上升最为显著。缺氧诱导因子-1α(hypoxia-inducible factor-1alpha,HIF-1α)作为转录调节因子,在与缺氧相关的心血管疾病、癌症等发生发展过程中起着重要作用[9-12]。有研究表明,高水平的HIF1α提示机体处于缺氧应激状态[13],HIF-1α表达与动脉粥样硬化性炎症斑块表型相关,并在活化的巨噬细胞中上调[14]。而LncRNA HIF-1α-AS1在缺氧相关疾病中的报道较少,本研究选择lncRNA HIF1α-AS1作为缺氧应激的目标基因开展研究,旨在探索lncRNA HIF-1α-AS1与血管内皮细胞缺氧应激损伤的联系。
1 材料与方法
1.1 细胞及试剂①细胞来源:在无菌条件下,取健康产妇胎儿新鲜脐带(产妇知情同意并自愿捐献),长约 20 cm,浸泡在添加抗生素的 M199 培养基中,4 ℃保存,在2 h 内用于实验。②试剂:胎牛血清(Gibco BRL 公司),胰蛋白酶(Hyclone 公司),M199高糖培养基(Gibco BRL公司),DAB 试剂盒(中山公司),PrimeScriptTMRT Master Mix(RR036A TaKaRa),Premix Taq(RR901A TaKaRa),UltraSYBR Mixture(CW0956 北京康为世纪生物科技有限公司),BCA蛋白测定试剂盒(P0010 碧云天生物技术研究所),RIPALysis buffer(sc-364162 美国Santa Cruz公司),HIF-1α一抗(sc-13515美国Santa Cruz公司),超氧化物歧化酶1(superoxide dismutase1,SOD1)一抗(sc-8636美国Santa Cruz公司),β-actin 一抗(4967 美国CST公司),辣根过氧化物酶标记的二抗(A0545 Sigma),ECL化学发光检测试剂盒(BU-WB-03 南京铂优生物技术有限公司)。
1.2 HUVEC培养原代培养将脐带剪去两端(约2 cm),注入1×PBS反复冲洗脐静脉数次,注入15 mL的 0.125%胰蛋白酶,待脐静脉充盈,使内膜与胰蛋白酶充分接触,轻柔挤压管壁,将含有内皮细胞的胰蛋白酶注入50 mL离心管,加入 M199 高糖培养基5 mL终止酶反应,再以10 mL 1×PBS冲洗管腔,流出液倒入离心管,离心半径13.5 cm,1400 r/min 离心10 min,弃上清,加入培养液制成细胞悬液。调整细胞数,以1×105/mL 接种至纤维连接蛋白预包被的培养皿中。置于5% CO2,37 ℃静止培养 4 h,更换培养液,除去未贴壁的细胞。每隔2天换液1次,以维持细胞营养及内环境稳定。传代培养:细胞长至单层融合时,弃去培养液,1×HEPES洗涤,加入1 mL 0.125%胰蛋白酶消化,将液体弃去,加入培养液5 mL吹打细胞至悬浮,在新的培养板中加入1 mL细胞悬液和4 mL HUVEC培养液,置于细胞培养箱(37 ℃,5% CO2)培养。
1.3 氧糖剥夺模型(oxygen-glucose deprivation,OGD)和细胞凋亡检测HUVEC细胞上清液更换为无糖培养基,并置于三气培养箱(5% CO2/1% O2/94% N2)中。以无氧糖剥夺组作为对照,OGD 24,48,72 h的血管内皮细胞作为实验组,分别用Hochest/Tunel形态学和流式细胞仪Annexin V/PI检测其凋亡水平。因48 h细胞凋亡率显著,后续试验均采用OGD 48 h。
1.4 实时荧光定量PCR筛选OGD后95种lncRNA的相对表达量细胞经OGD 48 h处理后弃去上清液,TRIZOL法提取细胞总RNA,检测A260/280,调整浓度并逆转录为cDNA。根据95种lncRNA序列分别设计引物并合成,采用ABI公司的StepOnePlus Real-time PCR System进行实时荧光定量PCR,筛选OGD后基因表达差异。RT-PCR反应条件为:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火/延伸1 min,40个循环,每循环一次溶解曲线分析一次,最后60 ℃ 15 s。数据处理以β-actin为内参,采用Ct值法(2-△△Ct法)分析目的基因的相对表达差异。
1.5 HIF-1α siRNA序列干扰根据GenBank数据库提供的人HIF-1α全长基因(No.nm_001530)设计合成的靶序列mRNA有4条,从5′-3′分别为:GGACACAGAUUUAGACUUG、GAUGGAAGCACUAGACAAA、CGUGUUAUCUGUCGCUUUG和GAUGAAAGAAUUACCGAAU。siRNA在GenBank数据库进行BLAST检索,仅与人HIF-1α序列相配。转染前24 h接种细胞六孔板和96孔板(培养液中不加抗生素)。24 h后吸弃上清,六孔板加入2 mL的转染混合物(含10%胎牛血清的HUVEC培养液+2 μmoL/L的siRNA+ Dharma FECT转染试剂+无抗生素HUVEC以一定比例混合);荧光标志的阴性对照用以评价转染率。96孔板加入100 μL转染混合物。置于37 ℃、5% CO2饱和湿度培养箱中培养24~48 h。弃去上清液,加入无血清HUVEC培养液(体积分数95% N2和5% CO2条件下培养)。取对数生长期且生长良好细胞用于后续实验。将细胞分成:阴性对照组(无任何靶基因的siRNA,并经缺氧处理)和3个lncRNA HIF-1α-AS1 siRNA干扰组(细胞经siRNA作用,并经缺氧处理)。含有荧光物质的siRNA转染后,荧光显微镜下观察转染效率,经RT-PCR检测靶基因判定是否干扰成功。
1.6 乳酸脱氢酶(lactate dehydrogenase,LDH)漏出率评价细胞损伤LDH能催化乳酸生成丙酮酸,丙酮酸与2,4-二硝基苯肼反应生成丙酮酸二硝基苯腙,在碱性溶液中呈棕红色,通过比色可计算出酶活性。细胞转染并OGD预处理后,每个样品收集培养液100 μL,加入基质溶液500 μL、辅酶I 100 μL,混匀后在37 ℃下水浴20 min。加入0.4 mol/L NaOH 5 mL,混匀,室温放置3 min,于440 nm处测定OD值,根据公式计算培养液LDH活性;将待测培养孔内细胞加入等量PBS,刮板刮取细胞并收集到管中,超声破碎后进行细胞匀浆液的LDH活性测定,方法与培养液测定方法相同。根据公式:LDH漏出率(%)=培养液LDH活性/(培养液LDH活性+细胞匀浆液LDH活性)×100%。
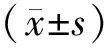
2 结 果
2.1 缺氧诱导脐静脉血管内皮细胞损伤Hochest/Tunel检测,与对照组4.86%±0.91%(0 h)相比,OGD 24 h细胞无明显凋亡,48 h、72 h细胞凋亡率显著增加,分别为5.98%±1.08%(24 h,P>0.05), 11.76%±1.59%(48 h,P<0.01)及19.39%±1.25%(72 h,P<0.01),见图1a。流式细胞仪(PI/Annexin V染色)检测结果与形态学检测趋势相同,与对照组3.37%±0.87%(0 h)相比,缺氧细胞凋亡率分别为5.97%±1.88%(24 h,P>0.05), 9.62%±2.63%(48 h,P<0.01),10.74%±2.56%(72 h,P<0.01),见图1b。后续实验均采用OGD 48 h。
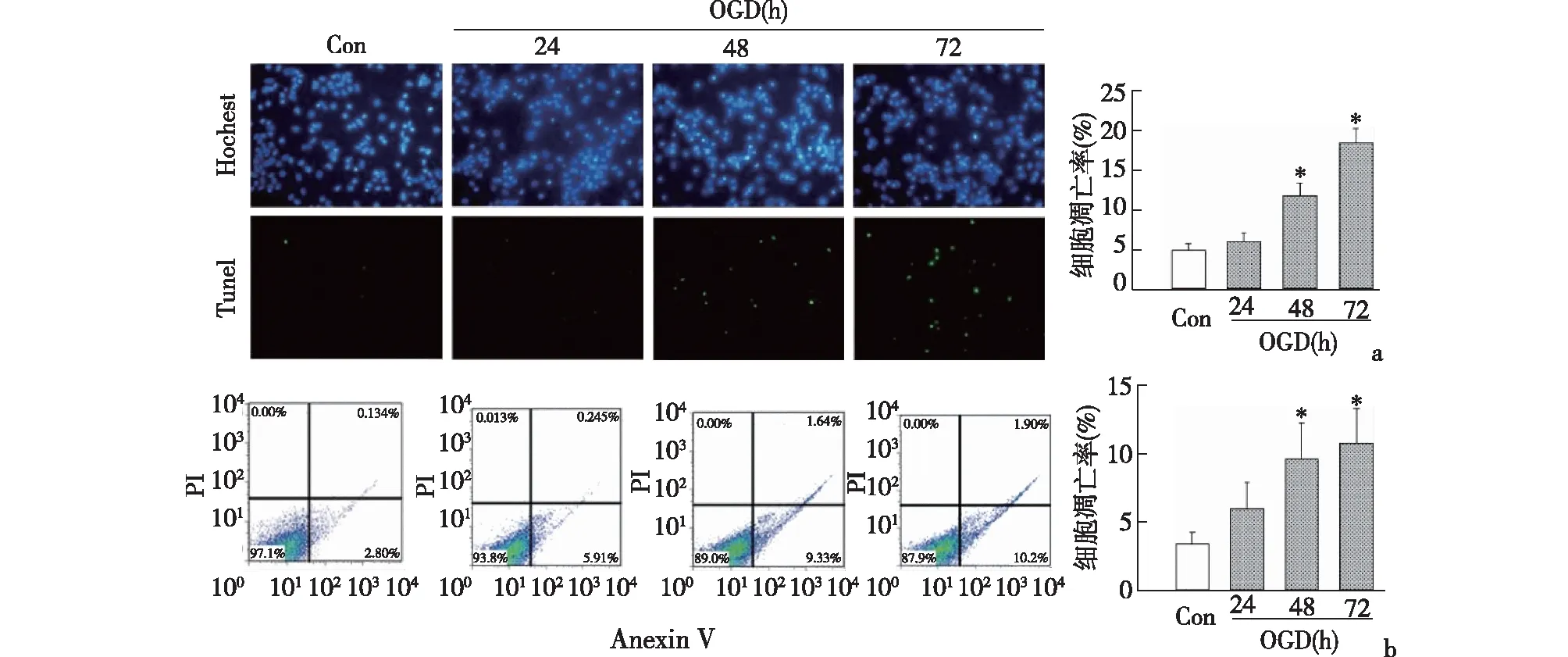
a: Hochest/Tunel检测细胞凋亡(×200);b:流式细胞仪检测细胞凋亡
2.2 RT-PCR筛选缺氧调控的lncRNAHUVEC细胞OGD 48 h后,RT-PCR检测出HIF1α-AS1、CDKN2B-AS5、BPESC1、CRB3-AS1、Fendrr等5个lncRNA上调表达,其中HIF1α-AS1上调1.98倍(P<0.05),见表1。

表1 RT-PCR筛选氧糖剥夺敏感的
2.3 HIF1a-AS1经siRNA处理后,HUVEC损伤减轻荧光标记的阴性对照提示同批次siRNA的细胞转染率约为75%。RT-PCR检测结果发现,相比于阴性对照组,siRNA1、siRNA2、siRNA3组siRNA干扰后相对表达水平有显著差异,分别为81.04%±8.98%(P<0.05),56.81%±4.97%(P<0.01),44.70%±2.12%(P<0.01),其中siRNA2和siRNA3干扰效果较好,见图2a。进一步检测转染后细胞的LDH漏出率,干扰内源lncRNA HIF1α-AS1后,与模型组26.17%±1.69%相比,siRNA1、siRNA2、siRNA3组LDH漏出率明显降低,分别为20.84%±2.64%(P<0.05),19.82%±1.61%(P<0.01),17.01%±0.24%(P<0.01),见图2b。
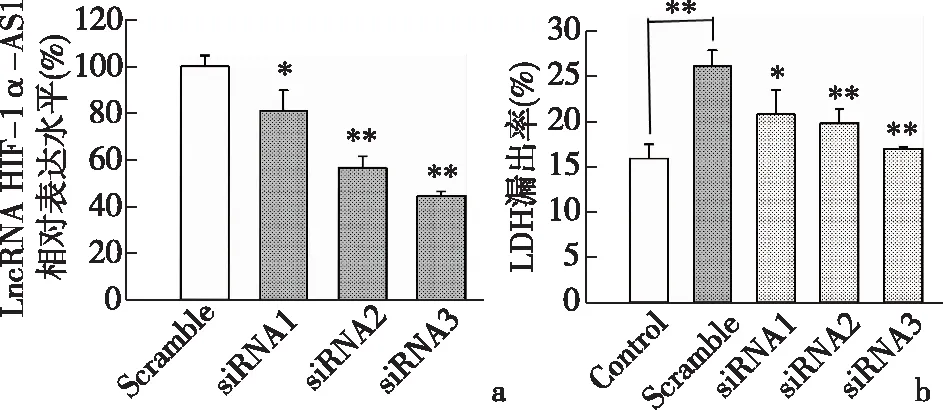
a: siRNA干扰后LncRNA HIF-1α-AS1的表达; b:siRNA干扰后LDH漏出率
2.4 siRNA 干扰lncRNA HIF-1α-AS1增加SOD1的mRNA水平及蛋白表达水平与对照组相比,siRNA2和siRNA3对lncRNA HIF-1α-AS1进行干扰后,2组SOD1基因mRNA水平显著上调,siRNA2组(P<0.01),siRNA3组(P<0.01),见图3a;2组SOD1蛋白表达量也明显上升,siRNA2(P<0.05),siRNA3(P<0.01),见图3b。
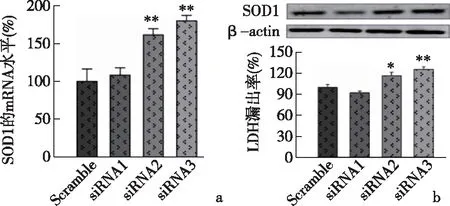
a:RT-PCR方法检测SOD1基因mRNA水平; b:Western blot方法检测SOD1蛋白水平
3 讨 论
lncRNA可多层面调控基因表达。本研究筛选出缺氧后差异表达上调的 lncRNA共5个,BPESC1与常染色体显性遗传病小眼睑综合征相关研究有见报道[15];CDKN2B-AS5是一种抑癌基因,在人类肿瘤细胞中表达异常[16];而Fendrr则是在控制胚胎中胚层分化成心脏和体壁过程中的特异性lncRNA[17];CRB3-AS1在前列腺癌组织中表达上调,同时调控细胞凋亡[18];其中HIF-1α-AS1上调1.98倍(P<0.05),其对应的转录因子HIF-1α与缺氧相关疾病有关且研究热度较高,故选择其非编码RNA作为目标基因,深入探究其与缺氧细胞损伤之间的关系。
细胞缺氧后转向无氧代谢,导致乳酸聚积而发生损伤,LDH会由细胞内漏出至培养液中,通过测定LDH漏出率能够比较客观地反映细胞受损情况,如有药物或基因干预,则可进一步评价干预因素的作用。SOD1又称Cu/Zn超氧化物歧化酶(Cu/Zn SOD),广泛分布于整个细胞,包括溶酶体,线粒体的膜间空间和内质网,构成了对抗氧化应激的前线防御机制,能够通过氧化还原反应将机体产生的自由基如超氧化物转化为分子氧和过氧化氢,以减轻细胞损伤[19]。在大量氧化应激下,缺乏SOD1的小鼠会表现出多种病理症状,包括肝细胞癌,寿命缩短等[20]。除了作为抗氧化酶,SOD1的新功能,包括暴露于氧化应激后核基因转录的激活,RNA代谢的调节等也有报道[21-22]。HUVEC缺氧后lncRNA HIF1α-AS1增加,细胞凋亡率升高、损伤加重。用siRNA干扰lncRNA HIF1α-AS1后,3个干扰组LDH 漏出率显著下降,siRNA2组和siRNA3组的SOD1基因mRNA水平显著上调,其SOD1蛋白表达量也明显上升,细胞损伤减轻,而siRNA1组干扰效率较低,细胞损伤虽然有所缓解,但 SOD1的蛋白量没有变化。提示lncRNA HIF1a-AS1含量变化幅度的大小对于细胞损伤的调节是有一定差异的。干扰lncRNA HIF1α-AS1后,通过上调SOD1表达而提高细胞的抗缺氧能力,减轻缺氧应激损伤,这是一种反向调节作用。
HIF-1α在常氧条件下通过蛋白酶体途径快速降解,而缺氧条件下,可通过调节糖酵解酶、乳酸脱氢酶和丙酮酸脱氢酶激酶的表达来下调线粒体的氧气消耗,使细胞转为无氧糖酵解途径。本研究通过构建lncRNA HIF1α-AS1沉默模型,检测缺氧条件下血管内皮细胞凋亡、损伤及细胞活力等状态,发现lncRNA HIF1α-AS1的高表达与细胞的凋亡率升高相关,而低表达时细胞活力增加。LncRNA并不编码蛋白,而是以RNA形式在表观遗传、转录及转录后调控基因的表达水平,参与细胞分化和发育[23]。结果提示缺氧诱导因子对于细胞低氧损伤的调节过程也可以通过lncRNA的形式参与,证实了lncRNA HIF1α-AS1可以作为防治缺氧内皮细胞损伤的靶标,但具体是在转录的哪个阶段调控还需要进一步的实验证实。
基于本研究结果,下步实验可以进一步探究凋亡相关的细胞信号通路,即有更加充分的分子生物学证据支持上述实验现象。另外,在动物模型上进行低压氧舱模拟上述各类缺氧环境,对比lncRNA HIF1α-AS1的基因敲除前后缺氧症状的差异,为血管内皮细胞损伤相关疾病(动脉粥样硬化、血栓形成等)的分子调控和药物治疗靶点提供依据。

