食品中黄曲霉毒素检测方法研究进展
胡冰, 时浩楠, 胡本伦, 赵思明, 刘茹, 贾才华
(华中农业大学食品科学技术学院,环境食品学教育部重点实验室,武汉 430070)
民以食为天,食品安全问题是关系国计民生的大事,其中,真菌毒素对食品的污染已成为各国高度关注的食品安全问题[1]。食品在受到真菌毒素污染后,不仅食用价值、营养价值和商品价值降低,还会对消费者的身体健康造成极大的伤害。此外,某些真菌毒素还具有致癌[2]、致畸[3]和致突变[4]作用。据FAO发布的统计数据,全球每年被真菌毒素污染的粮食约占粮食总产量的1/4,不仅造成大量浪费,还给世界农业和经济贸易的发展带来严重影响[5-7]。我国是受真菌毒素影响较为严重的国家之一[8],每年因真菌毒素污染粮食造成的直接经济损失达680亿~850亿元[9],而黄曲霉毒素(aflatoxin,AFT)是对人体危害较大且较常见的真菌毒素之一。鉴于此,本文概述了当前国内外关注度较高的黄曲霉毒素的检测方法,介绍了近几年检测技术的最新进展,分析了这些方法的优缺点,旨在为各类食品中黄曲霉毒素检测方法的选择提供参考,为解决我国有关真菌毒素污染的食品安全问题提供一定的技术支撑。
1 黄曲霉毒素概况
黄曲霉毒素是黄曲霉和寄生曲霉中产毒菌株的代谢产物[10],是一类结构相似的化合物,可分为B系和G系两个大类,其基本结构都有二呋喃环和香豆素,是二呋喃香豆素的衍生物。现已分离出 B1、B2、G1、G2、M1、M2、P1、Q1等十几种,其中B系为甲氧基、二呋喃环、香豆素、环戊烯酮的结合物;G系结构与B系类似,但其中的环戊烯酮被替换为环内酯。在自然环境下,从被AFT污染的食品中只检测出了黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)、黄曲霉毒素M1(AFM1)和黄曲霉毒素M2(AFM2)6种,结构见图1。
AFT对人和动物来说都是剧毒物,但不同种类的AFT之间毒性差异很大。AFB1的毒性最强[11-12],是氰化钾的10倍、砒霜的68倍,仅次于肉毒梭菌的代谢产物肉毒毒素,是当今发现的毒性最强的真菌毒素[13]。AFB1不仅具有极强的急性毒性,还具有慢性毒性[14],若在短期内大量摄入被AFB1污染的食品,会造成严重的肝损伤和胆管增生,危及生命;若在一段时间内持续摄入一定量的AFB1,则表现为生长障碍和慢性肝损伤[15]。此外,AFB1还是目前已知致癌性最强的毒物,1993年WHO就将其列为一类致癌物[16],主要诱发肝癌[17]。AFM1是动物摄入被 AFB1污染的饲料后在肝脏微粒体单氧化酶催化作用下产生的代谢产物[18],毒性仅次于 AFB1[19]。
AFT造成的食品污染在世界范围内相当广泛,其中AFB1主要污染对象为坚果类(花生、核桃、开心果、松子等)、谷物类(玉米、小麦、大米、高粱等)食品,尤其以花生、玉米受污染的程度最重[20],植物油、香辛料以及一些中药材也存在易受AFB1污染的问题。AFM1则通常分布于动物组织(肝脏、肾脏、肌肉)、动物体液(乳汁、尿液)和卵中[21],乳及乳制品受 AFM1的污染最为严重[22]。因此,许多国家都针对AFT制定了严苛的限量标准,FAO发布的世界食品和饲料真菌毒素法规显示,全球已有100多个国家和地区制定了各类食品中AFT的限量标准[23]。为便于比较国内外关于AFT限量标准的差异,表1梳理了我国食品安全国家标准GB 2761—2017[24],以及美国、食品法典委员会(Codex Alimentarius Commission,CAC)、日本和欧盟等国家、组织或地区对于AFT的限量标准[25-29]。
理化性质上,AFT具有极强的耐热性,普通的烹调方式难以将其完全破坏,280~300℃的高温才能将其裂解。AFT在水中的溶解度很低,但能溶于油脂和多种有机溶剂,经紫外线照射可产生荧光[30]。此外,AFT不耐碱,加碱处理也能使一些毒素丧失活性,若遇5%的次氯酸钠,则可瞬间被破坏。
2 食品中黄曲霉毒素的检测方法
目前,国内外应用较为广泛的食品AFT检测方法主要有仪器分析法(高效液相色谱法[31-32]、液相色谱−质谱法[33])、免疫分析法(酶联免疫吸附法[34]、时间分辨荧光免疫分析法[35]、胶体金免疫层析法[36])、表面增强拉曼光谱法[37]和电化学传感器法[38]等。
2.1 仪器分析法
2.1.1 高效液相色谱法 高效液相色谱(high performance liquid chromatography,HPLC)于 20世纪70年代获得迅猛发展,成为一种常规高效分离分析技术,是目前各种色谱模式中应用最为广泛的技术。HPLC分析的基本原理是以液体充当流动相,利用高压输液系统将流动相泵入装有固定相的色谱柱中,流动相中各种不同组分经色谱柱分离后进入检测器检测。AFT的检测普遍采用HPLC法,该方法不仅具有较高的检测分离效能,还可同时检测多种真菌毒素。

表1 国内外食品中黄曲霉毒素限量比较Table 1 Comparison of aflatoxin limits in food at home and abroad
由于食品中AFT的残留通常极其微量,故而HPLC法常与快速稳定的前处理方法结合使用,行之有效的前处理方法对于分析结果的准确与否起着决定性作用。在国家标准中,食品样品中AFT的提取、净化和富集方法有机溶剂用量大且操作过程较为繁琐,因而有必要开发出一种快速、高效的方法用于AFT的前处理。目前较为常用的是免疫亲和柱(immunoaffinity chromatography,IAC)净化法[39],该方法具有有机溶剂消耗少、基质干扰少、特异性强、灵敏度高和适用于各种复杂食品基质等特点[40]。周欣等[41]采用免疫亲和净化−高效液相色谱法测定了麦麸中4种AFT(AFB1、AFB2、AFG1、AFG2)的含量,样 品 提 取 后经IAC净化进行HPLC检测,最低检出限(limit of detection,LOD)分 别 为 5.6×10−4、2.3×10−4、1.08×10−3和 4.3×10−4µg·kg−1。然而 IAC 也存在一定的缺点,如柱子储存时间有限、不能回收利用且价格昂贵等。近年来,新型吸附材料制备技术的发展为食品中AFT残留的提取和净化提供了全新选择[42]。Saini等[43]基于固相萃取原理,以C18为吸附剂对饮用水中的痕量AFB1进行浓缩和富集,然后进行HPLC分析,样品LOD为0.012 ng·mL−1,定量限(limit of quantitation,LOQ)为 0.039 ng·mL−1,回收率为98.01%~98.65%,可用于饮用水中AFB1的痕量水平检测和定量。Mohammad等[44]制备了适配体功能化磁性纳米粒子(aptamer functionalized magnetic nanoparticles,AMNPs)充当吸附剂,用来提取和浓缩牛奶样品中的痕量AFM1,然后用HPLC进行定量分析,该方法的LOD为0.2 ng·L−1,是迄今为止所报道的最小值。
HPLC法虽具有较高的灵敏度和准确度,但样品需要经过复杂的前处理且经济成本较高;无法较好地掌握色谱分析条件,分析方法的建立较为耗时,不能满足大批量样品快速检测的需求;定性、定量分析均需要标准品作为参比;选择性较差,在使用反相色谱进行检测时常常会受到一些保留行为类似物质的干扰从而造成检测误差,梯度淋洗技术虽然可以较好地克服这个问题,但会延长样品的分析时间[45]。
2.1.2 液相色谱−质谱法 液质联用技术(liquid chromatogram tandem mass spectrometry,LC-MS)将液相色谱与质谱2种检测仪器有效结合,实现优势互补,液相色谱有对复杂样品的高效分离能力,而质谱具有的高选择性、高灵敏度以及能够提供物质相对分子质量与结构信息,LC-MS将二者的优点结合起来,显著提高了待测物定量分析的可靠性与准确度,具有较好的分离性能与高通量的检测水平[46]。鉴于气质联用技术在分析之前需要对样品进行衍生化处理(改变分析物的结构,使其沸点降低而易于离子化),较为复杂[47],在此不作介绍。
由于该方法兼具色谱对复杂样品的高效分离能力与质谱检测的通用性,故普遍适用于真菌毒素的检测且具有较高的灵敏度,近年来被广泛应用于真菌毒素的筛检中[10],亦可实现对多种真菌毒素的定性和定量分析。LC-MS在分析前,通常需要将样品中的待检组分提取出来,较为常用的方法是溶剂一步提取法。Deng等[48]采用LC-MS对海产品中的4种真菌毒素(AFB1、T-2毒素、赭曲霉毒素A和脱氧雪腐镰刀菌烯醇)进行了同步测定,样品经乙腈−水(85/15,体积分数)溶液提取后,用正己烷脱脂净化,随后进入仪器,该方法对4种真菌毒素的LOD为0.1~2.0 µg·kg−1,LOQ 为 0.3~5.0 µg·kg−1,回收率为72.2%~98.4%。Varga等[49]用乙腈−水−甲酸(79/20/1,体积分数)处理小麦样品中的12种真菌毒素,LCMS定量,LOQ为0.02~161 µg·kg−1,回收率为88%~120%。传统的一步提取法虽然具有处理简单、目标成分损失少等优点,但仍存在一定的局限性,其在提取过程中有机溶剂用量相对较大,同时在对于一些成分复杂的食品基质进行提取时,样品中其他成分可能会被一并提取出来,影响分析结果的准确性并造成质谱检测器进样口的污染[50]。QuEChERS法很好地克服了以上问题,它不仅大大降低了有机溶剂的使用,节约了时间和成本,而且具有较强的抗干扰能力和更高的回收率[51]。Miro-Abella等[52]用植物性饮料样品测试了其提取回收率,结果在80%~91%,样品提取后经LC-MS分析,植物性饮料中AFB1和AFG1的LOQ分别为15和0.05 µg·L−1。 Ouakhssase 等[53]采 用 改 进 的QuEChERS方法对玉米样品中4种AFT(AFB1、AFB2、AFG1和AFG2)进行提取,该方法溶剂用量少且无需纯化步骤,提取完成后进行LC-MS分析,LOD为0.11~0.36 µg·kg−1,LOQ为0.36~1.19 µg·kg−1,均低于欧盟规定的最高允许水平,除AFB2外回收率均在70%~110%。
LC-MS法无需对样品进行衍生处理,具有分离能力强、灵敏度高、特异性好的特点,能较好满足食品中AFT检测的要求,但要求测试人员必需掌握一定的专业知识,否则难以操作;高昂的仪器成本;分析测试通常只能在实验室中进行,不能满足现场检测的要求等制约了其进一步推广。因此,开发易操作、低成本、可用于现场检测真菌毒素的LC-MS技术已成为未来研究的热点。表2列举了不同方法的特点和应用效果,以便更加直观地对比每组方法。
2.2 免疫分析法
2.2.1 酶联免疫吸附法 酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)是将待测物的抗原(或抗体)吸附于固相载体表面,加入酶标记的抗体(或抗原),使其在固相载体表面发生抗原抗体结合反应,再添加酶反应的底物,显色后即可根据颜色的深浅、有无进行定性或定量分析。为了进一步提高ELISA的灵敏度以满足痕量检测的需要,Zhan等[54]开发了一种动态光散射−直接竞争酶联免疫吸附法(dynamic light scattering-direct competitive ELISA,DLS-dcELISA),用于超灵敏检测玉米中的AFB1。该方法采用基于散射的DLS信号来代替传统的基于吸收的比色信号作为免疫分析信号输出,利用葡萄糖氧化酶(glucos oxidase,GOx)氧化葡萄糖生成过氧化氢(H2O2)的特点,将GOx作为AFB1的载体制备了GOx-AFB1竞争抗原,生成的H2O2可在辣根过氧化物酶(horseradish reroxidase,HRP)和酪胺(TYR)存在的条件下触发胶体金纳米粒子(gold nanoparticle,AuNP)聚集,从而显著放大AuNP的散射信号,再将散射信号整合到dcELISA中进行 AFB1的检测(图 2)。LOD 为 0.12 pg·mL−1,比传统的比色ELISA法低约385倍,样品平均回收率为90.6%~107.0%。由于传统ELISA法在测定时常会出现假阳性和假阴性的现象,为了避免这一现象的发生,Xu等[55]建立了一种基于金属−有机框架(metal-organic framework,MOF)的间接竞争酶联免疫吸附测定法。该方法将传统ELISA法中的天然酶替换为功能性MOF,以催化生色 系 统 ,LOD 为 9×10−3ng·mL−1。 与 传 统 的ELISA相比,针对AFB1开发的MOFLISA法的LOD值提高了20倍,样品回收率和相对标准偏差分别为86.41%~99.74%和2.38%~9.04%,有效降低了假阳性和假阴性结果的出现频率。
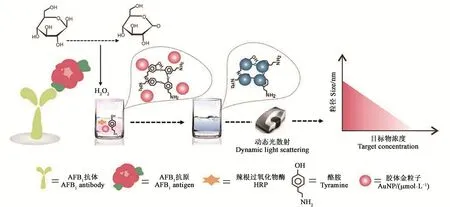
图2 DLS-dcELISA法结合H2O2介导的TYR信号放大系统[54]Fig.2 DLS-dcELISA method combined with H2O2-mediated tyramine signal amplification system[54]
近年来,ELISA凭借灵敏度高、特异性强、检测速度快、检测成本低等优点已被广泛应用于各学科的分析测试中,成为我国谷物、粮油和其他食品国家标准规定的真菌毒素筛选和检测方法。但仍存在一些不足,如测定时缓冲溶液的性质(pH、离子强度等)[56]、温度等因素会显著影响测定结果的准确性,需要准确把控;标记物酶稳定性差、易失活;检测结果重复性差且无法同时检测多种真菌毒素;自动化程度低及假阳性频率高等。
2.2.2 时间分辨荧光免疫分析法 时间分辨荧光免疫分析法(time-resolved fluoroimmunoassay,TRFIA)是一种新型超微量检测技术,其利用具有独特荧光特性的镧系元素及其螯合物作为示踪物来标记抗原(抗体),再结合高灵敏度的时间分辨技术测量荧光,对波长和时间2个参数进行信号分辨,可较大程度地减少背景干扰,提高检测结果的准确性[57]。在食品真菌毒素的检测中,常用的反应体系有抗原抗体免疫反应、核酸探针杂交反应和靶细胞与效应细胞的杀伤反应等,测试物经反应体系作用后进行反应产物荧光强度测定,进而在标准荧光曲线上查出反应体系中测试物的浓度,实现精确定量[58]。Guo等[59]开发了牛乳中AFM1的间接竞争TRFIA法:首先,将AFM1与牛血清蛋白(bovine serum albumin,BSA)偶联,形成AFM1-BSA结合物抗原,加入抗AFM1抗体进行孵育,AFM1-BSA结合物抗原与抗AFM1抗体发生特异性结合形成AFM1-BSA-抗AFM1抗体复合物;再加入铕(Eu)标记的羊抗兔抗体(goat anti rabbit IgG-Eu)进行二次孵育,孵育完成加入增强液,用全自动时间分辨荧光免疫分析系统进行定量分析(图3)。此方法对AFM1的LOD为6×10−3µg·kg−1,LOQ为0.022 µg·kg−1。卢迪莎等[60]开发了一种基于TRFIA的试纸,可同时筛检玉米样品中的AFB1和赭曲霉毒素A:首先以Eu系时间分辨荧光微球标记AFB1和赭曲霉毒素A单克隆抗体制备荧光探针,而后与免疫层析试纸条进行组装;组装后的试纸条对2种真菌毒素的肉眼LOD分别为 3.70、5.55 µg·kg−1,整个测试过程约为 20 min且开发的试纸条性质稳定可在4℃保存5个月以上,能较好满足大批量样品现场筛检的要求,应用前景广阔。目前该方法仅限适用于玉米样品的筛检,对AFT类似物也存在较高的交叉反应,还需进一步深入研究来克服这些问题。
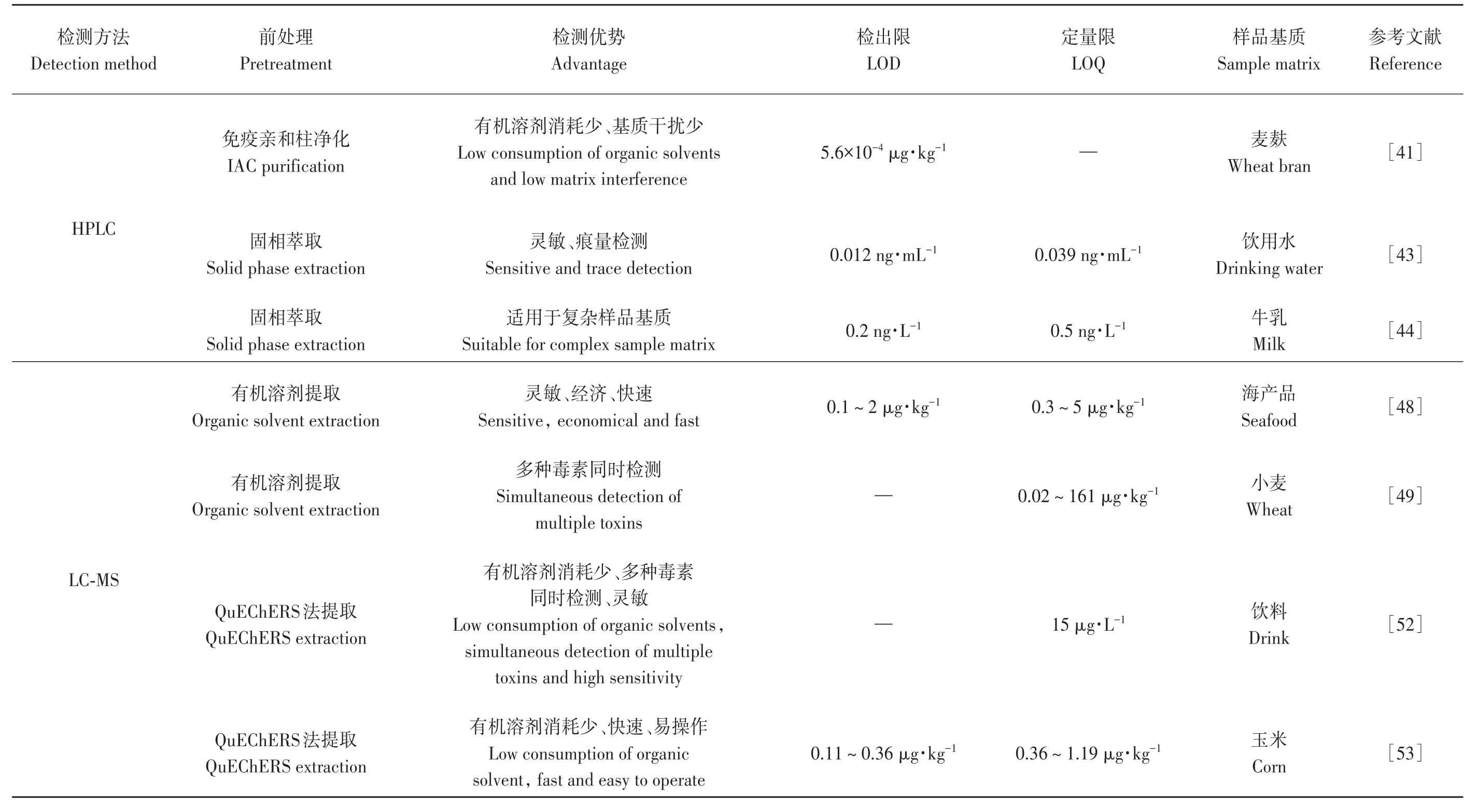
表2 仪器分析法检测食品中的黄曲霉毒素Table2 Determination of aflatoxin in food by instrumental analysis
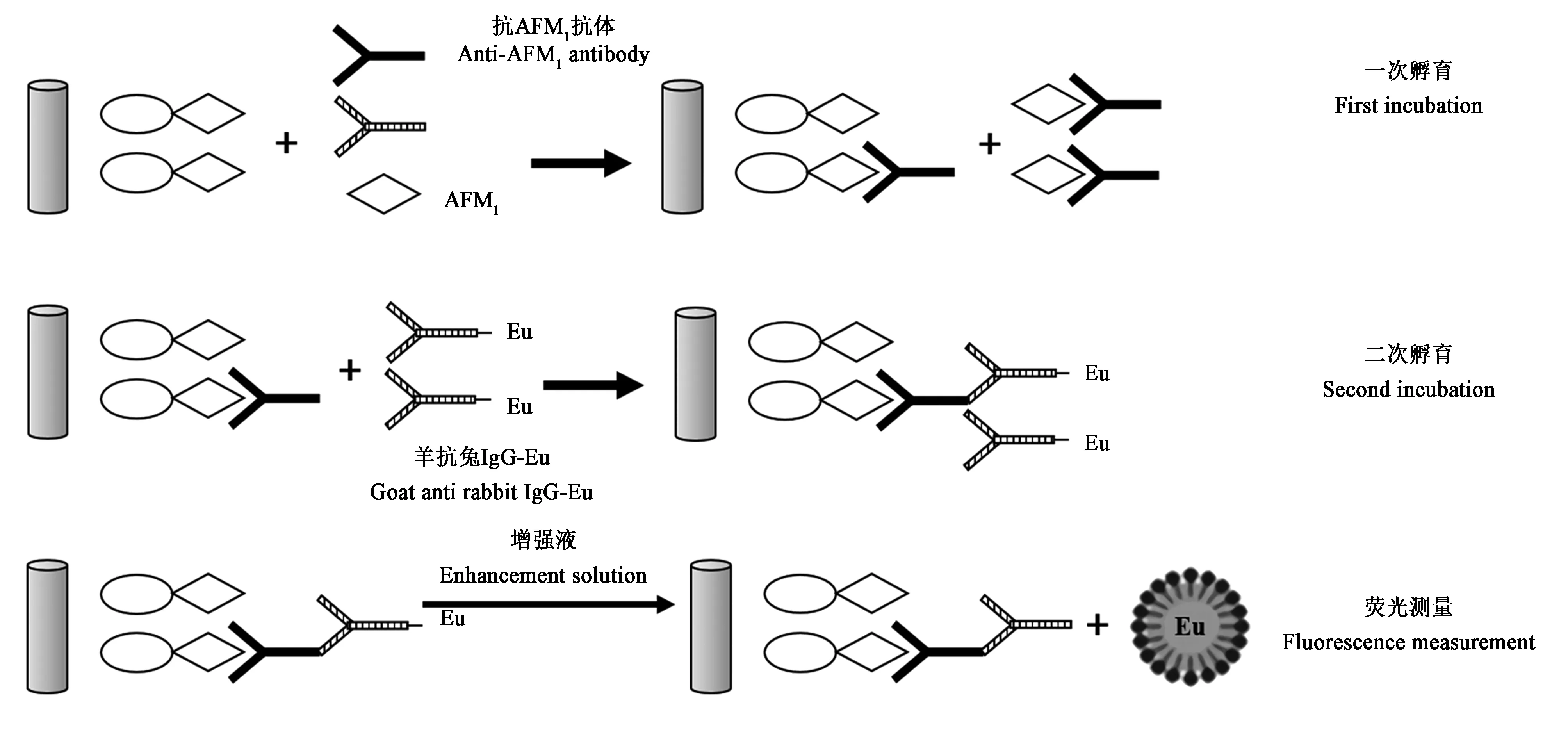
图3 间接竞争TRFIA法检测AFM1原理[59]Fig.3 AFM1detection by indirect competitive TRFIA[59]
TRFIA是超微量分析领域中的一项新兴技术,它将酶标记技术、放射性标记技术以及同位素标记技术的优点相结合[61],具有分析速度快、灵敏度高、稳定性好、特异性强等优点,发展潜力巨大。但TRFIA所使用的同位素的半衰期及其产生的放射性会对人体造成伤害并可能导致环境污染。此外,大多数螯合剂为有毒物质,对测试人员的身体健康有潜在威胁,且螯合剂的荧光寿命较短,产生的背景信号也容易受到干扰。
2.2.3 胶体金免疫层析法 胶体金免疫层析技术(immune colloidal gold technique,GICT)是20世纪90年代兴起的一种免疫分析技术,其以胶体金作为示踪标记物,硝酸纤维膜充当固相载体,基于抗原和抗体间的特异性结合反应,利用毛细管作用使得含有待测物的液体从膜条一端向另一端缓慢渗移,其间待测物与金标试剂发生一系列特异性结合反应而被截留,聚集于检测带上并显现出肉眼可见的红色条带,通过观察可实现对待测物的定性或半定量分析。陈宗伦[62]基于GICT开发了一款用于检测谷物中AFB1的检测卡。检测卡对谷物中AFB1的肉眼判断灵敏度为0.2 ng·mL−1,仪器判断灵敏度为0.05 ng·mL−1,检测可在15 min内完成,且检测卡在25℃常温条件下可保存1~2年。曹德康等[63]应用GICT制得一种可同时对谷物类食品中AFB1、玉米赤霉烯酮和呕吐毒素进行检测的三联检测卡。检测卡对3种毒素的LOD分别为5~10、60、1 000 ng·g−1,且该检测卡特异性良好,与待检物的结构类似物、其他真菌毒素均无交叉反应,15 min内可完成测试,于常温下可保存12个月。
GICT以其独有的优势越来越受到检测人员的青睐,它具有快速、灵敏、操作简便等优点,适用于在田间地头、仓库、农贸市场、商场等场所对原料或成品进行大批量筛查检测。但GICT在制备抗体时成本较高,样品提取时效率较低,检测结果重复性差且易出现假阳性结果,这些不足制约了GICT的推广应用,需进一步优化。
2.3 其他检测方法
2.3.1 表面增强拉曼光谱法 拉曼光谱是基于印度科学家拉曼在1928年所发现的拉曼散射效应发展起来的光谱分析技术,在分析样品时具有对试样非接触性、不破坏试样的特点[64],同时也拥有较高的灵敏度和准确性,可在短时间内完成对试样的分析,但传统拉曼光谱的强度和灵敏度较低。表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)克服了传统拉曼光谱的低灵敏度缺点,它利用纳米结构表面现象来增强吸附在银、金和铜等金属颗粒上的弱非弹性散射拉曼效应,且保持了常规拉曼光谱实时与快速的特性,已广泛应用于食品安全[65]、生物医药[66]、环境监测[67]等诸多领域。He等[68]基于SRES开发了一种可用于检测花生制品中AFB1的免疫传感器。传感器以SH-cDNA(short hairpin-cDNA)修饰的Fe3O4@Au粒子作为捕获探针,以SH-Apt(short hairpin-适配体)修饰的Au@Ag粒子和Cy3-Apt(Cy3荧光标记的适配体)为报告探针,在AFB1存在的条件下,Apt与AFB1的特异性结合可以使报告探针从捕获探针中释放出来,导致SERS强度随AFB1浓度的增加而线性下降,从而实现对AFB1的痕量检测(图4)。该方法对AFB1的LOD为0.40 pg·mL−1,回收率为96.6%~115.0%。在纳米溶胶由湿态向干态转化的过程中进行实时SERS采集的技术称为动态SERS(dynamic SERS,DSERS),与常规SERS信号相比增加了2~3个数量级。基于此,任菲等[69]采用D-SERS对薏苡仁中的AFG1进行检测。该方法采用擦拭法提取样品表面的AFG1,以AuNP作为SERS的增强基底进行D-SERS分析,对AFG1的LOD为5.5 µg·kg−1,具有低成本、快速、简便的特点,适用于大批量样品的快速筛检。
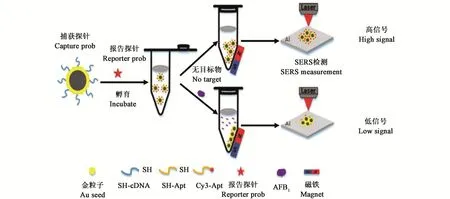
图4 基于SERS免疫传感器检测原理[68]Fig.4 Detection principle based on SERS immunosensor[68]
近年来,SERS技术凭借其荧光背景低、图谱信息量丰富、简便灵敏、快速无损等优点被广泛应用于食品安全检测领域。但目前SERS多作为一种辅助性检测手段使用,仍有一些问题亟待解决:①仪器成本较高,难以商业化推广;②制备重现性好、灵敏度高的基底较为困难,且性能可观的基底材料多为贵金属,如Au(金)、Ag(银)等与其他材料的复合物,进一步增加了检测成本;③自然界中真菌毒素的种类繁多且结构复杂,目前还尚未建立起针对各种真菌毒素的SERS拉曼谱图库导致许多毒素无法检测。
2.3.2 电化学传感器法 电化学传感器是一种利用电化学分析对样品进行定量检测的装置。其工作原理为:对目标物具有特异性识别的原件被修饰于电极上,通过与目标物相互作用对目标物进行识别而引起信号的改变,信号转换器再将这种信号变化转换成电化学信号。在一定范围内,目标物的浓度与电化学信号之间存在一定的比例关系,可实现对目标物的定量分析。Yuan等[70]研制了一种灵敏度高、可选择性地对AFB1进行检测的电化学传感器。其首先将AFB1适配体(aptamer,Apt)的巯基化cDNA通过硫−金键固定在AuNPs修饰的玻碳电极(glassy carbon electrode,GCE)表面,再通过特定的碱基配对方式让Apt与cDNA互补配对而附着于GCE表面;在AFB1存在的情况下,通过AFB1和Apt之间的特异性识别,Apt从电极表面分离,在溶液中形成Apt-AFB1偶联物;偶联物在外切酶Ⅰ(ExoⅠ)的作用下以触发AFB1循环;最后,DNA-AuNPs-HRP纳米探针通过特异性碱基配对与电极表面的cDNA结合,HRP可以催化H2O2将对苯二酚(hydroquinone,HQ)氧化为苯醌(benzoquinone,BQ),产生强烈的电化学信号(图5),信号随AFB1浓度的增加而增大,最低LOD为3.3×10−4ng·mL−1,回收率为88.5%~110.2%,已成功应用于花生和玉米样品中 AFB1的测定。Wang等[71]制备了一种无试剂适配体电化学传感器,可用于快速、灵敏检测多种食品中的AFB1。在对AFB1具有较高亲和力的短链26-mer DNA适配体5’端引入一个硫醇基团,并在其T18位点偶联一个亚甲基蓝(methylene blue,MB)标记,通过硫−金键合将适配体固定在金电极上。对于T18位点有MB标记的适配体,AFB1的结合引起MB电流信号显著增加,从而可以根据电信号的变化检测AFB1。传感器的检测极限为 6 pmol·L−1,且具有较好的稳定性,经去离子水漂洗再生后可重复使用。

图5 基于DNA-AuNPs-HRP纳米探针和ExoⅠ辅助信号放大的电化学适配体传感器检测原理[70]Fig.5 Detection principle of electrochemical aptamer sensor based on DNA-AuNPs-HRP nanoprobe and ExoⅠ auxiliary signal amplification[70]
近年来,电化学传感器因其具有较高的检测灵敏度、操作简便、便于携带且较为经济的特点而被广泛用于食品中污染物的检测。其中核酸适配体和电极修饰材料的开发是电化学传感器制备的关键,直接影响着传感器的检测性能和使用寿命。因此,探索性能优越的新型电极修饰材料,筛选、修饰亲和力更强、成本更低的核酸适配体将成为未来构建性能稳定的电化学传感器的研究重点[72]。
3 结语
AFT对食品的污染严重危害着消费者的身体健康,食品中AFT检测技术的发展日益受到人们的关注,高效检测各类食品中AFT的残留对我国食品行业的可持续发展和更好践行“健康中国”战略、保障我国食品安全事业行稳致远至关重要。
就目前来看,随着科学技术的进步,各种检测技术在灵敏度、准确度、稳定性等方面都取得了实质性的进步,但对于大批量样品的快速检测仍然没有方法可以同时满足灵敏、准确、稳定、快速、简便、低成本的要求,已然成为本领域所面临的一项难题。仪器分析技术虽然在检测结果的准确性上有着绝对的优势,但由于其本身的局限性,分析测试只能在实验室中由专业人员执行,样品在测试前需要经历较为繁琐的前处理过程,测试后也不能立即获取检测结果,且有着较高的测试成本,不适合大批量样品的快速筛查。免疫技术的兴起在一定程度上弥补了仪器分析技术的不足,它具有灵敏度高、特异性强、简便、快速、低成本等优点,各种免疫试剂盒、试纸条的出现使得大批量样品的现场筛查成为可能。更重要的是,它对操作人员的知识储备要求不高,经过一定的培训即可快速上手。但目前免疫技术在测试结果的准确性上与仪器分析技术仍有差距,假阳性、假阴性结果不能完全避免,且抗原抗体不易制备,还有待继续探索并不断完善。SERS、电化学传感器技术是当前真菌毒素检测领域研究的热点。SERS具有定量精确、快速无损的特点,电化学传感器则以其低成本和便携性备受青睐,但作为新兴检测技术还尚未发展成熟。未来,AFT的检测将更倾向于从实验室走向现场,从仪器分析走向快速分析,研发集提取、分离、富集、检测于一体的检测设备用于AFT的现场大批量、快速、精准定量将成为AFT检测技术的发展趋势。

