生物钟在卵巢生理和病理中的作用
黄 亮, 褚瑰燕, 杨公社*
(1)陕西省动物遗传育种与繁殖重点实验室,陕西, 杨凌 712100;2)西北农林科技大学动物科技学院动物脂肪沉积与肌肉发育实验室,陕西, 杨凌 712100)
昼夜节律是一种循环的内源性生物模式,以大约24 h为周期,调节机体生理、新陈代谢和行为[1]。几乎所有的生命体都通过生物钟机制来预测地球自转所引起的每日变化。昼夜节律是一种普遍的生命现象,在维持动植物的多种生理功能和调节动植物对内外环境的适应性方面发挥重要作用[2]。昼夜节律性是哺乳动物新陈代谢的主要特征,它使新陈代谢过程与昼夜光照周期同步[3]。昼夜节律的产生、维持和调节依赖于生物钟的输入系统和输出系统在整体水平和细胞水平上的协同作用,也依赖于内源性生物钟基因网络的精确调节。随着人类对生物钟研究的日益深入,从最初的植物到哺乳动物最后到人,生物钟机制研究得到较大的发展并取得了一些重大成就。在哺乳动物中,昼夜节律由视交叉上核(suprachiasmatic nucleus,SCN)的中央时钟驱动[4],并通过视网膜下丘脑束被光重置[5]。SCN通过内分泌、自主和行为线索影响外周组织时钟,例如与代谢、内分泌和生殖功能有关的生物钟[6]。激素水平、药代动力学和疾病方面的时间变化(例如,清晨心血管病发作的发生率增加,以及哮喘症状的夜间加重),显示了昼夜节律对人类生理和病理生理学的显著影响[7]。雌性生殖系统的节律性生理变化依赖于多个神经内分泌和内分泌组织的协调和同步活动。卵巢的每种细胞类型,包括卵泡膜细胞、颗粒细胞和卵母细胞,都有一个与卵泡生长、类固醇激素合成和排卵过程有关的生物钟。卵巢的生殖周期受昼夜节律的影响,扰乱周期或阻碍卵泡生长的疾病会破坏卵巢生物钟基因表达的节律[8]。生物钟在卵巢卵泡的募集、生长、排卵等生殖过程中发挥重要作用。生物钟紊乱不仅会导致排卵障碍和不孕,也与卵巢的衰老有紧密联系。目前,卵巢生物钟的分子机制尚未完全阐明。本文就近些年卵巢的生物钟研究进展予以综述,并对今后的研究作出展望。
1 生物钟概述
在哺乳动物中,生物钟由中央时钟和外周时钟两部分组成,两者协调产生生理和行为上的每日节律。中央时钟位于下丘脑前部的视交叉上核[9],视交叉上核由多个单细胞昼夜节律振荡器组成,当它们同步时,会产生协调的昼夜节律输出[7]。外周时钟存在于外周器官和组织中(肝、胰腺、卵巢、肺等),是一种具有自主性的时钟[10]。视交叉上核通过视网膜下丘脑束接受体外信号(光),通过神经和体液机制调节身体几乎所有组织与外周时钟的相位同步[11]。在某些情况下,外周时钟可以独立于中央时钟发挥作用。然而,与视交叉上核中时钟基因节律性表达的相位相比,外周时钟基因节律性表达的相位相反或相位延迟[12]。
2 生物钟的分子机制
哺乳动物昼夜节律受一些生物钟基因的调控,包括脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(brain and muscle Arnt-like protein-1,Bmal1)、昼夜节律运动输出周期故障(circadian locomotor output cycles kaput,Clock)、周期1/2/3 (period1/2/3,Per1/2/3)、隐花色素1/2 (cryptochrome1/2,Cry1/2)、核受体亚家族1D组成员1/2 (nuclear receptor subfamily 1 group D members 1/2,Rev-Erbα/β;Nr1d1/2)、维甲酸相关的孤核受体α/β/γ(retinoic acid-related orphan nuclear receptors α/β/γ,RORα/β/γ)、D-box结合蛋白(D-box binding protein,Dbp)、分化胚胎软骨细胞基因1/2 (differentiated embryonic chondrocyte gene1/2,Dec1/2)、促甲状腺细胞胚胎因子(thyrotroph embryonic factor,Tef)、肝白血病因子(hepatic leukemia factor,Hlf)、神经元PAS结构域蛋白2 (neuronal PAS domain protein 2,Npas2)、酪蛋白激酶1e (casein kinase 1 epsilon,Ck1e)等,这些基因共同组成连锁的转录-翻译反馈环路(transcription-translation feedback loop, TTLs)[13]。生物钟系统由一组核心的转录因子组成,它们共同在TTLs中发挥作用(Fig.1)。BMAL1和CLOCK是转录-翻译反馈环路的两个主要转录因子,分别由Bmal1和Clock基因编码,二者都具有碱性螺旋环-螺旋/PAS结构域(basic helix-loop-helix-PER-ARNT-SIM,bHLH/PAS)。在细胞质内,BMAL1和CLOCK蛋白质结合形成异二聚体转录复合物,作为主要的正向调节因子,然后进入细胞核,通过与启动子中的E-box元件结合来激活靶基因的表达[14],这些靶基因包括Bmal1、Clock、Per1/2/3和Cry1/2等[15]。细胞质内PER和CRY蛋白质形成异二聚体转录复合物,延迟后进入细胞核,直接与CLOCK/BMAL1复合物结合,并抑制其活性[16],从而抑制Per和cry基因以及其它生物钟基因的转录激活[17,18],最终形成核心的负反馈环路。当PER和CRY下降到低水平时,BMAL1/CLOCK又可以启动新一轮的基因反式激活周期。在大多数情况下,BMAL1和CLOCK是钟控基因的反式激活所必需的,但BMAL1也可以独立地调节某些基因的表达,例如II型碘甲状腺原氨酸去碘酶(type II iodothyronine deiodinase,Dio2)[19]。除了核心的负反馈环路外,还存在其他的反馈环路,例如BMAL1/CLOCK复合物能促进Rev-Erbα/β核受体的转录,当REV-ERBα/β积累到临界值时,又能反向抑制Bmal1的转录[20]。REV-ERBα与其基因启动子中的应答元件RRE(或RORE, retinoic acid related orphan receptor response element)结合,通过募集辅阻遏物核受体辅加压素1 (nuclear receptor corepressor 1,NCoR1)和组蛋白脱乙酰酶3 (histone deacetylase 3,HDAC3)抑制基因的转录[21]。此外,RORα以单体形式与应答元件(ROREs)结合来调节基因转录。结合ROREs的能力与其他几种核受体共享,例如REV-ERBα和REV-ERBβ[22],通过在BMAL1启动子中竞争性结合ROREs,这些受体可以对抗彼此对转录的影响[23],从而控制其转录水平。同时,RORα和REV-ERBα转录水平又受BMAL1/CLOCK复合物调节。RORs和REV-ERBs对RORE介导的基因转录的正负调控,在BMAL1表达的控制中发挥作用,并且可能是若干其他调节反馈回路的一部分[24,25]。
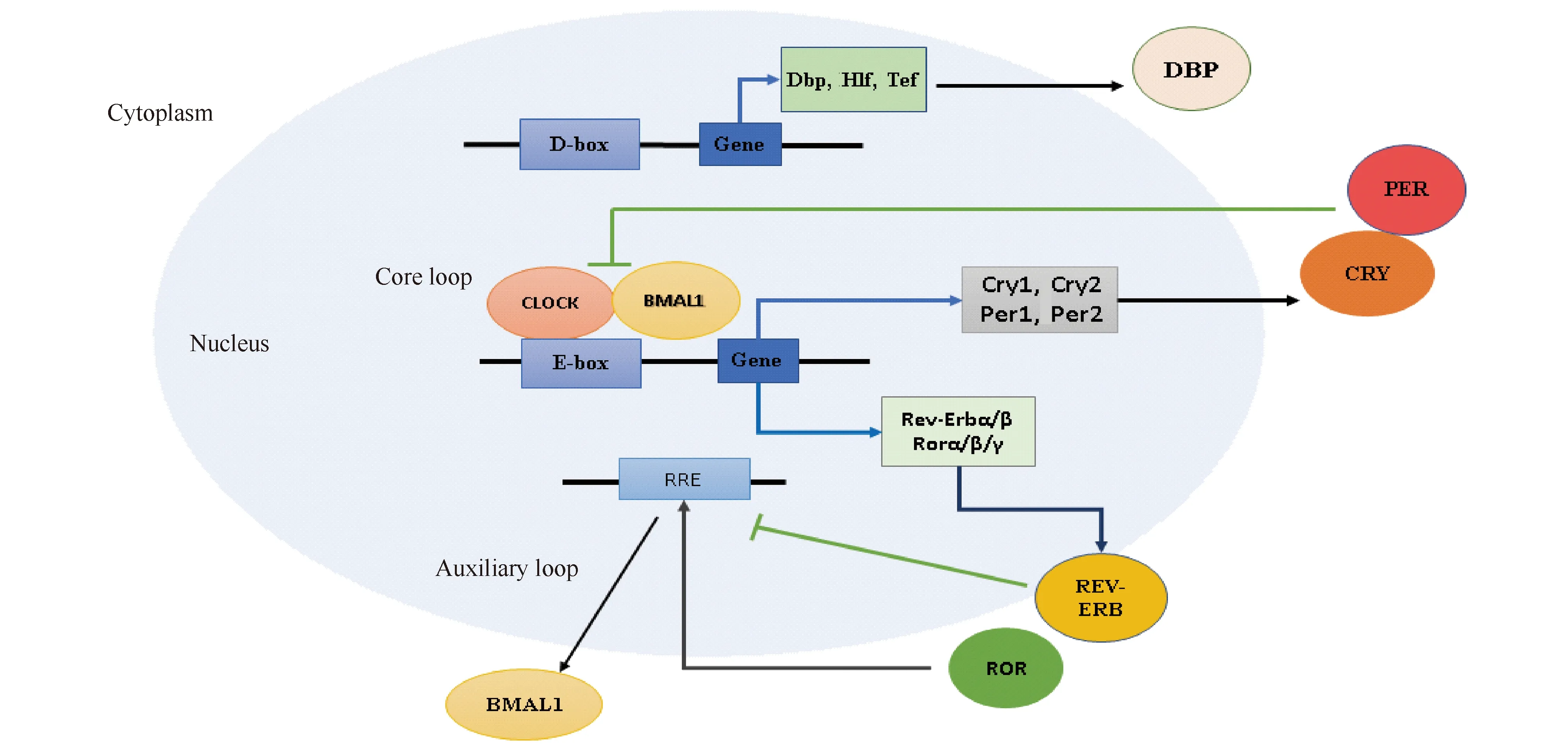
Fig.1 The circadian clock in mammals is formed by interlocking transcription-translation feedback loops In the core loop, the transcription factor CLOCK-BMAL1 dimers induce the expression of their own negative regulators including PER and CRY. By inhibiting the transcriptional activity of CLOCK-BMAL1, PER and CRY repress their own expression. Once PER and CRY levels have sufficiently dropped, a new cycle of transcription by CLOCK-BMAL1 can begin. The CLOCK and BMAL1 dimer also induced the expression of REV-ERBs, and the expression of RORs controlled by Ror gene which containing the D-box element. In the Auxiliary loop, REV-ERB and ROR regulate the expression of Bmal1 by competitively combining RRE components in Bmal1. RRE, REV-ERBα response element. DBP, D-box binding protein
3 生物钟在卵巢生理中的作用
雌性哺乳动物的生殖系统表现出精确的昼夜节律。自卵巢生物钟发现以来,生殖系统生物钟迅速成为新的研究热点。卵巢生物钟是一种外周时钟,接受中央时钟SCN的神经内分泌信号调节。视交叉上核能产生血管活性肠肽(vasoactive intestinal peptide,VIP)和精氨酸加压素(arginine vasopressin,AVP)。VIP直接刺激促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)神经元活动,精氨酸加压素信号对于GnRH神经元网络的视交叉上核调节至关重要,精氨酸加压素受BMAL1/CLOCK复合物的调节, 并以雌激素依赖的方式刺激Kisspeptin神经元[26]。Kisspeptin神经元在生殖中的主要作用是刺激GnRH神经元,将GnRH释放到垂体-门脉系统中,促性腺激素释放激素的释放对排卵前黄体生成素(luteinizing hormone,LH)的激增是必要的。GnRH促进垂体释放促卵泡激素(follicular stimulating hormone,FSH)和黄体生成素,垂体释放促卵泡激素和LH进入血液,随后作用于卵巢, 以促进配子发生和性类固醇生成[27]。性类固醇激素又反馈到垂体和下丘脑,从而调节不同激素的释放模式。下丘脑-垂体-卵巢(hypothalamic-pituitary-ovarian,HPO)轴上各种生物钟相互协调和同步以促进正常生殖行为。目前的研究表明,卵巢细胞中的生物钟在卵巢生理过程中发挥重要作用,例如参与卵泡的发育和成熟,排卵以及类固醇的合成与释放等。
3.1 生物钟参与卵泡发育
卵泡中存在生物钟基因的表达,包括卵泡膜细胞、颗粒细胞和卵母细胞[28]。许多研究表明,生物钟和卵泡发育之间有重要联系。卵巢中生物钟基因表达的时机受卵泡发育阶段的影响。在卵泡发育过程中,生物钟基因表达的节律在原始卵泡和腔前卵泡中不存在,但卵泡发育到早期窦状卵泡时就会出现,并在接近晚期的窦状卵泡或排卵前卵泡时会变得更加稳定[29]。研究发现,处于发育阶段的卵泡在白天表现出较高的BMAL1和CLOCK的蛋白质水平,而在晚上,CRY1、CRY2、PER1和PER2的蛋白质水平则上调[30]。卵泡的正常发育离不开颗粒细胞的支持作用,颗粒细胞分泌的营养物质和细胞因子,会通过间隙连接供给卵母细胞以满足其生长需要。因此,颗粒细胞发育受阻或功能障碍会直接影响卵泡的发育。此外,在大鼠卵巢中存在生物钟基因dec1(sharp2)的表达,该基因是细胞节律性辅助反馈环路中的1种,并被卵泡膜细胞和颗粒细胞中的马绒毛膜促性腺激素(equine chorionic gonadotropin, eCG)和人绒毛膜促性腺激素(human chorionic gonadotropin, hCG)暂时诱导[31]。在卵巢中,DEC1是细胞核中的转录阻遏物,并以促性腺激素依赖性方式直接或间接改变卵巢中基因的表达,例如FSH受体、环氧合酶2(cyclooxygenase 2, COX2)和其他E-box依赖性基因。这些结果表明,dec1参与卵泡发育与排卵过程[32]。
3.2 调控排卵反应
在哺乳动物中,垂体释放促卵泡激素和LH的水平表现为昼夜节律的振荡。垂体释放促卵泡激素促进卵泡生长和性类固醇的产生,而LH在雌二醇的循环水平高到足以促进卵泡成熟时触发成熟卵泡的排卵。排卵前,卵泡细胞上存在大量垂体释放促卵泡激素和LH受体,垂体释放促卵泡激素与LH中的1种或2种激素调节排卵前卵泡细胞中生物钟基因的表达[28,33, 34]。排卵前LH激增发生在雌性小鼠发情前期的夜晚,其时间是由生物钟系统决定[35]。研究发现,当雌性小鼠长期暴露于破坏的明暗循环环境,会明显损害排卵前LH激增的发生,导致排卵故障,这严重损害生殖活动从而导致生殖能力降低[36]。Karman和Tischkau[37]检测了12 L:12 D条件下大鼠卵巢中生物钟基因的表达,发现Bmal1和Per2转录物和蛋白质产物的节律性表达模式相对于SCN是异相的,并且彼此完全反相。在LH激增后的第1 d,Bmal1的表达显著升高,该研究确定,LH是卵巢昼夜节律基因节律的潜在调节剂。Sellix等[38]通过阻断内源性促性腺激素分泌,并评估定时外源性LH治疗对排卵的影响,以此作为阶段性卵巢敏感性的衡量标准。研究结果证明了卵巢对LH敏感性的昼夜节律,它决定了促性腺激素参与的排卵反应。Kobayashi等[39]用hCG激素处理小鼠卵巢,Bmal1基因在hCG给药后4~16 h的表达显著高于对照组小鼠,表明健康的排卵需要诱导Bmal1表达以促进LH激增。他们的数据还表明,BMAL1可能参与卵巢细胞的黄体化,因为BMAL1的表达在hCG给药16 h后达到最大值,此时卵泡发生黄体化。此外,敲除生物钟基因Clock会严重影响小鼠的生殖能力,导致卵母细胞释放减少和产仔数减少,表明Clock在卵泡发育与排卵过程的重要作用[40]。卵泡膜细胞中的生物钟调节钟控基因(例如LHR)表达的时间,并通过保持卵巢对促性腺激素的稳定节律而在排卵中发挥重要作用[41]。
3.3 调节类固醇激素的生成
卵巢中的生物钟在调节类固醇的生物合成中发挥重要作用。卵巢类固醇激素合成的第一步是在类固醇合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)的作用下,将胆固醇从卵泡内膜细胞线粒体外膜转移至内膜。在线粒体内膜,胆固醇在细胞色素P450胆固醇侧链切割酶(cytochrome P450 cholesterol side-chain cleavage enzyme,CYP11A1)的作用下转化为孕烯醇酮,随后在3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)催化下形成孕酮(progesterone,P4)。类固醇 17α羟化酶(steroid 17 alpha-hydroxylase,CYP17A1)催化P4转变为雄烯二酮,雄烯二酮进入颗粒细胞,并最终在芳香化酶(aromatase cytochrome P450 19A1,CYP19A1)的作用下形成雌二醇。类固醇生成基因,例如StAR、CYP11A1、3β-HSD和CYP19A1都是钟控基因。在成熟的颗粒细胞中这些基因表达的节律性受生物钟的严重影响。有研究用hCG处理体外培养的人黄体化颗粒细胞,研究表明,PER2基因在处理后显示出周期式的震荡模式。有趣的是,STAR基因的表达也显示出与PER2类似的震荡模式,这可能与卵巢中的类固醇生成有关[42]。Ratajczak等[43]和Boden等[44]的研究证明,BMAL1在类固醇生成细胞内和在STAR酶产生孕酮中发挥作用。此外,卵巢类固醇生成细胞特异性Bmal1基因敲除小鼠模型显示,Bmal1的缺失破坏了生物钟机制相关转录物以及Star基因的表达,Star基因表达受损会降低孕酮水平并造成着床失败[45]。卵巢细胞内的生物钟机制对雌激素的调节是生殖能力的一个关键方面。Wang等[46]通过抑制猪卵巢颗粒细胞Bmal1基因的表达,发现干扰Bmal1能显著下调Clock、Per1和Per2的表达,并且激素合成基因Star、Cyp11a1和Cyp19a1的表达也下调,这些基因的启动子区域都含有生物钟控制元件(E-box或RORE),表明生物钟系统可能是通过调控相关基因启动子上的生物钟调控元件发挥作用,最终导致颗粒细胞分泌的雌激素和孕酮减少。综上可知,卵巢类固醇生成受生物钟系统的调控,生物钟基因的缺失或抑制会影响类固醇的生成。
4 生物钟在卵巢衰老中的作用
过早衰老会缩短畜牧生产和人类生殖年限。随着年龄的增长,雌性动物的生殖能力自然下降,卵巢衰老对雌性动物的生殖生理和生产性能具有较大的影响。卵巢衰老与雌性哺乳动物年龄相关的生殖能力下降的分子机制仍不清楚[47]。卵巢的衰老与细胞水平上的衰老和功能退化有关。卵巢衰老的主要特征是卵巢储备减少[48]、卵母细胞质量和数量的下降[49]、卵泡的不断丧失以及性激素分泌下降[50]。越来越多的证据表明,生物钟在卵巢衰老过程中发挥重要的调节作用。尽管生物钟基因如Per1、Per2、Cry1或Cry2的突变对年轻(2~6个月大)小鼠发情周期的影响很小,但是中年(约10个月大)突变小鼠的发情周期不规律的比例明显高于野生型同年龄小鼠,其特征是不规则或延长的发情周期[51, 52]。Per突变中年雌性小鼠与老年野生型小鼠的生育能力相近,这暗示生物钟基因的突变会加速中年突变小鼠卵巢的衰老,导致不规则发情周期的出现,进而造成小鼠的生殖缺陷[51]。研究表明,生物钟系统的损伤加剧了衰老对生殖节律的影响[53]。此外,Brzezinski等[54]从接受过体外受精治疗的年轻(18~33岁)和大龄(39~45岁)病人中分离出黄体化颗粒细胞,在hCG刺激后36 h,测量细胞中生物钟基因的表达水平。他们发现生物钟基因CLOCK、BMAL1、CRY1、CRY2、PER1、PER2在培养的年轻和大龄人黄体化颗粒细胞中都有表达。与年轻妇女相比,老年妇女颗粒细胞中生物钟基因的表达呈现总体的下降趋势,其中PER1和CLOCK基因显著下调,这种下调可能部分解释了老年妇女生殖能力下降。有研究发现,妇女血清抗缪勒氏激素(anti-mullerian hormone,AMH)水平和颗粒细胞昼夜节律基因的表达均随着年龄的增长而显著下调。除REV-ERBα外,CLOCK、BMAL1、CRY1、CRY2和PER1均与AMH水平呈正相关,这表明老年妇女卵巢储备下降,是由于衰老导致的卵巢昼夜节律下调造成的[55]。褪黑素是昼夜节律的标志物,是一种由松果体分泌的脂溶性激素,其水平随昼夜节律而变化。Liang等[56]在体外培养的衰老牛卵母细胞中补充外源的褪黑素,研究发现,褪黑素能显著降低衰老细胞中的活性氧(reactive oxygen species,ROS)和DNA损伤水平,从而改善衰老卵母细胞质量并提高其发育能力。综上可知,卵巢细胞生物钟基因的突变会加速卵巢的衰老,并且生物钟基因的表达水平随着年龄的增长而改变。卵巢衰老与生物钟密切相关,因此,可能影响卵巢的功能并导致卵巢储备减少和生殖能力下降。
5 卵巢病理中的生物钟
生物钟系统的破坏可能是导致生殖能力下降相关疾病的致病因素之一。卵巢细胞的生物钟中断或与其他部位的昼夜节律振荡器之间的不同步,也会导致各种生殖疾病的发生和发展。昼夜节律紊乱引起的代谢和生殖功能障碍的潜在机制,及其与卵巢疾病的关系尚不清楚。以下几种是公认的与生物钟相关的卵巢疾病。
5.1 多囊卵巢综合征
多囊卵巢综合征(polycystic ovarian syndrome, PCOS)是哺乳动物常见的内分泌和与代谢风险增加相关的生殖系统疾病,也是造成生殖力下降或不育的主要原因。多囊卵巢综合征的主要特征是排卵功能障碍[57]、高雄激素症[58]、多囊性卵巢形态[59]、月经不调[60]和胰岛素抵抗[61]。肥胖、血脂异常和Ⅱ型糖尿病也是多囊卵巢综合征的特征[62]。许多证据表明,多囊卵巢综合征与昼夜节律紊乱有关。Simon 等[63]研究患有PCOS与不患有PCOS的肥胖少女之间褪黑素昼夜节律的差异。与对照组相比,患有多囊卵巢综合征的肥胖女孩褪黑素分泌时间延迟并且延长,这表明多囊卵巢综合征病人昼夜节律失调与代谢失调有关。此外,有研究探讨褪黑素在多囊卵巢综合征发病机制中的潜在作用,研究发现,正常人早晨的褪黑素水平很低,而多囊卵巢综合征患者在早晨具有高褪黑素水平,这表明多囊卵巢综合征患者体内褪黑素的昼夜差异较小,这种现象可能是由于多囊卵巢综合征女性紊乱的昼夜节律所导致的[64]。把健康的6周龄大鼠暴露于持续8周的黑暗环境,经过黑暗处理的大鼠体内生物钟基因表达的改变与多囊卵巢综合征患者一致。在持续的黑暗条件下,Bmal1表达的下调通过葡萄糖转运蛋白4(glucose transporter 4,GLUT4)促进胰岛素抵抗,而Per1和Per2表达的下调则促进雄激素过剩。此外,褪黑素治疗可通过BMAL1、PER1和PER2减轻黑暗处理大鼠的高胰岛素症和高雄激素症[65]。同样,持续的光照处理会诱导大鼠的多囊卵巢综合征变化,大鼠血清抗缪勒氏激素(AMH)水平明显升高,并且在卵巢中观察到更多的闭锁性囊肿样卵泡[66]。另外,也有研究证明,多囊卵巢综合征患者卵巢颗粒细胞中BMAL1基因表达低于非PCOS患者[67]。
5.2 绝经提前和过早的卵巢功能不全
自然绝经年龄对妇女的健康和生殖能力有重要影响。轮班工作是导致绝经年龄提前的重要因素之一。夜班妇女经历的环境昼夜节律信号被打乱,可能通过性腺功能的慢性失调而使绝经年龄提前。研究表明,绝经前妇女如果超过轮流夜班工作的阈值,则可能会有中度加速绝经发作的风险,而这种现象在年轻女性中最为显著,这造成年轻女性更早的发生卵巢功能衰竭[68]。此外,卵巢功能衰竭也与卵巢功能不全(premature ovarian insufficiency, POI)密切相关。POI的主要特征是育龄妇女卵巢功能的丧失,许多基因和非遗传因素促成POI的发生。有人用Per1/Per2双突变的雌性小鼠作研究,基因突变对卵泡发育过程中血管生长未见明显影响,但是会使卵巢卵泡过早减少,造成卵巢储备下降和功能的过早丧失,进而导致女性生殖能力下降。研究发现,Per1/Per2双突变可能通过影响小鼠HPO轴的每个部位的生殖内分泌系统来促进POI的发生[69]。
5.3 卵巢癌
卵巢癌是女性生殖系统中常见的致命疾病,也是妇科恶性肿瘤致死的主要原因。研究发现,与正常组相比,昼夜节律紊乱卵巢癌患者肿瘤样品中PER1和PER2蛋白的表达显著降低[70]。此外,Per2基因可抑制卵巢癌细胞的生长和转移,晚期卵巢癌与Per2突变或缺失有关,这表明Per2与卵巢癌的发展密切相关[71]。Zhao等[72]研究褪黑素的循环水平与卵巢癌发病机制的关系,发现卵巢癌患者的血清褪黑素水平显著降低。昼夜节律不仅与卵巢癌的发生有关,还与化疗耐药性有关。Xu等[73]研究CLOCK基因在顺铂敏感的A2780和顺铂耐药的CP70细胞中的表达,并且研究顺铂处理对CLOCK敲除后顺铂耐药的CP70细胞增殖和凋亡的影响。与顺铂耐药的CP70细胞相比,顺铂敏感的A2780细胞的CLOCKmRNA和蛋白质水平的表达显著降低,这表明CLOCK基因表达与卵巢癌细胞的顺铂耐药性密切相关。顺铂处理能显著抑制CP70细胞的增殖,并在敲除CLOCK后诱导其凋亡。此外,ARNTL(BMAL1)在卵巢癌细胞系中显著下调,表观遗传治疗可以恢复ARNTL的表达。ARNTL的过表达抑制卵巢癌细胞的生长,并增强顺铂的化学敏感性,这暗示生物钟基因ARNTL可能是卵巢癌的潜在肿瘤抑制基因[74]。
6 问题与展望
从哺乳动物第1个生物钟基因Clock发现以来,哺乳动物的昼夜节律引起了很多人的关注,也陆续发表大量的研究性文章。现已知道,生物钟基因在哺乳动物生殖系统中发挥重要的调控作用,特别是在卵巢组织中。卵巢生物钟是一种外周时钟,其接受中央时钟调节而又具有独立的调节能力。卵巢生物钟调控卵泡的发育和成熟、排卵以及类固醇激素的生成。虽然开展了研究,但其调控这些生理过程的具体分子机制仍然未知。卵巢细胞中调节生物钟发生的机制是什么?生物钟又是如何调节卵巢对激素和神经信号的反应,特别是在每一种卵巢细胞类型的水平上?目前仍不得而知。解决这些问题对维持哺乳动物卵巢的正常机能和延长生殖寿命至关重要。
卵巢衰老是导致哺乳动物年龄相关的生殖能力下降和不孕症的主要原因。在畜牧生产中,卵巢衰老不仅会导致家畜卵母细胞质量和数量的下降,还会使家畜患与衰老相关的卵巢疾病,这会缩短家畜的使用年限并降低生产效益。现已知道,卵巢衰老与生物钟密切相关,卵巢细胞生物钟基因的表达水平随着年龄的增长而下调。目前,衰老在颗粒细胞和卵母细胞上的研究报道非常有限,研究内容也不深入。生物钟与卵巢衰老是什么调控关系?卵巢衰老又是如何影响生物钟基因的表达?其具体的分子机制有待进一步的探索。在未来,随着研究的深入和分子机制的阐明,以猪为模型动物研究人卵巢衰老更为适合,因为猪的生理状态更接近于人。另外,靶向生物钟基因的药物治疗可能在卵巢抗衰老方面发挥重要作用。
昼夜节律紊乱与卵巢疾病的发生和发展有关,包括多囊卵巢综合征、绝经期提前、过早的卵巢功能不全和卵巢癌。这些损害生殖能力的疾病对生物钟功能的影响或生物钟在这些病因中的作用尚未得到充分认识。当前,已有一些药物用于治疗轮班工作或其它环境因素引起的人或动物的卵巢疾病,例如顺铂和褪黑素。针对生物钟因子的小分子有很大的潜力来治疗昼夜节律紊乱及其相关共病。阐明生物钟在卵巢疾病中调控机制,可为开发新的诊断和治疗方法以及新型药物提供理论依据。

