运动、肠道菌群代谢物
——短链脂肪酸与骨骼肌代谢调控
徐 磊, 倪 震, 张 缨*
(1)北京体育大学运动人体科学学院, 北京 100084;2)北京体育大学中国运动与健康研究院, 北京 100084)
人类肠道是一个由细菌、古细菌、真核生物以及病毒所构成的复杂的微生物生态系统,其中多达数千种不同种类的细菌称为肠道菌群,其在摄取营养物质、合成维生素、调节炎症以及免疫应答等方面扮演着十分重要的角色[1]。它可受到遗传、环境压力、饮食、年龄和运动等因素的影响,并通过其代谢产物与机体的多组织器官产生广泛的应答效应。有研究证实,肠道菌群可调控骨骼肌生理功能。缺乏肠道菌群或外源性补充抗生素的小鼠,表现出骨骼肌重量、力量、线粒体功能和有氧运动能力降低[2, 3]。而外源性补充益生菌的小鼠则表现出骨骼肌质量、力量和慢肌纤维比例增加[4],以及外源性补充益生元的老年人呈现出握力的提升[5]。
1 肠道菌群代谢物短链脂肪酸概述
短链脂肪酸(short chain fatty acid,SCFA)是肠道菌群的重要代谢物之一,它作为信号分子可对宿主的一系列活动产生影响,也是调控骨骼肌生理功能的关键因子[6]。虽然肠道菌群的类型和功能存在差异,但这些菌群均能在肠腔中以不易消化的食物成分为底物,发酵产生代谢产物。而这些代谢产物通常是一些只能通过外源性途径少量获得的营养物质[7]。例如,盲肠和结肠中的肠道菌群以小肠不易消化吸收的富含β-糖苷键的膳食纤维为底物,经发酵最终产生以乙酸、丙酸、丁酸为主的短链脂肪酸[8]。肠腔内短链脂肪酸浓度约为100 mmol/L,乙酸、丙酸、丁酸三者所占比值约为60%、25%和15%。其中,短链脂肪酸约98%以阴离子形式存在,其余以未解离短链脂肪酸 (undissociated acid, HSCFA)的形式存在[9]。结肠上皮细胞可通过单纯扩散和转运蛋白质,分别将肠腔内的HSCFA和短链脂肪酸-吸收入血(Fig.1)。
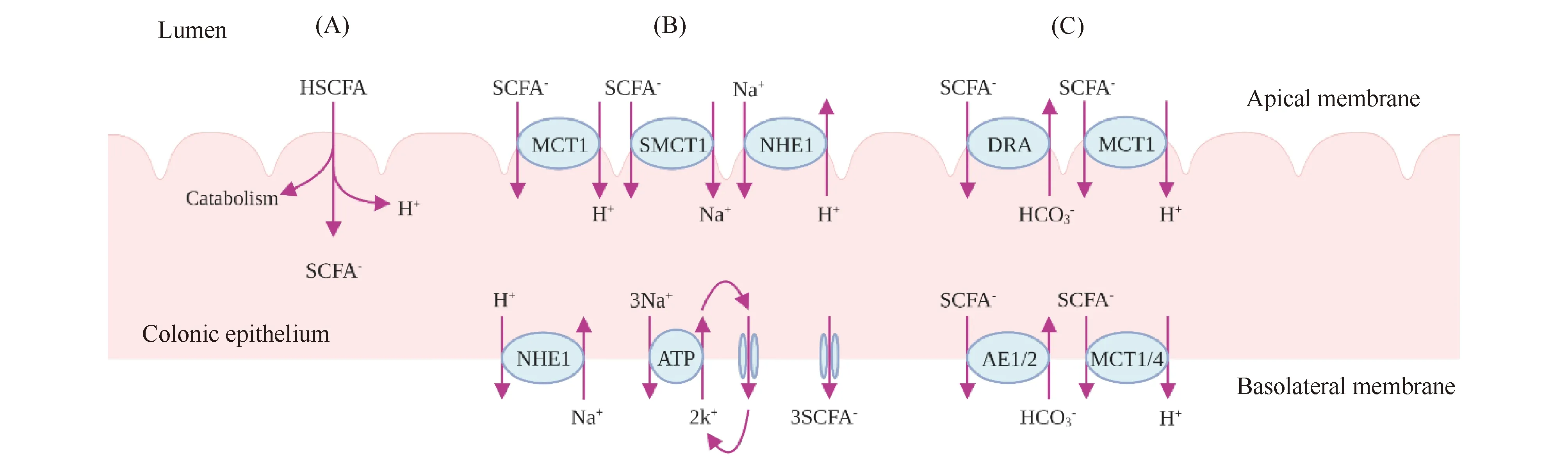
Fig.1 Transmembrane transport of SCFA from lumen to blood via the colonic epithelium (A) Apical membrane uptake of SCFA involves in diffusion of the undissociated acid (HSCFA). Among them, butyrate as the substrate of catabolism provides energy for colonic epithelium, and the rest of HSCFA is rapidly dissociated to the form of anion (SCFA-) and proton (H+). (B) MCT1 and SMCT1 expressed in apical membrane of colonic epithelium mediate SCFA- efflux from lumen to cytoplasm. All mechanisms lead to cytosolic acidification with stimulation of Na+/H+ exchange via NHE1 which expressed in apical and basolateral membrane. In basolateral membrane, 3Na+ leaves via the Na+/ K+-ATPase with recirculation of 2K+. Then, 3Na+ efflux drives the transport of 3SCFA- through volume-regulated anion channel to blood. (C) When cytosolic or luminal alkaline buffering is inadequate, AE1/2, DRA and MCT1/4 in basolateral and apical membrane mediate HCO3- influx from blood to cytoplasm or lumen, and SCFA- with H+ efflux from cytoplasm or lumen to blood
肠腔内的HSCFA经单纯扩散入胞质后,其中的丁酸可经氧化分解代谢为结肠上皮细胞提供能量。剩余的其他HSCFA迅速解离为短链脂肪酸-和H+(Fig.1A)。位于上皮细胞顶膜的单羧酸转运蛋白1(monocarboxylate transporter 1, MCT1)和钠离子偶联单羧酸转运蛋白1(sodium-coupled monocarboxylate transporter 1, SMCT1)可将肠腔内SCFA-、Na+、H+转运至细胞质。同时,为使胞质不被进一步酸化,顶膜和基底膜上的钠氢离子交换蛋白1(sodium/hydrogen exchanger 1, NHE1)将H+排出细胞质。而胞质中的3个Na+则由基底膜的钠钾泵泵出胞质,K+则通过基底膜的钾离子通道和钠钾泵在胞质和基底膜间进行循环。以保持胞质内的电荷平衡,胞质中的3个SCFA-也经基底膜的体积调节性阴离子通道(volume-regulated anion channel, VRAC)出胞质(Fig.1B)。HCO3-可通过基底膜阴离子交换蛋白1/2(anion exchanger 1/2, AE1/2)、MCT1/4和顶膜的腺瘤下调因子(downregulated in adenoma, DRA)、MCT1,分别被排入胞质内和肠腔,以补充碱性缓冲离子HCO3-的不足,同时H+和SCFA-被排出入血(Fig.1C)[9, 10]。
由盲肠、升结肠和横结肠内菌群产生的短链脂肪酸可进入肠系膜上静脉;而降结肠、乙状结肠内菌群产生的短链脂肪酸则进入肠系膜下静脉,它们可共同汇入门静脉至肝。短链脂肪酸中约30%~50%的丙酸在肝作为糖异生底物,约70%的乙酸在肝作为合成胆固醇和长链脂肪酸的底物[11, 12],剩余的短链脂肪酸以游离脂肪酸的形式经肝静脉进入外周循环。因此,肠道菌群来源的短链脂肪酸是肠道上皮细胞氧化分解和肝合成代谢的重要底物。另外,新近研究发现[8, 13],在各组织器官细胞膜表面存在能与短链脂肪酸特异性结合的受体,即G蛋白偶联受体(G-protein coupled receptor, GPCR),例如GPR43、GPR41和GPR109A等。肠道菌群来源的短链脂肪酸可作为信号分子调控宿主组织器官的生理活动[8, 13]。骨骼肌作为机体最大的组织器官,其细胞膜表面存在丰富的GPR43和GPR41[14, 15],且外源性补充肠道菌群来源的短链脂肪酸,可以部分逆转无菌小鼠骨骼肌质量与运动能力低下[2]。
2 运动对产生短链脂肪酸的肠道菌群的影响
运动是影响肠道菌群的一个独立因素[16],其对产生短链脂肪酸的肠道菌群组分的丰度和调控短链脂肪酸产生的相关基因表达有十分重要的影响。
2.1 急性运动
急性运动对产生短链脂肪酸的肠道菌群组分丰度有着显著的影响。运动员参加跨洋赛艇比赛后,大便菌群中Dorealongicatena, 人罗斯拜瑞氏菌(Roseburiahominis)和Subdoligranulum的丰度显著增加,其中R.hominis和Subdoligranulum能以膳食纤维为底物发酵产生丁酸[17]。此外,急性运动对调控短链脂肪酸产生的相关基因表达也有着显著的影响。对完成马拉松的职业运动员、训练后的精英马拉松运动员以及奥运会赛艇运动员的调查发现,他们大便中韦荣氏球菌属(Veillonella)的相对丰度均显著增加,且运动后菌群中参与调控乳酸转变为丙酸的甲基丙二酰通路上基因的相对含量更高[18]。
2.2 长期运动锻炼
长期运动锻炼同样影响着产生短链脂肪酸的肠道菌群组分的丰度,以及参与调控短链脂肪酸产生的相关基因表达。久坐超重女性在经过6周(3次/周、每次40~60 min、中低强度)的功率自行车训练后,其粪便中疣微菌门(Verrucomicrobia)、疣微菌科(Verrucomicrobiaceae)、艾克曼菌属(Akkermansia)和多尔氏菌属(Dorea)相对丰度增加,其中艾克曼菌属和多尔氏菌属能以膳食纤维为底物发酵产生丁酸[19]。中年胰岛素抵抗病人在分别经过2周间歇冲刺训练(3次/周、每次4~6组、每组30 s全力功率自行车、组间休息4 min)和中等强度耐力训练(3次/周、每次40~60 min、60%最大摄氧量强度的功率自行车)后,间歇冲刺训练组粪便中的毛螺菌属(Lachnospira)相对丰度增加,而中等强度耐力训练组粪便中的韦荣氏球菌属和栖粪杆菌属(Faecalibacterium)相对丰度增加,其中韦荣氏球菌属能通过甲基丙二酰通路将乳酸转变为丙酸[20]。未服药的超重糖尿病前期男性病人经过12周(3次/周、每次70 min)有氧联合抗阻训练后,研究人员分析了稳态模型评估的胰岛素抵抗指数(homeostatic model assessment of insulin resistance, HOMA-IR)显著降低的病人的粪便,发现运动不仅使这些病人粪便中的乙酸、丙酸、丁酸以及总短链脂肪酸含量增加,且能增加以膳食纤维为底物发酵产生丁酸的Lanchospiraceaebacterium的相对丰度,以及参与调控经发酵产生丙酸的基因(K01754、K13992、K00245)的相对含量[21]。此外,久坐人群按照BMI分为Lean和Obesity组,两组均经过6周(3次/周、每次30~60 min、运动强度为60%~70%的静息心率、功率自行车或者跑步机)有氧耐力训练,其粪便中的乙酸、丙酸和丁酸含量增加,且能增加以膳食纤维为底物发酵产生丁酸的罗氏菌属(Roseburia)、毛螺菌属(Lachnospira)、梭菌属(Clostridium)、栖粪杆菌属(Faecalibacterium)、fLachnospiraceae的丰度和参与调控经发酵产生丙酸和丁酸的甲基丙二酰辅酶A脱羧酶(methylmalonyl-CoA decarboxylase, mmdA),以及丁酰COA:乙酸COA转移酶基因(butyryl-CoA : acetate CoA-transferase, BcoAT)的相对含量[22]。
持续的运动锻炼刺激,对保持产生短链脂肪酸的肠道菌群丰度和调控产生短链脂肪酸的相关基因表达水平有重要作用。若经6周有氧耐力训练后的受试者,重新回归久坐生活6周后,其大便中丙酸和丁酸含量、产生丁酸的菌群丰度、mmdA和BCoAT基因的相对含量均又回到基线水平[22]。然而,参加完跨洋赛艇比赛的运动员继续3个月训练后,大便中能以膳食纤维为底物发酵产生丁酸的菌群丰度依旧保持在高于基线水平[17],表明这与赛后运动员持续的运动锻炼密切相关。
3 运动介导肠道菌群代谢物短链脂肪酸对骨骼肌代谢调控机制
3.1 SCFA对骨骼肌糖原合成的调控
大量体内外研究表明,短链脂肪酸能增加骨骼肌糖原含量[23-25]。已有研究报道,短链脂肪酸可通过与结肠的内分泌细胞(L细胞)膜表面的GPR43和GPR41结合,促使L细胞释放胰高血糖素样肽1(glucagon-like peptide 1, GLP-1)[26]。研究已发现,静脉注射或直肠注射短链脂肪酸——乙酸使胰岛素抵抗病人血浆GLP-1含量显著性地高于生理盐水组[27],而其并不能使GPR43或GPR41基因敲除鼠结肠细胞的GLP-1分泌增加[28]。进而,GLP-1可与胰岛的B、D细胞膜上GLP-1受体(glucagon-like peptide 1 receptor, GLP-1R)结合,分别促进胰岛素与生长抑素分泌。而生长抑素则可与胰岛A细胞膜上生长抑素受体2(somatostatin receptor 2, SSTR2)结合,反馈性地抑制胰高血糖素合成分泌[29]。进一步研究发现,给特异性敲除胰岛B细胞GLP-1受体的小鼠静脉注射GLP-1,该鼠则无法分泌胰岛素[30]。
短链脂肪酸还能直接增强骨骼肌的胰岛素敏感性。组蛋白乙酰转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase, HDAC)分别具有对组蛋白乙酰化和去乙酰化作用,从而使组蛋白与DNA的结合处于松散或紧密状态,以此可调控基因的转录[31]。研究发现,短链脂肪酸可激活HAT或抑制HDAC以调控基因转录[8]。在无胰岛素刺激下,丁酸能在分化的棕榈酸诱导的胰岛素抵抗的L6细胞中,增强胰岛素受体底物1(insulin receptor substrate 1, IRS1)基因转录起始位点附近的组蛋白H3乙酰化水平,并且显著增加IRS1 mRNA和蛋白质表达水平。但蛋白质激酶B(protein kinase B, PKB/AKT)磷酸化、葡萄糖转运体4(glucose transporter 4, GLUT4)和糖原合酶激酶3β(glycogen synthase kinase 3β, GSK3β)磷酸化水平未见变化;而在丁酸与胰岛素共孵育的情况下,p-IRS1、p-AKT、GLUT4和p-GSK3β的蛋白质水平均显著增加[32]。另外,给糖尿病大鼠注射乙酸(5.2 mg、5天/周、6个月)后,其骨骼肌GLUT4 mRNA和蛋白质,以及调控GLUT4转录的Krüppel样因子15(Krüppel-like factor 15, KLF15)表达水平显著高于对照组[33]。
由上可知,短链脂肪酸对骨骼肌糖原合成调控,可能是通过短链脂肪酸促进结肠L细胞分泌GLP-1,间接使胰岛B细胞合成分泌胰岛素增加,以及短链脂肪酸通过促进IRS1基因转录起始位点附近组蛋白乙酰化水平,增强其转录活性,提高骨骼肌的胰岛素敏感性,从而增加骨骼肌摄取葡萄糖和合成糖原。
3.2 SCFA对骨骼肌脂代谢的调控
大量体内外研究已经证明,短链脂肪酸可激活腺苷酸活化蛋白质激酶(AMP-activated protein kinase, AMPK)[34-37],AMPK激活可促进骨骼肌中的脂肪分解代谢和抑制合成代谢。首先,AMPK活化可促使骨骼肌胞膜上脂肪酸转位酶(fatty acid translocase, FAT/CD36)表达增加,进而促使脂肪酸转运至胞质[38]。经乙酸孵育(0.5 mmol/L、24 h或48 h)分化为肌管的L6细胞呈现脂肪酸摄取显著增加[35],且兔在注射乙酸(2 g/kg、4 d)后,其骨骼肌中CD36的mRNA水平显著高于对照组[39]。其次,AMPK活化后提高骨骼肌脂肪酶活性,促进肌肉细胞内的甘油三酯分解[40]。有文献报道,高脂饲养的C57BL/6J小鼠在灌胃丁酸(80 mg/d,10 d)后,其骨骼肌内的甘油三酯显著降低[36],以及标准饮食饲养的C57BL/6J小鼠在灌胃丁酸(5%W/W、10个月)后,其骨骼肌内的脂肪含量也显著降低[41]。兔在注射乙酸(2 g/kg、4 d)后,骨骼肌中负责水解甘油三酯的激素敏感性脂肪酶(hormone-sensitive triglyceride lipase, HSL)和脂蛋白脂肪酶(lipoprteinlipase, LPL)的mRNA水平显著高于对照组[39]。此外,AMPK激活后可磷酸化乙酰辅酶A羧化酶(Acetyl CoA carboxylase, ACC),抑制催化生成丙二酰辅酶A的ACC活性,从而一方面降低饱和脂肪酸的合成;另一方面消除其对肉碱棕榈酰转移酶1(carnitine palmitoyltransferase 1, CPT1)活性的抑制作用,进而增加脂肪酸转运至线粒体进行β-氧化[38, 40]。经乙酸干预(0.5 mmol/L、10 min)分化为肌管的L6细胞,其p-AMPK和p-ACC的蛋白质水平均高于对照组[35]。C57BL/6小鼠在灌胃乙酸(10 mL/kg、8周)后,骨骼肌中ACCmRNA水平显著低于对照组,而CPT1mRNA水平显著高于对照组[37]。
3.3 SCFA对骨骼肌线粒体生物发生调控
过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1, PGC-1α)是线粒体生物发生的重要调控因子,与能量代谢关系密切。AMPK激活可磷酸化转录共刺激因子--- PGC-1α,促使其入核激活核呼吸因子1/2(nuclear respiratory factor 1/2, NRF1/2)。进而,NRF1/2可与线粒体转录因子A(mitochondrial transcription factor A, TFAM)基因上的启动子结合,并促进其转录。TFAM调控线粒体DNA的复制、转录和翻译,影响线粒体的生物发生[42]。此外,活化的AMPK还能通过磷酸化转录因子EB(transcription factor EB, TFEB),促使其入核与PGC-1α基因的启动子结合,调节对PGC-1α转录活性,促进其表达[40, 43]。体内外研究已表明,短链脂肪酸能显著增加骨骼肌组织或肌细胞内p-AMPK、PGC-1α和TFAM的mRNA及蛋白质表达水平[34-37, 41]。
3.4 运动介导肠道菌群代谢产物SCFA对骨骼肌代谢调控机制
运动可使产生短链脂肪酸的肠道菌群组分的丰度提高,并参与调控短链脂肪酸生成的相关基因表达增加,实现肠道中短链脂肪酸含量的上调。短链脂肪酸促使结肠L细胞合成分泌的GLP-1到外周,进而GLP-1作用于胰岛B细胞增强胰岛素合成分泌,直接调节骨骼肌摄取葡萄糖与合成糖原。而外周的短链脂肪酸还会直接作用于骨骼肌,通过提高骨骼肌IRS1基因转录起始位点附近的组蛋白乙酰化水平,增强骨骼肌的胰岛素敏感性。同时,短链脂肪酸通过激活AMPK促进骨骼肌的脂肪酸摄取、脂肪分解代谢和线粒体生物发生,抑制脂肪合成代谢(Fig.2)。因此,运动可能通过介导短链脂肪酸调控骨骼肌代谢和提升其生理功能,进而增强机体的运动耐力。

Fig.2 The possible mechanism of exercise regulating skeletal muscle metabolism through gut microbial metabolite SCFA Exercise can increase the abundance of SCFA-producing gut microbiota and the expression of related genes involved in the regulation of SCFA production, so as to increase the content of SCFA in the gut lumen. SCFA promotes the synthesis and secretion of GLP-1 by colonic L cells , and then GLP-1 coming to the peripheral circulation acts on islet B cells to enhance insulin synthesis and secretion, directly regulating skeletal muscle glucose uptake and glycogen synthesis. After liver anabolism, the residual SCFA can directly act on skeletal muscle and enhance insulin sensitivity of skeletal muscle by increasing histone acetylation level on chromatin in proximity of the Irs1transcriptional start site. At the same time, SCFA can promote fatty acid uptake, lipolysis, lipid β-oxidation and mitochondrial biogenesis by activating AMPK, and inhibit lipid anabolism
4 问题和展望
本文全面综述了运动、肠道菌群代谢产物短链脂肪酸与骨骼肌代谢的最新研究进展。由此发现,短链脂肪酸是通过与胰岛、肝的联动效应影响骨骼肌代谢的重要调控因子。该综述以肠道菌群来源的短链脂肪酸为切入点,多视角地探讨了运动、肠道菌群来源的短链脂肪酸与骨骼肌代谢之间的关系,为阐明骨骼肌运动适应的新机制提供理论依据。
目前,对于运动、肠道菌群代谢物短链脂肪酸与骨骼肌代谢之间的研究仍存在诸多亟待解决的问题:(1)短链脂肪酸通过何种跨膜转运的方式进入肠系膜静脉?(2)进入外周的短链脂肪酸是否还与其他重要器官产生联动效应间接调控骨骼肌代谢?(3)进入外周的短链脂肪酸直接调控骨骼肌代谢的机制仍需完善。此外,目前研究对象主要集中于肠道菌群。那么,运动能否对肠道中的古细菌、真核生物以及病毒的组份和代谢产物产生影响?以及这些微生物的代谢产物能否到达外周来调控骨骼肌生理功能?到达外周的代谢物如何调控骨骼肌代谢?随着微生物组学技术的日渐成熟,以及悉生或无菌动物的广泛应用,我们相信对上述问题的探究将为运动、短链脂肪酸或其他肠道微生物代谢产物与骨骼肌代谢之间关系的研究提供新的视角,也将进一步促进运动生理、微生物学与代谢组学多学科的交叉融合研究。

