三元基序家族蛋白15敲低诱导肝癌细胞周期阻滞
刘珊珊, 刘连新
(中国科学技术大学,生命科学与医学部, 中国科学技术大学附属第一医院, 合肥 230001)
肝细胞癌(hepatocellular carcinoma,HCC)是全球癌症相关死亡的第4大原因,HCC的肿瘤发生是一个涉及多重危险因素的复杂过程[1]。慢性乙型肝炎病毒(hepatitis B virus, HBV)感染和黄曲霉毒素B1(aflatoxin B1,AFB1)是中国和印度等发展中地区主要危险因素[2,3],在发达地区,HCC主要是由丙型肝炎病毒(hepatitis C virus, HCV)[4]和非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)引起的肝硬化导致[5]。
有研究显示,细胞周期阻滞影响肿瘤的发生发展[6]。细胞周期机制的关键是周期蛋白依赖性蛋白质激酶(cyclin-dependent kinases,CDKs),当其被激活时,细胞能顺利从细胞周期的一个阶段移动到下一个阶段。CDKs受到细胞周期蛋白质的正向调节,并受到CDK抑制因子(cyclin-dependent kinase inhibitor, CKI)的负向调节[7]。G0/G1的周期蛋白质有细胞周期蛋白A(cyclin A)[8]、细胞周期蛋白D(cyclin D)、细胞周期蛋白E(cyclin E),CKI主要包括p21、p27和p57、p15、p16等[9]。CKI的激活会使CDKs失去活性,从而阻止Rb蛋白的磷酸化,E2F转录活性受到抑制,使细胞不能正常从G1期进入S期,细胞周期停滞[10]。细胞周期停滞实际上代表了一种生存机制,当细胞受到DNA损伤时,细胞会启动DNA损害修复调控体系,抑制细胞周期运转,为肿瘤细胞提供修复其自身受损DNA的机会[11]。
在诸多治疗肝癌的策略中,针对细胞周期的靶点治疗有sperm-associated antigen 5 (SPAG5)[12]、TRIM59[13]等。TRIM15(tripartite motif-containing protein 15)是三元基序家族蛋白质中的一员,这个家族的成员因具有RING锌指(RING-finger)结构域通常被定义为E3连接酶[14]。TRIM15在多篇文章中被报导与细胞迁移[15-17]和免疫相关[18],然而,本研究证明TRIM15同样调控细胞增殖和细胞周期,因此TRIM15有望成为肝癌的临床诊断和治疗的最新靶点。
1 材料与方法
1.1 细胞系
人肝癌细胞系HepG2、PLC、HCCLM3购自中国科学院上海细胞库,人胚肾细胞293T购自ATCC细胞库。
1.2 试剂
DMEM粉末、PBS粉末、胎牛血清、青霉素/链霉素购自Gibco公司;慢病毒包装试剂购自上海和元生物;逆转录酶和qRT-PCR相关试剂购自TAKARA。
1.3 抗体信息
1.4 细胞培养、慢病毒包装和病毒感染
细胞在5% CO2、37℃恒温条件下培养于含有1%链霉素/青霉素、1%丙酮酸钠和 10% 胎牛血清DMEM培养基中。
慢病毒包装:根据sh-gene:pSPAX2:pmd2.g=2∶2∶1,将混在opti-MEM中的慢病毒加入质粒中混匀静置20 min后加入293T细胞用于产病毒。
病毒感染:将病毒经过0.45 μm的滤头过滤后加入细胞中,感染36 h后加入嘌呤霉素筛选稳定表达的细胞。
1.5 RNA的抽提、逆转录和实时荧光定量PCR(qRT-PCR)
使用TRIZOL试剂将细胞裂解,加入三氯甲烷萃取,12 000 r/min,4℃,离心10 min;异丙醇沉淀,加入75% 乙醇清洗沉淀,最后加入DEPC-H2O溶解。将抽提的RNA在逆转录试剂盒指导下逆转录为cDNA。最后根据TAKARA购买的荧光定量PCR试剂盒在Agilenr公司的qRT-PCR仪中反应,β-肌动蛋白(β-Actin)和 2-ΔΔCt用作本实验的内参。
1.6 Western印迹检测
SDS-PAGE蛋白胶被用来分离蛋白质样本,电泳后将蛋白质转到NC膜上,之后用TBST 缓冲液(buffer)配置的5%的脱脂牛奶于室温下封闭1 h,洗膜后过夜孵育一抗,第二天将膜洗3次,根据一抗来源孵育二抗60 min。最后,使用Tanon公司的核酸凝胶成像仪进行ECL显影。β-肌动蛋白为本实验的内参蛋白质。
1.7 免疫荧光分析
将细胞传于共聚焦小皿,密度10%~20%;PBS清洗后使用4%多聚甲醛固定15 min;PBS清洗后再用5% BSA封闭1 h;一抗孵育4℃过夜;二抗孵育1 h,最后去除二抗后PBS洗3遍,静置干燥后加入含DAPI的抗淬灭剂,随后在Leica公司的共聚焦荧光显微镜下观察拍照。
1.8 核质分离检测
配置含蛋白酶抑制剂的低渗缓冲液:10 mmol/L HEPES(PH 7.9),1.5 mmol/L MgCl2,10 mmol/L KCl,(Cocktail 现配现用);将细胞消化后PBS洗3遍,加入低渗缓冲液冰上静置20 min;加入10 μL 10% NP-40,吹打混匀,冰上静置2 min,10 000 r/min,4℃,离心10 min;上清即为细胞质,沉淀则为细胞核。
1.9 细胞生长曲线测定
在24 孔板中传5 000个细胞,按照时间梯度收集细胞计数,在计数完成后进行数据分析,细胞数量=细胞浓度×细胞体积。
1.10 细胞克隆形成实验
细胞经过消化后制成单细胞悬液,以2×103/孔的密度接种于6孔板中,培养10 d。培养完成后,弃去上清液,PBS洗细胞,加入多聚甲醛(4%, 15 min) 进行固定,GIMSA 染色30 min。
1.11 细胞周期分析
细胞被胰酶消化后PBS洗3遍,并加入70%预冷乙醇于-20℃固定过夜;第2 d,将细胞离心,去除上清,加入PBS清洗1遍,加入200 μL 50 μg/mL 的碘化丙啶(PI)染液悬浮细胞,冰上避光放置30 min;最后使用beckman coulter流式细胞仪对样品进行测试,采集的细胞周期结果用CytExpert软件进行分析。
1.12 统计学分析
本研究中的所有实验均进行了至少3次独立重复实验,数据统计全部按照平均数±标准差(Mean±SD)。双尾t检验被用来分析组间的数据差异显著性,P<0.05表示有统计学差异,记为“*”;P<0.01,记为“**”;P<0.001,记为“***”。
2 结果
2.1 三元基序家族蛋白15在细胞核和细胞质中均有分布
为了确定TRIM15在细胞中的分布情况,在HepG2细胞中进行核质分离实验,Western 印迹检测细胞核中标志物PARP和细胞质中的标志物GAPDH,以证明核质分离成功,从而验证TRIM15分布在细胞核和细胞质(Fig.1A)。免疫荧光检测(Fig.1B)则更加地直观证明了TRIM15在细胞中的分布情况。以上结果证明,TRIM15在细胞核和细胞质中均有分布。但是,TRIM15在细胞核中的丰度明显高于在细胞质中,提示其在细胞核中发挥主要功能。
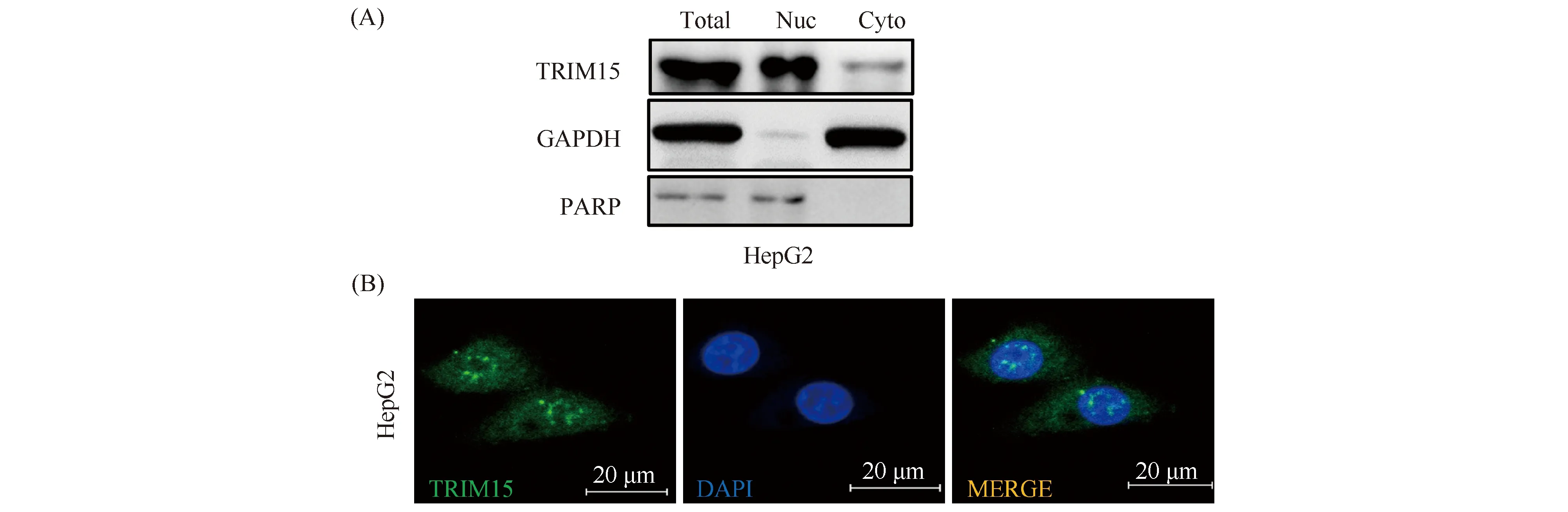
Fig.1 TRIM15 is located in the nucleus and cytoplasm (A) Nucleocytoplasmic separation assays demonstrated that TRIM15 is located in the nuclear and cytoplasm. GAPDH was used as a marker of the cytoplasm, PARP was used as a marker of the nucleus. (B) TRIM15 subcellular localization was detected by immunofluorescence, DAPI was used to stain the nucleus, and TRIM15 was stained with anti-TRIM15 antibodies
2.2 敲低三元基序家族蛋白15细胞形态异常
TRIM15的2条shRNA敲低序列(Table 2), 第一条敲低序列位于第二条外显子内,第2条敲低序列则位于第四条与第五条外显子中(Fig.2A),qRT PCR的引物列于Table 3。TRIM15敲低后,Western印迹(Fig.2B)和qRT-PCR(Fig.2C)分别从蛋白质和mRNA水平验证了TRIM15的敲低效果。结果显示,TRIM15敲低后细胞形态发生变化,HCCLM3细胞变圆且生长缓慢,HepG2细胞生长更加分散,并且产生损伤(Fig.2D)。
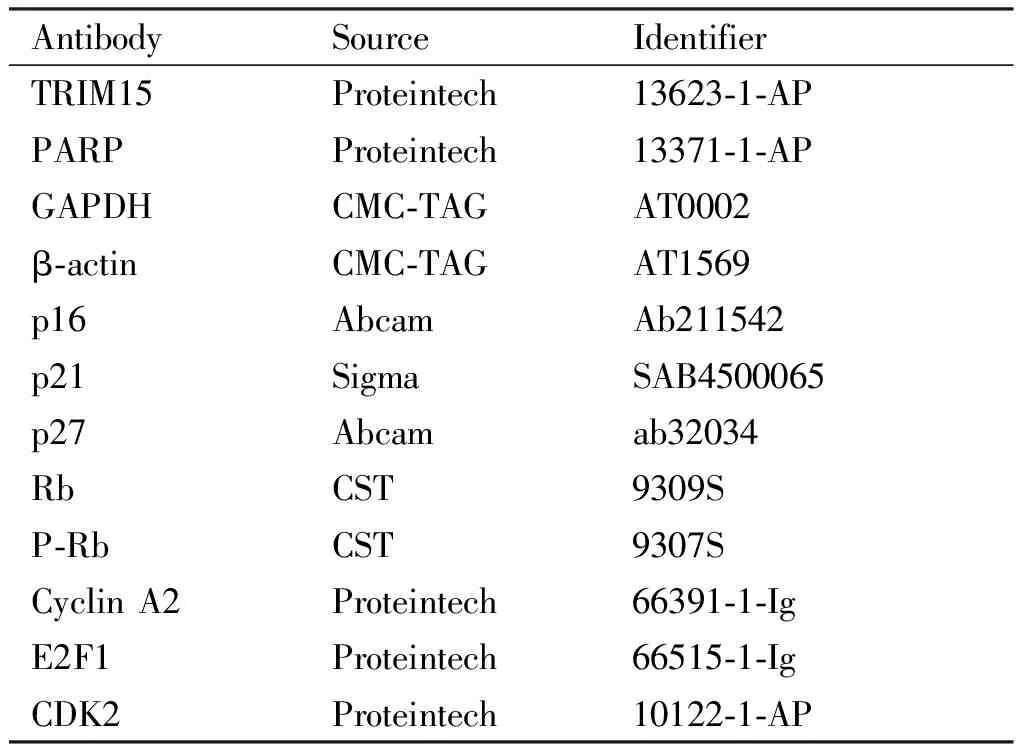
Table 1 Antibodies used in this study
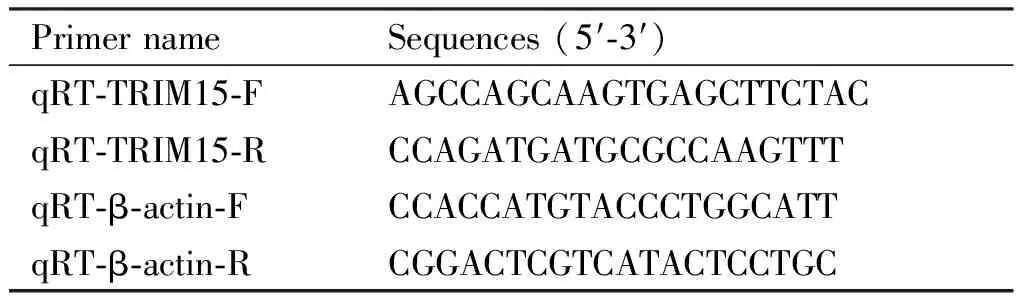
Table 3 Primers used for qRT-PCR
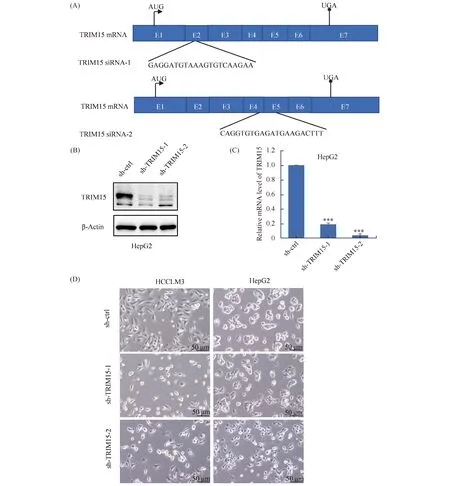
Fig.2 TRIM15 knockdown Changes the cell morphology of hepatoma cells (A) The position of two knockdown sequences of TRIM15. (B) The protein levels of TRIM15 were examined by Western blotting after knockdown of TRIM15 by transfection of sh-TRIM15 in HepG2 cells. (C) The mRNA levels of TRIM15 were examined by qRT-PCR after knockdown of TRIM15 by transfection of sh-TRIM15 in HepG2 cells. (D) Cell morphology changes after knockdown TRIM15 in HCCLM3 and HepG2 cells under the inverted optical microscope. Data were presented as mean ± SD (n=3). *P<0.05, **P<0.01, ***P<0.001
2.3 敲低三元基序家族蛋白15抑制肝癌细胞的增殖
在3种肝癌细胞系HepG2、HCCLM3和PLC中,敲低TRIM15,在不同时间段进行细胞计数。结果显示,与对照组相比,敲低TRIM15细胞生长受到显著抑制(P<0.05,Fig.3A),克隆形成结果说明敲低TRIM15后克隆数显著减少,细胞克隆形成能力受阻(Fig.3B)。上述结果表明,敲低TRIM15可以显著抑制肝癌细胞的增殖。
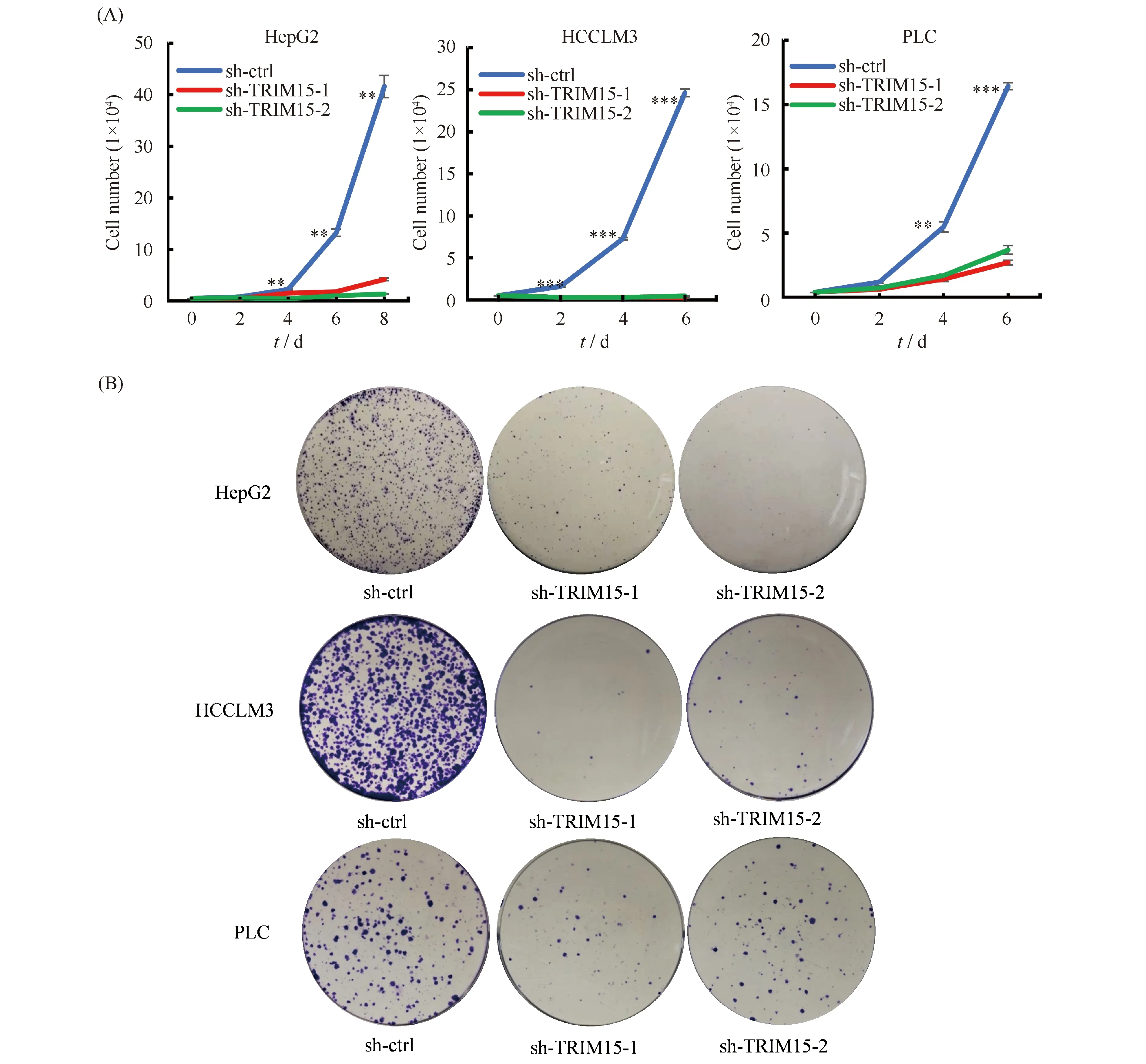
Fig.3 TRIM15 knockdown inhibits the proliferation of hepatoma cells (A) Cell growth curve assays demonstrated that TRIM15 knockdown suppressed proliferation of HepG2, HCCLM3, and PLC cells. (B) TRIM15 knockdown inhibited colony formation in HepG2, HCCLM3, and PLC cells. Representative pictures of the colonies are shown. Data were presented as mean ± SD (n=3). *P<0.05, **P<0.01, ***P<0.001
2.4 三元基序家族蛋白15敲低引起细胞周期受阻于G0/G1期
通过流式细胞术检测敲低TRIM15后对细胞周期的影响(Fig.4A)。结果显示,与对照相比,敲低TRIM15后G0/G1期HepG2细胞增加约11%,S期细胞减少约4%,G2/M期细胞减少约7%(Fig.4B)。综上所述,敲低TRIM15通过延缓G1/S的转化来抑制肝癌细胞的增殖。
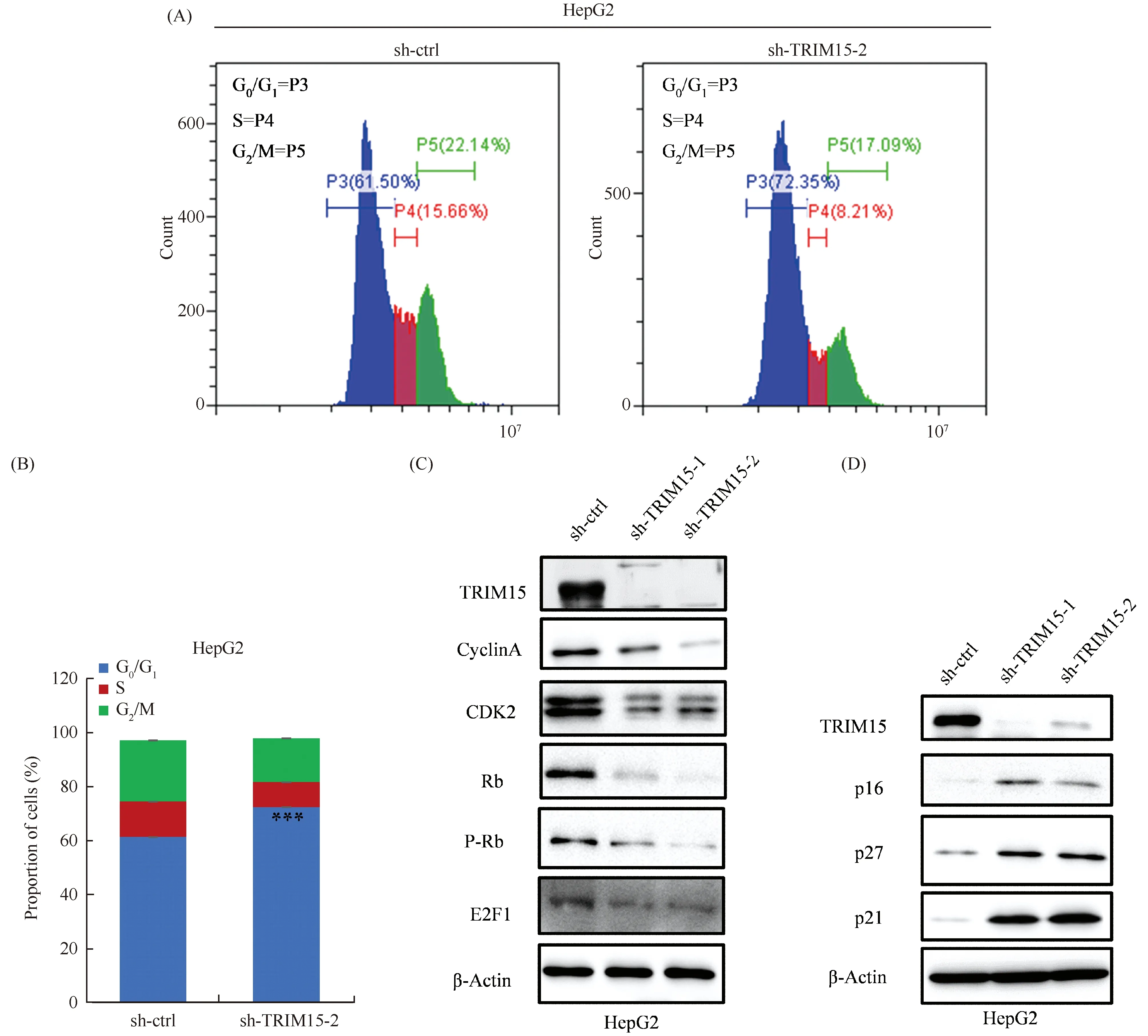
Fig.4 Knockdown of the TRIM15 gene induces G0/G1 arrest (A, B) The cell cycles of HepG2 cells were analyzed by FACS. TRIM15 knockdown blocked the cell cycle progression of HepG2 cells in the G0 /G1 phase. Data for each band represent the mean of three independent experiments. (C, D) Western blotting analysis of the indicated genes after knockdown of TRIM15 in HepG2 cells. β-Actin was used as a loading control. Data were presented as mean ± SD (n=3). *P<0.05, **P<0.01, ***P<0.001
为了探索敲低TRIM15诱导G0/G1细胞周期阻滞的机制,本文通过免疫印迹检测以确定TRIM15对细胞周期相关蛋白质的影响,特别是G1/S细胞周期检查点相关蛋白质。结果显示,TRIM15敲低后的HepG2细胞中,细胞周期蛋白A、CDK2、Rb、P-Rb、E2F1显著下调(Fig.4C)。随后检测了CDK抑制因子p16、p21、p27,发现TRIM15的敲低使p16、p21、p27蛋白水平明显上调(Fig.4D)。综上所述,敲低TRIM15通过抑制CDK2/Rb/E2F1信号通路,从而抑制细胞增殖。
3 讨论
HCC是目前最常见的恶性致命肿瘤,在发展中国家发生率最高,化疗和免疫疗法是治疗HCC的最佳选择[19]。探索潜在的HCC治疗靶标是目前肝细胞癌研究的热点和难点问题。
据文献表明,人们对TRIM15在肝癌细胞增殖、细胞周期的分子和生理功能知之甚少。在不同肿瘤细胞中,TRIM15对肿瘤的生长或迁移发挥着抑制或促进作用[16,17,20]。通过查阅TCGA和GTEx数据库,我们发现TRIM15 在肝癌组织中的表达水平明显高于其在正常肝组织中的表达量,是潜在的肝癌预后标志物。本研究敲低TRIM15 后,通过生长曲线和克隆形成检测发现肝癌细胞生长停滞,流式细胞术证明细胞周期被阻滞在G0/G1期。检测G1期CDK的正调控因子细胞周期蛋白质和负调控因子CKI的变化,结果显示,敲低TRIM15导致细胞周期蛋白A表达减少,CKI(例如p16、p21和p27[21])表达增多,这表明G0/G1期CDK2活性受到抑制。不仅如此,CDK2及其下游相关蛋白质Rb、P-Rb、E2F1表达量均减少。事实证明,TRIM15缺失会显著抑制CDK2/Rb/E2F1信号通路,导致细胞周期受阻。p16、p21和p27的高表达同样与细胞衰老相关,然而本研究在敲低TRIM15后,通过β半乳糖苷酶染色,发现衰老细胞比例并未明显增加(结果未展示)。
综上所述,我们的研究发现肝癌细胞系敲低TRIM15通过诱导G0/G1阻滞从而抑制肝癌细胞增殖。然而,人们对TRIM15的理解仍不够深入。TRIM15的其他重要生物学功能及其调节细胞增殖分子机制值得进一步研究。我们接下来的工作会通过体内实验进一步验证 TRIM15对肝癌细胞增殖的作用机制。

