重症急性胰腺炎大鼠血浆中6种线粒体N-甲酰肽及胰腺FPR1的表达研究
肖懿,张桂贤,高瑞芳,李霞,沈洪昇,刘洪斌△
重症急性胰腺炎(severe acute pancreatitis,SAP)作为一种病死率极高的急性胰腺炎(AP),不仅具备AP的临床表现和生化改变,还伴有持续(>48 h)器官功能衰竭[1]。损伤相关分子模式(damage associated molecular patterns,DAMPs)是指发生创伤或严重失血等情况时被释放到细胞间隙或血液循环中的一类物质[2]。胞内来源的线粒体DAMPs分子包括线粒体N-甲酰肽(N-formyl peptides,NFPs)和线粒体DNA(mitochondrial DNA,mtDNA)。研究发现SAP模型大鼠血浆mtDNA浓度显著升高,并与多器官损伤程度密切相关[3]。MT-ND1、MT-ND2、MT-ND3、MT-ND4、MT-ND5和MT-ND6均属于人线粒体基因组所编码的人源线粒体NFPs的氨基酸序列。甲酰肽受体(formyl peptide receptors,FPRs)属于7次跨膜G蛋白偶联受体家族[4],参与并调控多种炎症性疾病[5]。人体内有3种FPRs,分别是FPR1、FPR2和FPR3[6]。线粒体NFPs作为主要的促炎介质,可被FPR1和FPR2所识别。已知NFPs可作用于中性粒细胞表面FPR1,激活中性粒细胞的免疫功能[7]。目前,探讨FPR1和炎症关系的研究颇多,但线粒体NFPs和FPR1与SAP的关系尚不明确。本研究以6种线粒体NFPs及FPR1为切入点,初步探究SAP进程中其相关表达情况,为拮抗SAP病程中的炎症级联反应寻找潜在治疗靶点。
1 材料与方法
1.1 主要试剂及仪器 牛磺胆酸钠购自Sigma公司;全血总蛋白提取试剂盒(TF211148)购自北京百奥莱博科技有限公司;BCA蛋白质定量试剂盒(UE285903)购自Thermo Fisher Scientific公司;兔抗大鼠MT-ND1(GR3189552-7)、MT-ND3(GR3202807-11)、MT-ND5(GR3286204-5)购自Abcam公司;兔抗大鼠MT-ND2(AB2E05N)、MT-ND4(AB2E06N)抗体购自Invitrogen公司;兔抗大鼠MT-ND6(A3918)抗体和兔抗大鼠FPR1(W0838)抗体均购自biorbyt公司;ECL化学发光液(No.1722102)购自Millipore公司;辣根酶标记山羊抗兔IgG(H+L,127760)、兔SP试剂盒(2005E1124)、DAB显色试剂盒(2040A1012)和抗体稀释液(19082903)购自北京中杉金桥公司。Tanon-5200化学发光分析仪和PowerPac Basic、Mini-PRO TEAN®Tetra、Mini Trans-Blot垂直电泳系统均购自Bio-Rad公司;CX41微图HTC1600正置显微镜购自日本Olympus公司。
1.2 实验动物 6周龄SPF级雄性SD大鼠30只,体质量180~200 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2020-0004。正常饲料喂养,自由进食饲料和水,室内通风良好,饲养环境12 h光照与12 h黑暗交替循环,温度(22±3)℃,相对湿度(50±10)%。大鼠适应性喂养1周后进行实验。
1.3 分组与模型制备 将30只大鼠按随机数字表法分为3组:假手术组、SAP模型3 h组和SAP模型6 h组,每组10只。假手术组仅在开腹并轻轻翻动胰腺后关闭腹腔。参照文献[8]方法,模型制备前禁食12 h,不禁水。以10%水合氯醛(0.3 g/kg)腹腔注射麻醉,无菌条件下经腹壁正中切口入腹,于胆管出肝门端以无损伤小动脉夹暂时阻断胆管,寻找到胆胰管十二指肠乳头开口处,在其对应系膜缘处用4号注射针头刺一小孔,用PE50导管经乳头部逆行插入胆胰管0.5 cm,妥善固定,以5%牛磺胆酸钠匀速注入(50 mg/kg,0.1 mL/min),注射完毕后拔管,5 min后去除小动脉夹,以无损伤缝线缝合十二指肠穿刺孔,缝合腹壁。实验完毕后将各组大鼠放回鼠笼常规饲养,密切关注其生命体征。
1.4 样本采集 SAP造模3 h后对SAP模型3 h组取材,SAP造模6 h后对假手术组和SAP模型6 h组取材。以10%水合氯醛(0.3 g/kg)腹腔注射麻醉,大鼠取仰卧位固定开腹,4%枸橼酸钠(1∶9)预润洗处理一次性无菌注射器,抽取腹主动脉全血5 mL,将抗凝全血离心留取血浆,分装储存于-20℃备用;取胰腺组织于4%多聚甲醛中固定备用。
1.5 胰腺组织HE染色及病理评分 胰腺组织于4%多聚甲醛中固定48 h后取出,常规脱水包埋,行5μm厚切片,捞片后60℃烤片过夜,二甲苯脱蜡,梯度乙醇脱水,苏木素染色,流水冲洗片刻后伊红染色,流水冲洗多余染料,脱水透明,中性树胶封片,在显微镜下观察胰腺组织形态学变化。依照Schmidt病理评分标准[9]对各组胰腺组织进行评分。
1.6 免疫组化法检测胰腺组织FPR1表达 胰腺组织石蜡切片60℃烘片过夜后置于室温30 min。切片置于新鲜二甲苯脱蜡及梯度乙醇脱水后,进行常规抗原热修复,自然冷却至室温后用PBS漂洗3次,每次5 min,随后置于湿盒内滴加内源性过氧化物酶阻断剂室温孵育15 min。经PBS漂洗3次,每次3 min,使用羊血清工作液于湿盒中封闭2 h,FPR1抗体(1∶200)4℃孵育过夜。次日复温至室温后PBS漂洗3次,每次3 min,生物素标记羊抗兔IgG湿盒常温孵育15 min。PBS漂洗3次,每次3 min,用辣根酶标记链霉卵白素工作液于湿盒中常温孵育15 min。PBS漂洗3次,每次3 min,滴加DAB显色液显色2~3 min,自来水中止显色。苏木素复染、脱水、透明,中性树胶封片,镜下观察表达情况。采用Image J软件测量典型图像中阳性信号区域占比3次,FPR1阳性表达率(%)=强阳性占比+阳性占比+弱阳性占比。
1.7 免疫印迹法检测血浆中6种线粒体NFPs表达 按照蛋白提取试剂盒说明书指示提取冻存血浆蛋白,BCA蛋白质定量试剂盒进行蛋白定量,用loading buffer配平蛋白提取液并在100℃金属浴中加热10 min。根据蛋白不同情况取最佳上样量,其中MT-ND1、MT-ND3和MT-ND6上样量均为60μg,MT-ND2和MT-ND4上样量均为30μg,MT-ND5上样量为10μg。SDS-PAGE分离,转膜,室温下用5%脱脂牛奶封闭,4℃孵育兔抗大鼠一抗MT-ND1(1∶1 000)、MT-ND2(1∶500)、MT-ND3(1∶1 000)、MT-ND4(1∶1 000)、MT-ND5(1∶500)、MT-ND6(1∶1 000)过夜,洗膜,室温下孵育羊抗兔二抗(1∶5 000)1 h,洗膜,加入ECL发光液于化学发光分析仪中曝光。用Image J软件重复测量各条带灰度值3次。各组MTND1水平为各组MT-ND1蛋白灰度值与假手术组MT-ND1蛋白灰度值均值的比值,MT-ND2、MT-ND3、MT-ND4、MTND5和MT-ND6依此类推。
1.8 统计学方法 采用SPSS 22.0进行数据分析,正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。胰腺组织FPR1阳性表达率数据通过取平方根变换后满足正态性和方差齐性。P<0.05为差异有统计学意义。
2 结果

Fig.1 HE staining of the pancreatic tissues(first row×100;second row×200)图1 各组胰腺组织的HE染色情况(第一排×100;第二排×200)
2.1 各组胰腺组织HE染色以及病理评分结果 假手术组胰腺组织无水肿、充血和胰腺坏死,镜下无明显病理变化,胰腺腺泡排列规则,腺管形态正常,无明显充血、坏死和炎性浸润,且胰岛结构完整。与假手术组比较,SAP模型3 h组和SAP模型6 h组的胰腺组织病变明显,表现为胰腺组织出血,腺泡细胞明显肿胀、坏死,小叶结构紊乱,叶间隙增宽,间质内有明显炎性细胞浸润等病理改变。其中SAP模型6 h组可见腺泡细胞坏死更甚,中性粒细胞、单核细胞等炎性细胞浸润面积更大,出血更加明显,胰岛周围尤甚,见图1。假手术组、SAP模型3 h组和SAP模型6 h组病理评分分别为(4.20±1.64)、(9.40±1.39)和(13.50±1.41)分,差异有统计学意义(F=98.576,P<0.05)。与假手术组比较,SAP模型3 h组和SAP模型6 h组的病理评分明显升高,SAP模型6 h组病理评分明显高于SAP模型3 h组(均P<0.05)。
2.2 各组胰腺组织FPR1表达水平 假手术组中胰腺腺泡细胞未见明显FPR1表达,仅胰岛出现弱阳性表达;相较于假手术组,SAP模型3 h组和SAP模型6 h组的胰腺组织FPR1主要定位表达于炎性浸润区域和胰腺组织坏死区域,且SAP模型6 h组因坏死区域面积更大,炎性细胞浸润更甚,而出现明显黄棕染色情况,见图2。假手术组、SAP模型3 h组和SAP模型6 h组的FPR1阳性表达率分别为(11.00±1.34)%、(31.80±2.12)%和(56.90±1.37)%,差异有统计学意义(F=4 636.458,P<0.05),SAP模型3 h组和SAP模型6 h组的胰腺组织FPR1表达水平均较假手术组升高,SAP模型6 h组的FPR1阳性表达率较SAP模型3 h组明显增加(P<0.05)。
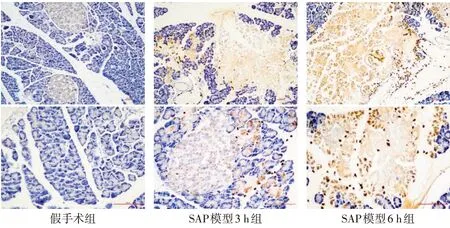
Fig.2 Expression of FPR1 in pancreatic tissue(IHC,first row×100;second row×200)图2 胰腺组织中FPR1的表达(免疫组化法,第一排×100;第二排×200)
2.3 血浆中6种线粒体NFPs的表达水平 与假手术组相比,SAP模型3 h组和SAP模型6 h组的MTND1、MT-ND3和MT-ND6蛋白表达水平均显著增高(P<0.05),且呈现递增趋势。SAP模型3 h组和SAP模型6 h组MT-ND2表达水平相较于假手术组表达均升高,但SAP模型6 h组表达低于SAP模型3 h组(P<0.05)。MT-ND4表达水平在3组中呈现递减趋势(P<0.05)。3组MT-ND5表达水平差异无统计学意义。见图3、表1。
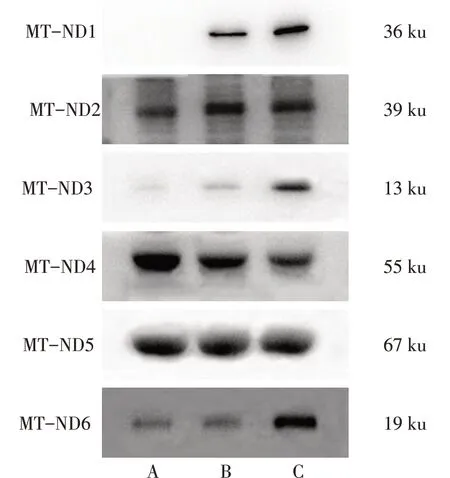
Fig.3 Expression levels of 6 kinds of mitochondrial N-formyl peptides in plasma图3 血浆中6种线粒体NFPs的表达
Tab.1 Comparison of expression levels of 6 mitochondrial NFPs in plasma of rats between the three groups表1 各组大鼠血浆中6种线粒体NFPs的表达比较(n=10,±s)
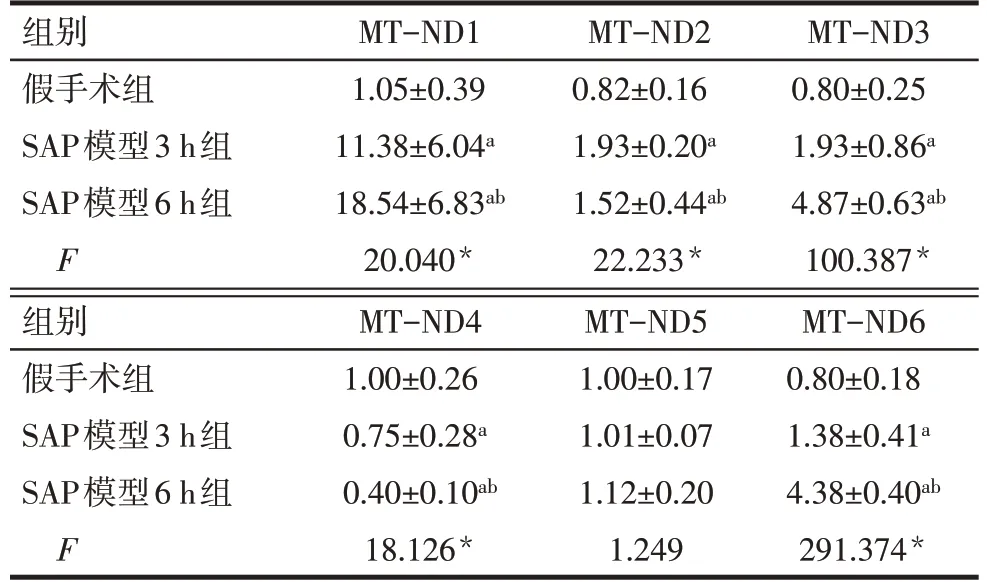
Tab.1 Comparison of expression levels of 6 mitochondrial NFPs in plasma of rats between the three groups表1 各组大鼠血浆中6种线粒体NFPs的表达比较(n=10,±s)
*P<0.05;a与假手术组相比,b与SAP模型3 h组相比,P<0.05。
组别假手术组SAP模型3 h组SAP模型6 h组F MT-ND1 1.05±0.39 11.38±6.04a 18.54±6.83ab 20.040*MT-ND2 0.82±0.16 1.93±0.20a 1.52±0.44ab 22.233*MT-ND3 0.80±0.25 1.93±0.86a 4.87±0.63ab 100.387*组别假手术组SAP模型3 h组SAP模型6 h组F MT-ND4 1.00±0.26 0.75±0.28a 0.40±0.10ab 18.126*MT-ND5 1.00±0.17 1.01±0.07 1.12±0.20 1.249 MT-ND6 0.80±0.18 1.38±0.41a 4.38±0.40ab 291.374*
3 讨论
早期SAP患者死亡的重要原因是伴有全身炎症反应综合征(SIRS)的暴发性器官衰竭[10]。在急性创伤过程中,NFPs释放到外周循环系统,和对线粒体DAMPs有反应的免疫细胞一起参与SIRS的形成[11]。已知NFPs的公认经典配体FPRs[12]所介导的疾病包括炎症性肺部疾病[13]、结肠炎、单核苷酸多态性相关牙周炎等[14]。FPR1在众多免疫细胞均有表达,且作为体内炎症环境的关键调节器已成为研究的热点[15]。研究发现,经典的核苷酸结合寡聚化结构域样受体3炎性体可通过FPR1通路调控闭塞性细支气管炎综合征[16]。早期AP出现的并发症均与血管功能紊乱有关,包括内皮激活和损伤,血管通透性增加,白细胞向组织迁移增加等[17];而FPR1的激活可以刺激众多下游信号通路,这些信号通路与血管收缩和中性粒细胞的黏附、趋化、吞噬、分泌颗粒的胞吐等作用有关[18]。通过调控中性粒细胞的功能,FPR1在炎症和许多疾病的病理过程中均扮演重要角色[19-20]。但是,炎症反应为自身免疫的重要一环,其作用对人体是“有利”还是“有害”,取决于FPR1所介导的炎症反应的方向与程度。FPRs本身还可作为药物作用靶点,用于许多炎症性疾病的针对性治疗[21],如竞争性FPR1拮抗剂二肽HCH6-1可能作为一种治疗FPR1相关炎症性肺部疾病的新药物[22]。
本研究显示,牛磺胆酸钠诱导大鼠SAP模型后胰腺组织出现明显出血坏死以及炎性浸润。随着SAP造模时间延长,胰腺组织FPR1表达逐渐增加,表明SAP大鼠胰腺病变程度与FPR1相关;而FPR1与炎症密不可分,推测其与SAP的过度炎症反应和炎症级联放大有关。值得注意的是,Gabl等[23]发现MT-ND3和MT-ND6对FPR1有受体偏好,MT-ND4和MT-ND5倾向于FPR2,MT-ND2是较弱的中性粒细胞激活剂,MT-ND1不发挥激动或拮抗FPR作用。本研究发现,MT-ND5的表达与SAP病情无明显关系,MT-ND1、MT-ND3和MT-ND6随病情进展而表达升高,推测其可能参与SAP的炎症反应过程,且其表达水平与炎症程度有关。3组MT-ND2的表达结果则呈“类钟形”曲线,可能表明其确实参与炎症反应,但受到其他调控或蛋白的影响。随着SAP造模时间延长,MT-ND4可能出现了负反馈式表达递减,具体调节机制有待进一步探究。
综上所述,SAP进程中,包括胰腺腺泡细胞在内的受损细胞会释放线粒体NFPs进入血循环,激活FPR信号通路,而趋化受体FPR1的活化将进一步激活包括中性粒细胞在内的免疫细胞,这与牛磺胆酸钠诱导的SAP失控的过度炎症反应密切相关。本研究为线粒体NFPs在内的DAMPs参与SAP病程提供了理论基础,具体机制有待进一步研究论证。

