槲皮素通过miR-101/EZH2轴介导的EMT途径改善NSCLC吉西他滨耐药的机制研究
钱麒钰,袁改利,马珊珊,罗莉梅,徐玉
非小细胞肺癌(NSCLC)为一种高度恶性的难治性肿瘤。NSCLC的高转移性及放化疗耐药性的产生是导致NSCLC患者生存期变短的重要原因[1]。减少NSCLC转移,提高放化疗治疗效果,对促进患者生存及改善预后有重要意义。肿瘤上皮细胞间充质转分化(EMT)表型改变引起的耐药基因如Zeste基因同源蛋白2(EZH2)表达异常,是促进癌细胞转移、耐药性增强的关键因素[2-4]。miR-101与EZH2之间有靶向调控关系[5],且miR-101/EZH2轴已被证实是参与子宫内膜癌、结肠癌等肿瘤细胞EMT表型改变、耐药性产生的关键信号通路[6],但干预调控miR-101/EZH2轴对NSCLC细胞影响的相关研究较少。
槲皮素为天然黄酮类成分,现代药理学发现,其对乳腺癌、胃癌、胰腺癌等癌细胞转移有抑制作用[7],且其对NSCLC细胞EMT表型改变也有抑制作用[8]。但槲皮素是否可通过抑制EMT表型改变来改善NSCLC对放化疗的敏感性尚未可知。本研究通过体外培养NSCLC细胞,从miR-101/EZH2轴方面对此进行探究验证,以期为槲皮素用于治疗肺癌提供理论依据。
1 材料与方法
1.1 材料 人NSCLC细胞系A549细胞株购自上海奥陆生物科技有限公司;槲皮素购自北京索莱宝科技有限公司;EMT诱导剂转化生长因子(TGF)-β1(重组人TGF-β1蛋白水解加工复合物)购自美国PEPROTECH公司;吉西他滨(Gb)购自北京伊塔生物科技有限公司;CCK-8试剂盒购自上海经科化学科技有限公司;miR-101抑制物(miR-101-inhibitor)及其阴性对照试剂(miR-NC)均由南京金斯瑞生物科技有限公司设计合成;EZH2、TGF-β1、果蝇母亲DPP同源物4(SMAD4)、磷酸化SMAD4(p-SMAD4)、E钙黏蛋白(Ecadherin)、N钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、内参β-actin兔抗人抗体和辣根过氧化物酶羊抗兔二抗均购自美国abcam公司;SpectraMax iD3酶标仪购自美谷分子仪器(上海)有限公司;7500实时荧光定量PCR(qPCR)仪购自美国Thermo Fisher公司。
1.2 细胞复苏及培养 A549细胞株常规复苏后,取适量细胞,DMEM高糖培养基培养于恒温培养箱中常规传代培养。参照文献[9],按Gb浓度递增法培养获得A549耐Gb高浓度(200 nmoL/L)细胞株,若A549/Gb细胞能够在含200 nmol/L Gb培养液培养中稳定生长和传代,则视为耐药细胞株造模成功。
1.3 CCK-8法检测细胞增殖情况 将A549、A549/Gb细胞按5×104个/孔的密度接种于6孔板内,向培养液中加入终浓度为0、4、8、16、32、64、128、256μmol/L的槲皮素,干预培养48 h后,加入CCK-8溶液10μL继续培养2 h,酶标仪上于450 nm波长下检测光密度(OD)值,根据OD值计算细胞生存率(%)=实验组OD值/空白组OD值×100%。绘制生长曲线,计算半数抑制浓度(IC50),选取IC50的槲皮素浓度作为A549、A549/Gb细胞的干预浓度。
1.4 细胞分组及处理 取对数期A549细胞,以5×104个/孔的密度接种于6孔板内,并设置为空白组(A549细胞入正常培养基培养)、A549+EMT诱导剂[10]组(4μg/L TGF-β1处理)、A549+槲皮素组(64μmol/L槲皮素处理)、槲皮素+EMT诱导剂组(64μmol/L槲皮素+4μg/L TGF-β1处理),每组6个复孔。取对数期A549细胞及A549/Gb细胞,以5×104个/孔的密度接种于6孔板内,并设置为A549组、A549/Gb组、A549/Gb+槲皮素组(128μmol/L槲皮素处理)、A549/Gb+EMT诱导剂组(4μg/L TGF-β1处理)、miR-101-inhibitor组(A549/Gb细胞转染miR-101-inhibitor)、miR-NC组(A549/Gb细胞转染miR-NC)、槲皮素+miR-101-inhibitor组(A549/Gb细胞转染miR-101-inhibitor+128μmol/L槲皮素),每组设置6个复孔。各组干预培养48 h后,收集细胞进行后续研究。
1.5 qPCR检测各组细胞miR-101表达水平 取各组干预培养后的细胞,加入细胞裂解液匀浆粉碎后,RNA提取试剂盒提取总RNA,并逆转录得到cDNA,以cDNA为模板(10×cDNA模板1μL),加入上、下游引物各0.5μL,H2O 8μL,2×SYBR mix 10μL,行PCR反应。反应条件:95℃预变性14 min;95℃变性40 s,60℃退火45 s,72℃延伸20 min,50个循环。以U6为内参,用2-ΔΔCt法计算miR-101表达水平。各引物序列由生工生物工程(上海)有限公司合成,见表1。

Tab.1 Primer sequence表1 引物序列
1.6 Western blot法检测EZH2、TGF-β1/SMAD4和EMT标志蛋白E-cadherin、N-cadherin及Vimentin表达 取各组干预培养后的细胞,洗涤后裂解、匀浆粉碎获得细胞匀浆液,蛋白提取试剂盒及BCA法提取并测定匀浆液中蛋白浓度后,取25μg蛋白,行SDS-PAGE、PVDF转膜,加入1∶800的EZH2、TGF-β1、SMAD4、p-SMAD4、E-cadherin、N-cadherin及Vimentin兔抗人一抗,及1∶1 000β-actin兔抗人内参抗体,4℃孵育过夜,次日加入1∶1 500的辣根过氧化物酶羊抗兔二抗室温孵育2.5 h,增强化学发光法显影曝光,化学发光成像分析系统拍照,Image-J软件分析相对灰度值。
1.7 细胞对Gb的耐药性检测 取各组细胞,按1×105个/孔的密度接种于6孔板中,各组均加入不同浓度(0、5、10、20、40、80、100、200 nmol/L)的Gb培养24 h后,加入CCK-8溶液10μL继续培养2 h,在酶标仪上于450 nm波长下检测OD值,根据OD值绘制生长曲线,计算IC50及耐药指数(IR),IR=实验组IC50/A549细胞IC50。
1.8 统计学方法 采用Graphpad Prism 6.0进行统计分析,计量资料以均数±标准差(±s)表示,2组间比较采用t检验;多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 槲皮素对A549细胞及A549/Gb细胞生存率的影响 随着槲皮素浓度的升高,A549细胞及A549/Gb细胞生存率均逐渐降低。当槲皮素浓度为64、128μmol/L时,A549及A549/Gb细胞存活在50%左右,选用64、128μmol/L的槲皮素为A549及A549/Gb细胞的干预浓度,见图1。

Fig.1 Effects of different concentrations of quercetin on the survival rates of A549 cells and A549/Gb cells图1 不同浓度槲皮素对A549细胞及A549/Gb细胞生存率的影响
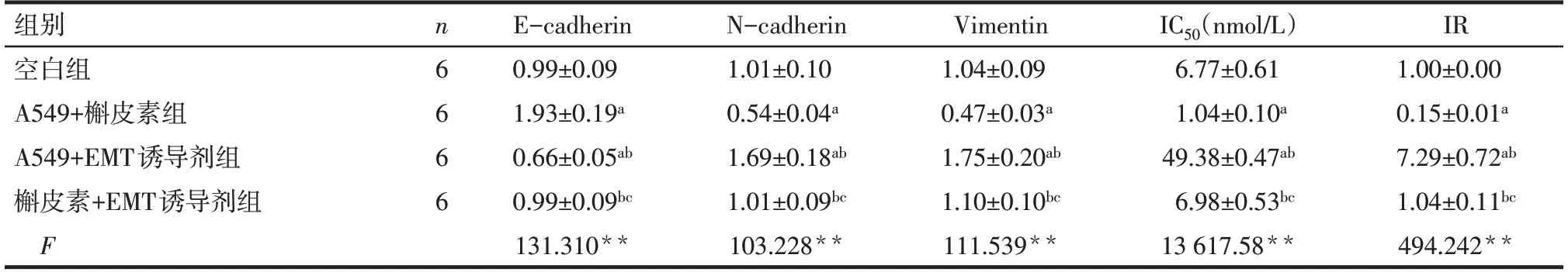
2.2 槲皮素对A549细胞EMT逆转作用及耐药性的影响 与空白组相比,A549+槲皮素组细胞Ecadherin蛋白表达水平升高,N-cadherin及Vimentin蛋白表达水平、IC50及IR降低(P<0.05);与A549+槲皮素组相比,A549+EMT诱导剂组和槲皮素+EMT诱导剂组细胞E-cadherin蛋白表达水平降低、Ncadherin及Vimentin蛋白表达水平、IC50及IR升高(P<0.05),见图2、表2。

Fig.2 Immunoblotting of E-cadherin,N-cadherin and Vimentin protein expression in cells of each group图2 各组细胞E-cadherin、N-cadherin、Vimentin蛋白表达水平免疫印迹图
2.3 槲皮素对A549细胞miR-101及EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平的影响 与空白组相比,A549+槲皮素组细胞miR-101表达升高,EZH2、TGF-β1及p-SMAD4/SMAD4蛋白表达水平均降低(P<0.05);A549+EMT诱导剂组miR-101表达降低,EZH2、TGF-β1及p-SMAD4/SMAD4蛋白表达水平均升高(P<0.05)。与A549+槲皮素组相比,槲皮素+EMT诱导剂组细胞miR-101表达降低,EZH2、TGF-β1及p-SMAD4/SMAD4蛋白表达水平均升高(P<0.05),见图3、表3。
Tab.2 Comparison of E-cadherin,N-cadherin and Vimentin protein expression levels,IC50 and IR between the four groups表2 各组细胞E-cadherin、N-cadherin、Vimentin蛋白表达水平及IC50、IR比较 (±s)
Tab.2 Comparison of E-cadherin,N-cadherin and Vimentin protein expression levels,IC50 and IR between the four groups表2 各组细胞E-cadherin、N-cadherin、Vimentin蛋白表达水平及IC50、IR比较 (±s)
**P<0.01;a与空白组比较,b与A549+槲皮素组比较,c与A549+EMT诱导剂组比较,P<0.05。
组别空白组A549+槲皮素组A549+EMT诱导剂组槲皮素+EMT诱导剂组F n6 6 6 6 E-cadherin 0.99±0.09 1.93±0.19a 0.66±0.05ab 0.99±0.09bc 131.310**N-cadherin 1.01±0.10 0.54±0.04a 1.69±0.18ab 1.01±0.09bc 103.228**Vimentin 1.04±0.09 0.47±0.03a 1.75±0.20ab 1.10±0.10bc 111.539**IC50(nmol/L)6.77±0.61 1.04±0.10a 49.38±0.47ab 6.98±0.53bc 13 617.58**IR 1.00±0.00 0.15±0.01a 7.29±0.72ab 1.04±0.11bc 494.242**

Fig.3 EZH2,TGF-β1,p-SMAD4/SMAD4 protein expression levels detected by Western blot assay in each group图3 各组细胞EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平免疫印迹图
Tab.3 Comparison of miR-101 and EZH2,TGF-β1,p-SMAD4/SMAD4 protein expression levels between the four groups表3各组细胞miR-101及EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平比较 (n=6,±s)

Tab.3 Comparison of miR-101 and EZH2,TGF-β1,p-SMAD4/SMAD4 protein expression levels between the four groups表3各组细胞miR-101及EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平比较 (n=6,±s)
**P<0.01;a与空白组比较,b与A549+槲皮素组比较,c与A549+EMT诱导剂组比较,P<0.05。
组别空白组A549+槲皮素组A549+EMT诱导剂组槲皮素+EMT诱导剂组F miR-101 1.08±0.09 1.95±0.19a 0.56±0.03ab 1.19±0.11bc 137.972**EZH2 1.04±0.09 0.44±0.05a 1.87±0.17ab 1.11±0.10bc 166.675**TGF-β1 1.17±0.11 0.24±0.20a 1.88±0.17ab 1.19±0.08bc 124.430**p-SMAD4/SMAD4 1.00±0.10 0.55±0.05a 1.69±0.22ab 1.02±0.09bc 76.765**
2.4 抑制miR-101后槲皮素对A549/Gb细胞EMT及耐药性的影响 与A549组相比,A549/Gb组细胞E-cadherin表达降低,N-cadherin及Vimentin、IC50及IR指数升高(P<0.05)。与A549/Gb组相比,A549/Gb+槲皮素组E-cadherin表达升高,N-cadherin及Vimentin表达、IC50及IR降低(P<0.05),A549/Gb+EMT诱导剂组及miR-101-inhibitor组E-cadherin表达降低,N-cadherin及Vimentin、IC50及IR升高(P<0.05)。与A549/Gb+槲皮素组相比,槲皮素+miR-101-inhibitor组及miR-NC组细胞E-cadherin表达降低,N-cadherin及Vimentin表达、IC50及IR升高(P<0.05),见图4、表4。
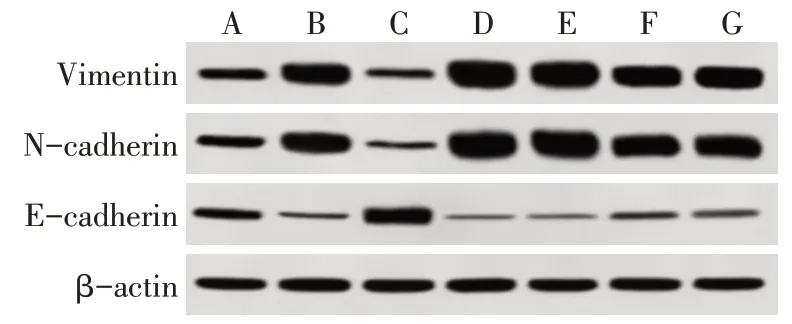
Fig.4 Immunoblotting results of E-cadherin,N-cadherin and Vimentin expression in cells of each group图4 各组细胞E-cadherin、N-cadherin、Vimentin表达免疫印迹图
2.5 抑制miR-101后槲皮素对miR-101及EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平影响 与A549组相比,A549/Gb组细胞miR-101表达降低,EZH2、TGF-β1及p-SMAD4/SMAD4蛋白表达水平均升高(P<0.05)。与A549/Gb组细胞相比,A549/Gb+槲皮素组细胞miR-101表达升高,EZH2、TGF-β1及p-SMAD4/SMAD4蛋白表达水平均降低(P<0.05);A549/Gb+EMT诱导剂组及miR-101-inhibitor组细胞miR-101表达降低,EZH2、TGF-β1及p-SMAD4/SMAD4蛋白表达水平均升高(P<0.05)。与A549/Gb+槲皮素组相比,槲皮素+miR-101-inhibitor组及miR-NC组细胞miR-101表达降低,EZH2、TGF-β1及p-SMAD4/SMAD4蛋白表达水平均升高(P<0.05),见表5、图5。
Tab.4 Comparison of E-cadherin,N-cadherin and Vimentin protein expression levels,IC50 and IR after miR-101 inhibition between the seven groups表4 抑制miR-101后各组细胞E-cadherin、N-cadherin、Vimentin蛋白表达水平及IC50、IR比较 (±s)

Tab.4 Comparison of E-cadherin,N-cadherin and Vimentin protein expression levels,IC50 and IR after miR-101 inhibition between the seven groups表4 抑制miR-101后各组细胞E-cadherin、N-cadherin、Vimentin蛋白表达水平及IC50、IR比较 (±s)
**P<0.01;a与A549组比较,b与A549/Gb组比较,c与A549/Gb+槲皮素组比较,P<0.05。
组别A549组A549/Gb组A549/Gb+槲皮素组A549/Gb+EMT诱导剂组miR-101-inhibitor组槲皮素+miR-101-inhibitor组miR-NC组F n6 6 6 6 6 6 6 E-cadherin 1.00±0.09 0.39±0.03a 1.43±0.14ab 0.16±0.04abc 0.10±0.01abc 0.41±0.04ac 0.40±0.03ac 298.561**N-cadherin 1.01±0.10 2.41±0.24a 0.44±0.04ab 2.99±0.19abc 2.91±0.20abc 2.40±0.16ac 2.44±0.19ac 192.489**Vimentin 1.04±0.09 2.33±0.19a 0.57±0.05ab 2.85±0.20abc 2.80±0.21abc 2.30±0.19ac 2.33±0.18ac 162.612**IC50(nmol/L)6.70±0.60 99.33±2.97a 26.32±0.49ab 169.38±4.77abc 166.77±4.83abc 98.18±2.50ac 97.90±2.63ac 2368.450**IR 1.00±0.00 14.89±1.42a 3.95±0.20ab 25.29±1.62abc 24.84±1.60abc 14.74±1.39ac 14.60±1.34ac 329.579**
Tab.5 Comparison of miR-101 and EZH2,TGF-β1,p-SMAD4/SMAD4 protein expression levels after miR-101 inhibition between the seven groups表5 抑制miR-101后各组细胞miR-101及EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平比较 (±s)
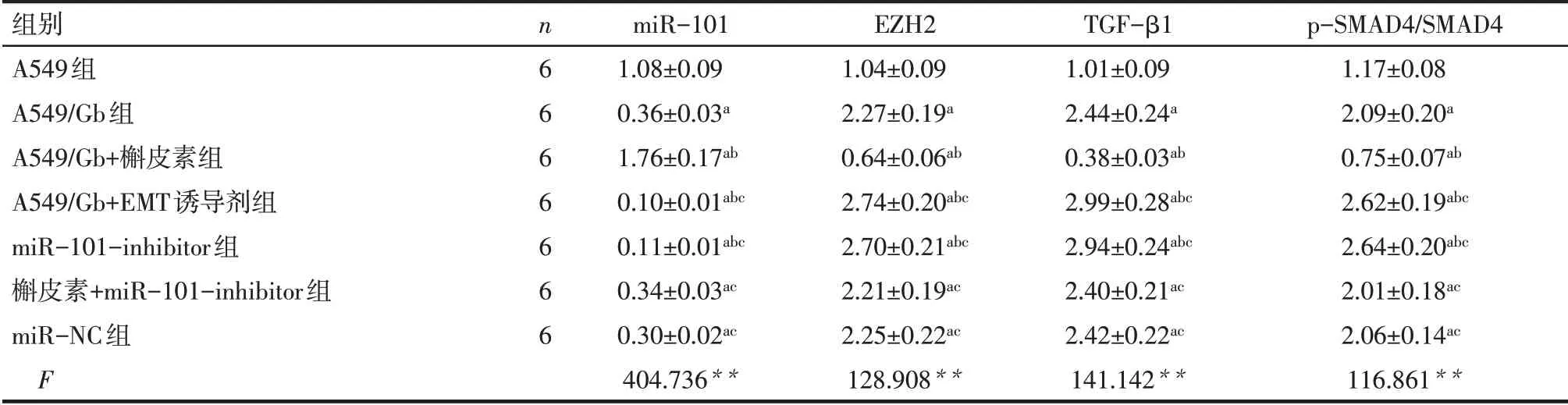
Tab.5 Comparison of miR-101 and EZH2,TGF-β1,p-SMAD4/SMAD4 protein expression levels after miR-101 inhibition between the seven groups表5 抑制miR-101后各组细胞miR-101及EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平比较 (±s)
**P<0.01;a与A549组比较,b与A549/Gb组比较,c与A549/Gb+槲皮素组比较,P<0.05。
组别A549组A549/Gb组A549/Gb+槲皮素组A549/Gb+EMT诱导剂组miR-101-inhibitor组槲皮素+miR-101-inhibitor组miR-NC组F n6 6 6 6 6 6 6 miR-101 1.08±0.09 0.36±0.03a 1.76±0.17ab 0.10±0.01abc 0.11±0.01abc 0.34±0.03ac 0.30±0.02ac 404.736**EZH2 1.04±0.09 2.27±0.19a 0.64±0.06ab 2.74±0.20abc 2.70±0.21abc 2.21±0.19ac 2.25±0.22ac 128.908**TGF-β1 1.01±0.09 2.44±0.24a 0.38±0.03ab 2.99±0.28abc 2.94±0.24abc 2.40±0.21ac 2.42±0.22ac 141.142**p-SMAD4/SMAD4 1.17±0.08 2.09±0.20a 0.75±0.07ab 2.62±0.19abc 2.64±0.20abc 2.01±0.18ac 2.06±0.14ac 116.861**
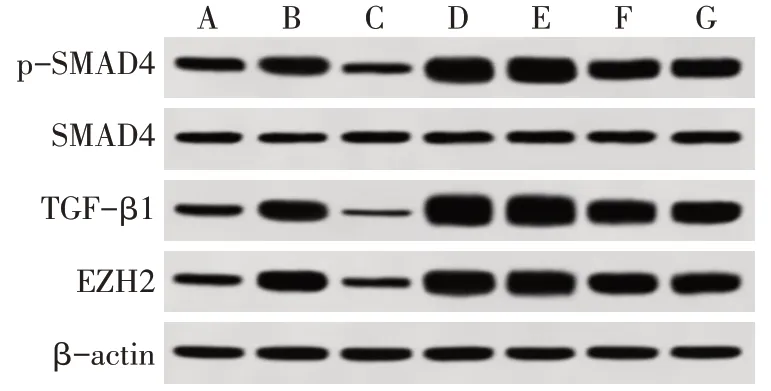
Fig.5 Western blot assay of EZH2,TGF-β1,p-SMAD4/SMAD4 protein expression in each group图5 各组细胞EZH2、TGF-β1、p-SMAD4/SMAD4蛋白表达水平免疫印迹图
3 讨论
NSCLC占肺癌的85%[1]。EMT作为引起NSCLC耐药性产生的关键因素也逐渐受到临床的关注。研究认为,EMT可赋予NSCLC细胞更高的侵袭能力,从而限制癌细胞的化疗疗效[11]。Assani等[12]发现EMT调节可改变肺癌和乳腺癌细胞对化疗的抵抗性,用EMT诱导剂促进EMT特性增加的同时,可降低化疗药物治疗的敏感性;反之,抑制EMT进程,可提高癌细胞对化疗药物的敏感性,证实EMT是癌细胞耐药性产生的关键因素。本研究用EMT诱导剂进一步增强A549及A549/Gb细胞EMT特性(Ecadherin降低,N-cadherin及Vimentin表达升高)后,A549及A549/Gb细胞表现出更强的耐药性,IC50及IR进一步升高,证实EMT增强可促进癌细胞耐药性产生。槲皮素对NSCLC细胞EMT进程有抑制作用,且槲皮素可增强NSCLC细胞对X线辐射及紫杉醇化疗等治疗敏感度[13-14]。本研究发现,槲皮素降低A549及A549/Gb细胞EMT进程的同时,其对Gb的耐药性也明显降低,而槲皮素与EMT诱导剂联合应用后,槲皮素抑制A549细胞耐药性作用被显著削弱,证实槲皮素降低A549细胞对Gb的耐药性作用可能与抑制EMT进程有关。
EZH2不仅可直接结合E-cadherin并抑制其转录而促进EMT进程[15],还可通过激活TGF-β/SMAD4通路,进一步促进EMT进程,产生更强的耐药性[16]。另外EZH2还是重要的耐药基因,研究证实,EZH2可直接调控或结合Schlafen家族成员11(SLFN11)基因的结合位点,使其降解及抑制化学抗性基因作用减弱、癌细胞DNA损伤及修复作用增强,而产生耐药性[17]。Murai等[18]认为肿瘤细胞缺乏SLFN11基因是引起癌细胞对DNA合成抑制剂如Gb、阿糖胞苷等化疗药物敏感性降低的关键原因,用EZH2组蛋白抑制剂降低EZH2,重新激活SLFN11,是提高化疗药物杀灭癌细胞效果的重要措施。本研究发现,A549及A549/Gb细胞EMT特性及耐药性升高的过程中,EZH2、EMT活化途径TGF-β/SMAD4也随之升高,证实EZH2参与EMT及耐药性产生过程。
miRNA在EMT及耐药性产生过程中发挥重要作用。EMT活化可引起多种miRNA的异常表达,介导耐药性产生,miRNA中的miR-101在多种癌细胞中表达下调,且其低表达与癌细胞EMT升高及耐药性产生关系密切[19]。Jiang等[20]发现,miR-101可靶向抑制EZH2表达,降低结肠癌细胞EMT进程。本研究发现,A549及A549/Gb细胞EMT特性及耐药性升高的过程中,miR-101表达降低,单独下调miR-101表达或加入EMT诱导剂后,EZH2表达升高,A549及A549/Gb细胞耐药性及EMT特性均升高,证实miR-101/EZH2轴也参与细胞EMT介导的耐药性产生过程。槲皮素降低A549及A549/Gb细胞耐药性及EMT进程作用的同时,miR-101表达升高,EZH2表达降低,提示槲皮素逆转EMT介导的耐药性产生作用可能与上调miR-101、抑制EZH2有关。下调miR-101或诱导EMT均可逆转槲皮素的上述作用。
综上所述,槲皮素可通过上调miR-101、抑制EZH2表达,改善EMT介导的NSCLC细胞耐药性产生。这为阐明槲皮素抗肺癌细胞耐药性产生的靶向调控机制提供了一定参考。肺癌耐药性及EMT发生机制复杂,涉及多个miRNA及多条通路共同调节。槲皮素缓解肺癌细胞EMT,阻断耐药性产生的其他机制有待进一步探究。

