miR-1307-3p通过靶向ISM1促进乳腺癌细胞的增殖和迁移
陆旭阳,刘奕,李晓辉,黄欣,黄翠霞,马书祥,窦伟瑜,曾麒燕,2△
乳腺癌发病率逐年上升,已成为女性患者癌症死亡的主要原因[1]。尽管放化疗及多种辅助治疗极大提高了患者的生存质量,但由于乳腺癌细胞的异质性,乳腺癌转移依然是目前难以攻克的问题[2]。微小RNA(micro RNA,miRNA)是一种内源性非编码RNA,其通过与靶基因3′端非编码区(3′-UTR)结合而调节靶基因的表达[3],参与细胞发育、增殖、分化和凋亡等多种生物过程[4]。研究表明,miRNA在乳腺癌的发生、侵袭及转移过程中发挥重要作用[5-6],有望成为乳腺癌诊治的靶标。本课题组前期发现,过表达linc00324可抑制乳腺癌MDA-MB-231细胞增殖,减少侵袭和迁移,增加细胞凋亡;通过MS2-RIP测序发现,linc00324可与多种miRNA相互作用,其中包括miR-1307-3p[7],但其在乳腺癌中的作用鲜有报道。本研究旨在分析miR-1307-3p对乳腺癌细胞增殖、迁移、凋亡等方面的影响,并初步分析其潜在的作用机制。
1 材料与方法
1.1 主要材料 人乳腺正常上皮细胞系MCF-10A,人乳腺癌细胞系MCF-7、MDA-MB-231购自中国科学院上海生命科学院细胞库。DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)、青/链霉素双抗、胰蛋白酶购自美国Gibco公司。miDETECT A TrackTMmiRNA RT-qPCR Starter Kit、miR-1307-3p类似物(mimics)或抑制物(inhibitor)及相应的阴性序列(control)购自广州锐博公司,序列见表1。Lipofectamine 2000转染试剂购自美国Invitrogen公司。RNA提取试剂盒购自美国赛默飞公司;总RNA逆转录和荧光定量PCR试剂盒购自日本Takara公司;CCK-8细胞增殖检测试剂盒购自日本DOJINDO公司;Annexin V-异硫氰酸荧光素(Fluorescein Isothiocyanate,FITC)/碘化丙啶细胞凋亡检测试剂盒购自南京凯基公司;双荧光素酶检测试剂盒购自美国Promega公司。多功能酶标仪(Thermo公司,美国),实时荧光定量PCR仪(ABI,美国),超净工作台(苏洁医疗器械有限公司,苏州),倒置显微镜(Olympus,日本),流式细胞仪(Beckman-Coulter公司,美国)。

Tab.1 Sequence for miRNA mimics or inhibitor表1 miRNA类似物或抑制物序列
1.2 方法
1.2.1 TCGA数据库分析miR-1307-3p在乳腺癌患者中的表达水平及其与临床指标的关系 利用TCGA数据库(https://portal.gdc.cancer.gov)分析miR-1307-3p在不同肿瘤中的表达水平,进一步从数据库中获取1 068例乳腺癌患者和104例正常乳腺组织的资料,分析miR-1307-3p在乳腺癌组织中的表达水平,并分析其与临床指标的关系。
1.2.2 细胞培养 将人乳腺正常上皮细胞株MCF-10A及人乳腺癌细胞系MCF-7、MDA-MB-231用含10%FBS的DMEM培养基,于37℃、5%CO2细胞培养箱中培养。
1.2.3 细胞转染 MCF-7细胞以3×105个/孔接种于6孔培养板,待细胞密度为70%时,用4μg mimics、mimics-control、inhibitor和inhibitor-control进行转染,以未转染细胞作为空白对照,培养6 h后,更换为完全培养基继续培养48 h。
1.2.4 总RNA提取及qPCR TRIzol法提取转染后细胞总RNA,并逆转录成cDNA。按照qPCR试剂盒说明书进行PCR反应,检测mRNA和miRNA表达水平,分别以GAPDH和U6为内参。PCR扩增条件:95℃预变性10 min;95℃2 s,60℃20 s,70℃10 s,共35个循环。以2-ΔΔCt值表示miR-1307-3p、ISM1相对表达水平。引物由日本Takara公司合成,序列见表2。

Tab.2 Primer sequence for qPCR表2 qPCR引物序列
1.2.5 CCK-8法检测miR-1307-3p对MCF-7细胞增殖能力的影响 将转染mimics和mimics control的细胞于96孔板中分别培养24、48、72、96 h后,每孔加入10μL CCK-8溶液,继续培养细胞2 h后,检测450 nm处吸光度(A)值,以此反映细胞增殖能力。
1.2.6 划痕实验分析miR-1307-3p对MCF-7细胞迁移能力的影响 MCF-7细胞以3×105个/孔接种于6孔板,按1.2.3转染。待细胞密度达90%时,用小枪头在孔中划线,PBS洗去脱落细胞后,加入完全培养基。培养24 h或48 h后,用Image J软件分析划痕愈合率。愈合率=(0 h划痕面积-24 h或48 h的划痕面积)/0 h划痕面积×100%。
1.2.7 流式细胞术分析miR-1307-3p对MCF-7细胞凋亡的影响 收集转染48 h后的细胞,用预冷PBS洗涤后,加入AnnexinⅤ-FITC(0.5 mg/L),15 min后,加入碘化丙啶(5 mg/L),上流式细胞仪分析细胞凋亡率。
1.2.8 生物信息学分析 通过miRDB、miRWalk、TargetScan数据库预测miR-1307-3p的靶基因。同时,应用TCGA数据库分析乳腺癌组织中靶基因的表达水平,并分析其在不同病理分期中的表达差异。
1.2.9 双荧光素酶实验 通过PCR扩增ISM1的3′-UTR序列,克隆至pGLO质粒构建野生型质粒,并在此基础上构建3′-UTR的突变型质粒。取对数生长期MCF7细胞,接种于6孔板,培养24 h后进行细胞转染。将miR-1307-3p mimics与ISM1 3′-UTR野生型或突变型质粒共转染细胞,并以mimics control为对照。转染48 h后,参照试剂盒说明书检测各组细胞的荧光强度。
1.3 统计学方法 采用SPSS 25.0软件进行数据分析,符合正态分布的计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 miR-1307-3p在乳腺癌组织的表达水平显著上调 TCGA数据库分析表明,miR-1307-3p在乳腺癌组织中的表达水平最高(图1);乳腺癌组织中miR-1307-3p的表达水平高于正常乳腺组织(11.17±0.04vs.10.38±0.11,t=6.372,P<0.01);有淋巴转移者miR-1307-3p表达水平低于无淋巴转移者,见表3。

Fig.1 The expression of miR-1307-3p in different tumors with analyzed by TCGA data图1 利用TCGA数据库分析miR-1307-3p在不同肿瘤中的表达水平
Tab.3 The relationship between the expression of miR-1307-3p and the clinical indicators in breast cancer patients表3 不同临床特征的乳腺癌患者的miR-1307-3p表达水平比较 (±s)

Tab.3 The relationship between the expression of miR-1307-3p and the clinical indicators in breast cancer patients表3 不同临床特征的乳腺癌患者的miR-1307-3p表达水平比较 (±s)
**P<0.01;#数据存在缺失值。
患者临床特征年龄>60岁≤60岁TNM分期#Ⅰ+ⅡⅢ+Ⅳ肿瘤直径#≤2 cm>2 cm淋巴转移#n miR-1307-3p相对表达量t 480 588 11.05±1.37 11.23±1.29 1.836 781 264 11.20±1.35 11.04±1.28 1.761 276 749 11.15±1.24 11.17±1.36 0.177有无547 324 11.13±1.32 11.39±1.33 3.214**
2.2 乳腺癌细胞中miR-1307-3p表达变化 乳腺癌细胞系MCF-7和MDA-MB-231中miR-1307-3p的相对表达水平明显高于正常乳腺细胞MCF-10A,见图2。
2.3 过表达和沉默miR-1307-3p的效果 qPCR分析表明,miR-1307-3p mimics组的miR-1307-3p表达水平是mimics control组的15.13倍,而转染miR-1307-3p inhibitor后miR-1307-3p表达水平下调约57%,见图3。
2.4 过表达miR-1307-3p促进MCF-7细胞的增殖 与mimics control组相比,miR-1307-3p mimics组细胞A450值明显增高,见图4。

Fig.2 The expression of miR-1307-3p analyzed by qPCR in different breast cells lines图2 qPCR分析不同乳腺细胞株中miR-1307-3p表达量

Fig.3 qPCR verified the expression of miR-1307-3p in MCF-7 cells transfected with miR-1307-3p mimics or inhibitor图3 qPCR验证miR-1307-3p-mimics或inhibitor转染MCF-7细胞后miR-1307-3P的表达水平

Fig.4 Overexpression of miR-1307-3p promotes the proliferation of MCF-7 cells图4 miR-1307-3p过表达促进MCF-7细胞的增殖
2.5 过表达和沉默miR-1307-3p后MCF-7细胞迁移能力的变化 划痕实验显示,与空白组和mimics control组相比,miR-1307-3p mimics组在24 h和48 h的迁移能力显著增强,见图5、表4。与空白组和inhibitor control组相比,miR-1307-3p inhibitor组在24 h和48 h的迁移能力则显著减弱,见图6、表5。

Fig.5 The effects of miR-1307-3p overexpression on the migration abilities of MCF-7 cells图5 miR-1307-3p过表达对迁移能力的影响

Fig.6 The effects of miR-1307-3p silence on migration abilities of MCF-7 cells图6 miR-1307-3p沉默对迁移能力的影响
Tab.4 Comparison of migration ability in MCF-7 cells after the overexpression of miR-1307-3p表4 miR-1307-3p过表达后各组MCF-7细胞迁移能力比较(n=3,±s)

Tab.4 Comparison of migration ability in MCF-7 cells after the overexpression of miR-1307-3p表4 miR-1307-3p过表达后各组MCF-7细胞迁移能力比较(n=3,±s)
**P<0.01;a与空白组比较,b与mimics control组比较,P<0.05。
组别空白组mimics control组miR-1307-3p mimics组F 24 h迁移率(%)16.87±2.97 14.13±3.22a 43.06±6.22ab 13.264**48 h迁移率(%)32.51±3.26 26.28±7.39a 60.13±7.46ab 12.363**
2.6 miR-1307-3p-inhibitor诱导MCF-7细胞凋亡 空白组、inhibitor control组和inhibitor组细胞凋亡 率 分 别 为(4.54±0.395)%、(4.94±0.423)%和(11.90±0.367)%,组间比较差异有统计学意义(F=107.327,P<0.01),抑制miR-1307-3p表达后MCF-7细胞凋亡率升高,见图7。
2.7 miR-1307-3p可调控ISM1基因的表达 通过miRDB、miRWalk、TargetScan数 据 库 预 测miR-1307-3p的靶基因,发现ISM1可能是其靶基因之一,相互作用位点见图8A。双荧光素酶实验显示,与对照质粒相比,miR-1307-3p mimics与ISM1 3′-UTR野生型质粒共转染后,细胞荧光素酶活性明显下降(P<0.01);而miR-1307-3p mimics与ISM1 3′-UTR突变型质粒共转染后,荧光素酶活性与对照质粒相比差异无统计学意义(P>0.05),见图8B。经qPCR分析发现,miR-1307-3p过表达明显下调MCF-7细胞中ISM1的表达,沉默miR-1307-3p表达后,MCF-7细胞中ISM1的表达明显上调(P<0.05),见图9。
Tab.5 Comparison of migration ability in MCF-7 cells after the downrgulation of miR-1307-3p表5 miR-1307-3p表达下调后各组MCF-7细胞迁移能力比较 (n=3,±s)

Tab.5 Comparison of migration ability in MCF-7 cells after the downrgulation of miR-1307-3p表5 miR-1307-3p表达下调后各组MCF-7细胞迁移能力比较 (n=3,±s)
*P<0.05,**P<0.01;a与空白组比较,b与inhibitor control组比较,P<0.05。
组别空白组inhibitor control组miR-1307-3p inhibitor组F 24 h迁移率(%)20.2±3.27 19.4±3.52a 11.2±2.82ab 8.373*48 h迁移率(%)36.3±3.76 40.1±6.52a 25.1±3.46ab 11.1840**
2.8 乳腺癌患者ISM1的表达水平及与病理分期的关系 进一步利用TCGA数据库分析1 085例乳腺癌组织中ISM1的表达水平,发现乳腺癌组织中ISM1的表达水平明显低于正常乳腺组织(P<0.01),见图10A。不同病理分期乳腺癌患者的ISM1表达水平差异有统计学意义,见图10B。进一步分析发现,在乳腺癌患者中ISM1启动子的甲基化水平明显高于正常乳腺组织(P<0.01),见图10C。
3 讨论

Fig.7 The apoptosis of MCF-7 cells after transfection with miR-1307-3p inhibitor analyzed by flow cytometry图7 流式细胞术分析miR-1307-3p沉默表达对MCF-7细胞凋亡的影响
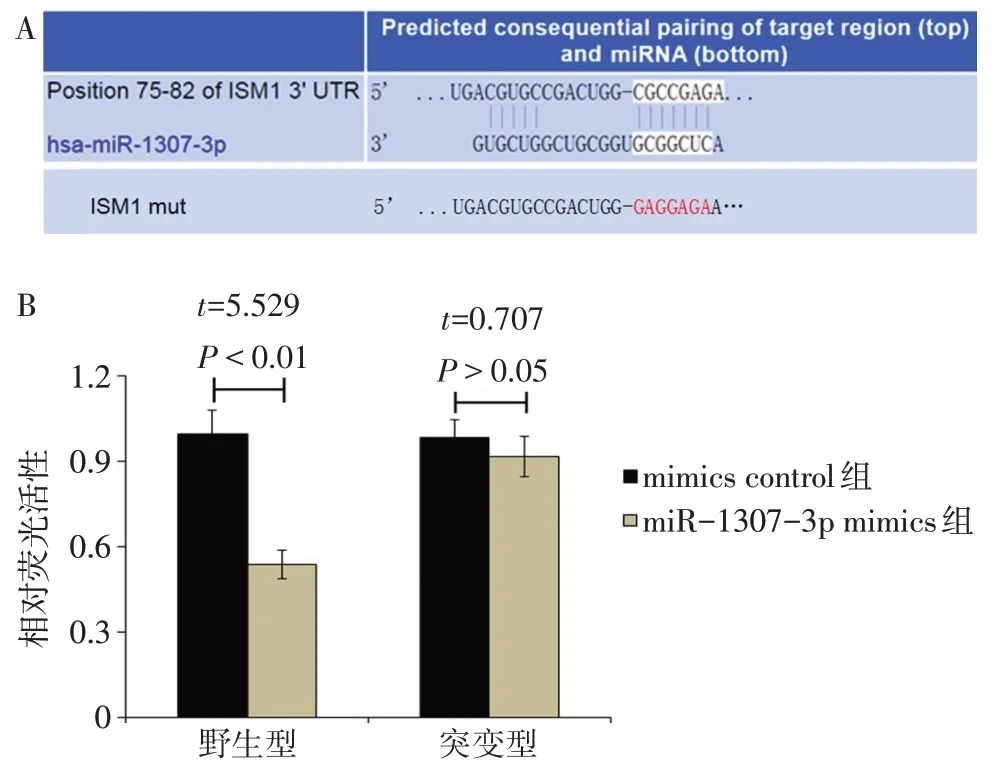
Fig.8 Prediction and validation of the targeting relationship between ISM1 and miR-1307-3p图8 ISM1与miR-1307-3p靶向关系的预测与验证
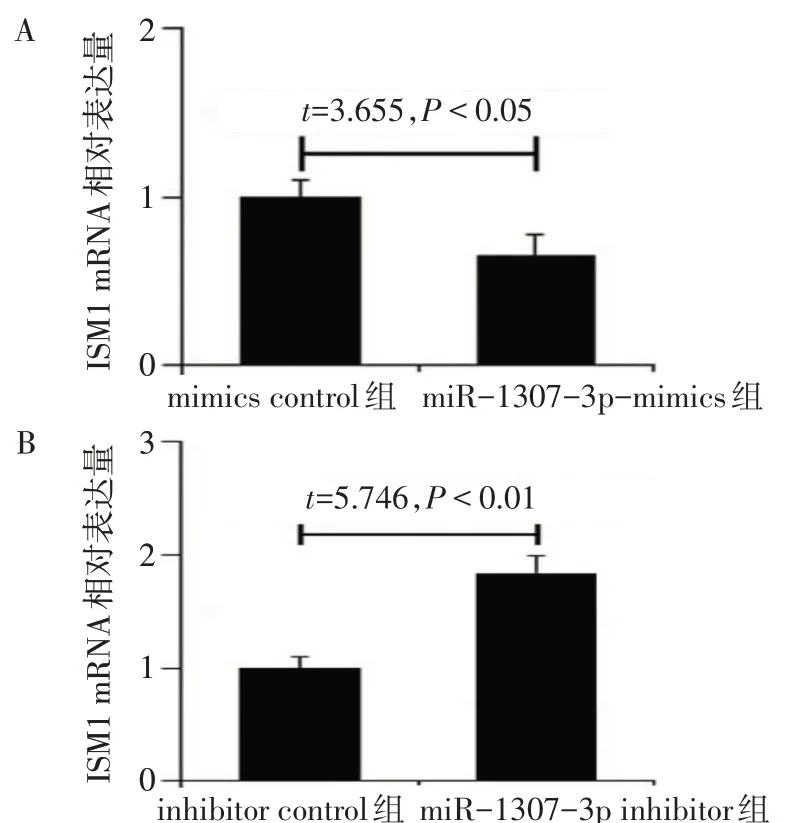
Fig.9 miR-1307-3p regulates the expression of ISM1 gene图9 miR-1307-3p可调控ISM1基因的表达水平

Fig.10 The expression of ISM1 in breast cancer analyzed with TCGA database图10 TCGA数据库分析ISM1在乳腺癌中的表达情况
miRNA是一类长度为18~26 bp的小分子非编码RNA,通过调控基因表达,参与调节细胞增殖、分化、凋亡和代谢等各种生理和病理过程[8-9]。研究表明,miRNAs的异常表达与乳腺癌的发生发展密切相关,参与肿瘤血管形成、转移、侵袭及肿瘤耐药等过程[10]。miR-1307-3p是与癌症相关的miRNA,可促进肿瘤的增殖、转移和化疗耐药[11-13]。研究发现miR-1307-3p的表达水平在乳腺癌患者中显著上调,可用于乳腺癌的早期诊断[14]。本研究发现,TCGA数据库中miR-1307-3p在乳腺癌组织中的表达水平明显上调;进一步研究发现,miR-1307-3p在乳腺癌细胞株中的表达水平也明显升高,并促进乳腺癌细胞的增殖和迁移,miR-1307-3p抑制剂可诱导乳腺癌细胞凋亡,提示miR-1307-3p的异常表达可能与乳腺癌的发生发展有关。然而,利用TCGA数据库分析miR-1307-3p在乳腺癌患者中的表达水平时,却发现有淋巴结转移组的miR-1307-3p水平低于无淋巴结转移组的患者,这与体外实验结果矛盾,由于miR-1307-3p水平是来自数据库中的RNA芯片数据,后续的研究中将进一步收集乳腺癌组织样本,验证miR-1307-3p与淋巴结转移的关系。
目前一般认为miRNA主要通过与靶基因miRNA的3′-UTR互补结合而抑制靶基因的翻译,以调控靶基因的表达水平[15]。为探明miR-1307-3p的作用机制,首先需要寻找其靶基因。本研究通过miRDB、miRWalk、TargetScan预测ISM1的3′-UTR区存在与miR-1307-3p互补结合的位点,并通过双荧光素酶实验证实ISM1是miR-1307-3p的靶基因,与Zheng等[16]报道一致。进一步发现,过表达miR-1307-3p可下调ISM1的表达水平,抑制miR-1307-3p表达则上调ISM1的表达水平。ISM1最初被鉴定为与胚胎发育相关的基因[17]。目前关于ISM1的研究甚少,有研究报道ISM1在胆管癌患者中的水平显著下调[18],ISM1过表达可抑制人脑胶质瘤和小鼠肿瘤的血管生成[19-20],并抑制小鼠乳腺癌和黑色素瘤的生长[21]。也有研究发现,可溶性ISM分子通过激活caspase-8来诱导血管内皮细胞凋亡,而膜结合型ISM则通过激活黏着斑激酶促进血管内皮细胞的存活和迁移[22]。笔者通过TCGA数据库分析发现,ISM1在乳腺癌组织中的表达水平显著下调,且其表达水平与乳腺癌患者病理分期有关。最近有文献报道ISM1是NODAL信号通路的抑制剂[17]。已有研究表明NODAL通路与乳腺癌的进展相关,NODAL可通过激活ERK信号而调控c-myc和P27蛋白水平,最终导致肿瘤形成[23]。
表观遗传调控异常与肿瘤发生发展密切相关。DNA甲基化是较早发现的表观遗传学修饰之一,正常组织中分散存在的CpG通常被甲基化,而转录调控区(如启动子)的CpG岛则呈低甲基化[24]。转录调控区CpG岛的甲基化可招募特异性甲基化结合蛋白,引起DNA构象、染色质结构及稳定性的改变,从而抑制相关基因的转录,导致多种信号通路以及细胞周期、凋亡、DNA损伤和免疫识别等改变。异常DNA甲基化与肿瘤发生有关,有研究报道,卵巢癌和乳腺癌患者中抑癌基因RAS相关区域家族1A(RASSF1A)由于其启动子呈高甲基化而使其表达受抑[25],DNA损伤修复基因谷胱甘肽巯基转移酶P1(GSTP1)启动子区域甲基化异常可缩短肝癌患者生存期[26]。本研究发现,乳腺癌患者中ISM1启动子的甲基化水平明显增强,这与Suman等[27]的研究结果一致,提示乳腺癌患者中ISM1水平下调除了受miR-1307-3p的直接调控外,还可能与其启动子甲基化有关,miR-1307-3p是否涉入其中机制,有待进一步深入研究。
综上所述,miR-1307-3p可通过靶向ISM1而促进乳腺癌细胞增殖和迁移,其中可能涉及ISM1启动子的甲基化、NODAL和ERK信号通路的激活等过程,本研究为明确乳腺癌发生发展机制提供了新思路。
——一道江苏高考题的奥秘解读和拓展

