磷化工“双废”联用工艺研究*
陈 晓,代 典,黄靖宇,范旭阳,艾新帅,潘志权
(1.武汉工程大学 化学与环境工程学院,湖北 武汉 430073;2.武汉工程大学 国家磷资源开发利用工程技术研究中心,湖北 武汉 430073;3.湖北鄂中生态工程股份有限公司,湖北 荆门 448000)
0 引言
磷石膏是湿法磷酸的副产物,产量巨大,已成为我国固废治理难题[1]。由于磷石膏大都露天堆放,其酸性、含磷物质易被雨水冲刷带走而污染周围土地、地下水及河流,危害人类健康[2]。磷石膏组分复杂,除主体二水硫酸钙以外,还含有二氧化硅、铁、铝等杂质和部分影响白度的有机物,常规方法难以对其进行大规模处理。磷尾矿是磷矿采选后的产物,常常作为固体废弃物大量堆存,不仅浪费了钙、镁、磷等有用资源,而且对生态环境造成了破坏[3-4]。磷矿是不可再生资源,磷尾矿的综合利用对磷矿企业的可持续发展具有重大意义[5]。
目前,国内外磷石膏综合利用研究大多集中在将磷石膏预处理之后,通过填充或者改性的方法与其他材料混合制备复合材料[6],如胶凝材料、蒸压砖、磷石膏改性水泥等[7-8]。但此类材料的应用面窄,销售半径小,难以消解巨量堆存的磷石膏[9-11]。目前,磷尾矿的资源化利用主要包括提取钙、镁、磷等有用矿物、回填开采区、生产肥料以及化工产品等,也难以有效处理大量堆存的磷尾矿[12-18]。
本文以磷化工两大固废——磷石膏和磷尾矿为原料,采用硫酸循环酸浸磷尾矿,对循环过程中Ca2+、Mg2+、P2O5在各个阶段的浓度变化情况进行了模拟,并对预处理后的磷石膏进行了碳化成碳酸钙的优化试验,以及对其他有用元素进行了资源化回收利用,为“双废”联用工艺提供了新的可行性方案。
1 试验部分
1.1 试样、试剂及设备
试样与试剂:磷石膏与磷尾矿试样均取自湖北鄂中生态工程股份有限公司。盐酸、硫酸、氨水、碳酸铵均为工业级试剂;柠檬酸、抗坏血酸、三乙醇胺、乙二胺四乙酸二钠(EDTA)、K-B指示剂、乙二醇二乙醚二胺四乙酸(EGTA)、孔雀绿、硝酸钾、酚酞等均为分析纯级检测试剂。
主要设备与仪器:搪玻璃反应罐,三足式离心机,耐腐耐磨料浆泵,X射线荧光光谱仪,X射线衍射仪,能量色散X射线光谱仪(EDX),白度仪,场发射扫描电子显微镜,凯氏定氮仪,循环真空泵,电热恒温鼓风干燥箱,电子天平。
1.2 检测方法
试验过程中钙、镁、磷按照GB/T 1871.4-1995《磷矿石和磷精矿中氧化钙含量的测定 容量法》、GB/T 1871.5-1995《磷矿石和磷精矿中氧化镁含量的测定 火焰原子吸收光谱法和容量法》以及GB/T 1871.1-1995《磷矿石和磷精矿中五氧化二磷含量的测定 磷钼酸喹啉重量法和容量法》测定,氮含量用凯氏定氮仪测定,磷石膏、磷尾矿物相分析用X射线衍射仪测定,全元素分析用X射线荧光光谱仪测定,磷石膏形貌、能谱、元素分布用场发射扫描电子显微镜测定,白度用白度仪测定。
1.3 试验过程
1.3.1 矿物分析前处理
将磷石膏与磷尾矿在阴凉处晾干,用四分法混合均匀,并研磨至粉末状。
1.3.2 磷尾矿分解试验
将磷尾矿投入反应罐中,缓慢泵入工业盐酸,常温搅拌0.5 h,经过离心产生硅渣、二氧化碳以及酸解液。
1.3.3 磷石膏碳化试验
将磷石膏投入另一反应罐中,缓慢泵入氨水,并通入分解磷尾矿产生的二氧化碳,搅拌,离心后得到碳酸钙和硫酸铵溶液。
1.3.4 钙分离试验
将2/3体积酸解液泵入反应罐中,并泵入碳化磷石膏产生的硫酸铵溶液,反应一段时间后离心得到二水石膏和析钙滤液。
1.3.5 酸化试验
将1/3体积酸解液泵入反应罐中,并投入石膏,离心分离后得到半水石膏与转晶液;向转晶液中注入浓硫酸,离心,即可得到酸化二水石膏和酸化滤液;酸化滤液回用于分解磷尾矿。
1.3.6 氮、镁、磷分离试验
向析钙滤液中注入质量分数为25%的氨水,离心得到磷酸铵镁及析磷滤液;析磷滤液直接浓缩生成氯化铵以及浓缩滤液;向浓缩滤液中加入碳酸铵溶液生成碳酸镁以及析镁滤液;析镁滤液回用于析钙滤液进行析磷。整体工艺流程如图1所示。
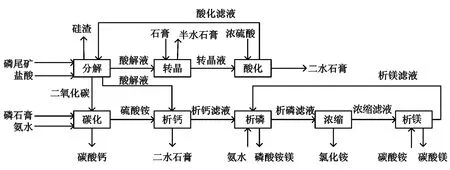
图1 试验工艺流程
2 结果与讨论
2.1 矿物分析
磷石膏呈粉末状,pH约为3,白度16.31%,在40 ℃下自然风干之后,对其化学成分进行分析,结果见表1;物相分析结果如图2所示,其中11.676°、20.755°、23.405°和29.134°为二水石膏的特征衍射峰,除此之外,还含有少量石英。
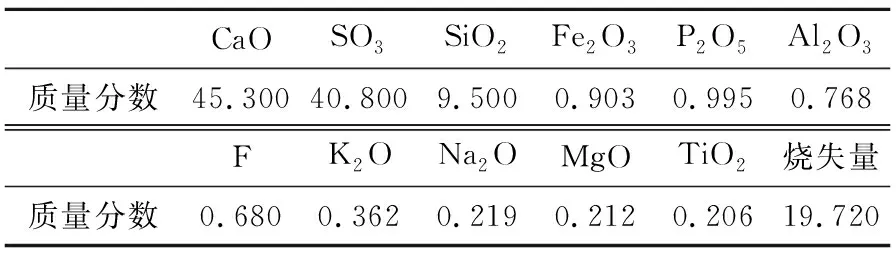
表1 磷石膏化学成分分析结果 单位:%
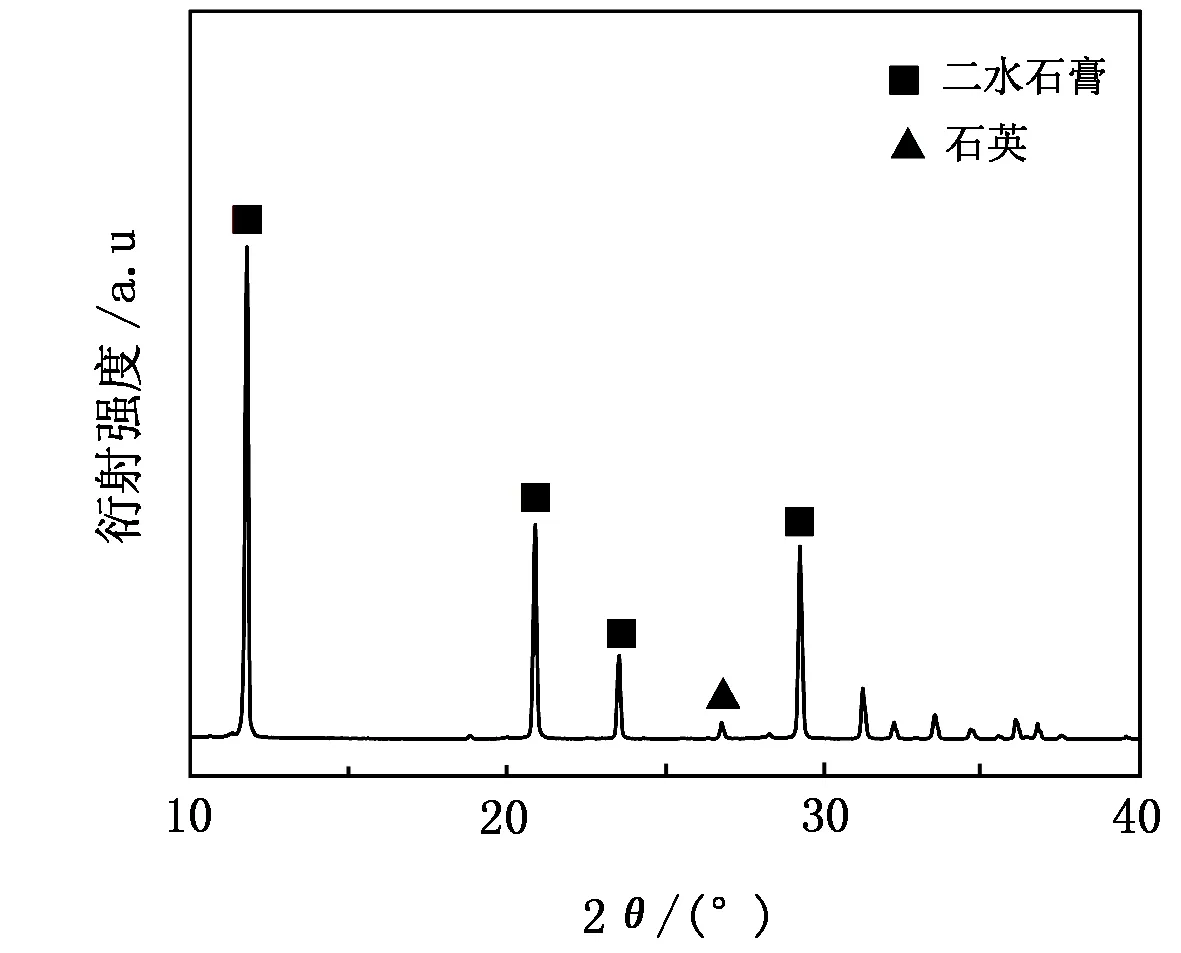
图2 磷石膏的物相分析结果
磷石膏的形貌特征及元素分布如图3所示。从图3a可看出,磷石膏的结晶形态主要呈菱形块状,部分呈长板状或不规则形状;从图3b可看出,部分磷石膏呈聚集态,具有一定致密性,且具有大量不规则的孔径及裂隙;由图3c、图3e、图3f可知,石英在体系中呈不规则分布,随机与石膏混杂;同时,含磷杂质不仅附着于石膏表面,还与石英存在一定的附着关系。这种混杂态的分布关系使得磷石膏在纯化过程中难以与石英及含磷杂质分离。

图3 磷石膏SEM图(a,b)、EDX分析(d)及元素分布(c,e,f)
磷尾矿呈粉末状,深褐色,在40 ℃下自然风干之后,对其化学成分进行分析,结果见表2;物相分析结果如图4所示,其中25.857°、31.923°和33.094°为氟磷灰石的特征衍射峰,30.965°、41.128°、44.932°和51.078°为白云石的特征衍射峰,29.422°为方解石的特征衍射峰,除此之外,还含有少量石英。

表2 磷尾矿化学成分分析结果 单位:%

图4 磷尾矿的物相分析结果
2.2 磷尾矿分解过程中Ca2+、Mg2+、P2O5的浓度变化
在磷尾矿分解过程中,盐酸将磷尾矿中的钙、镁、磷分解于酸解液中,检测酸解液中Ca2+、Mg2+、P2O5的浓度,结果如图5所示。
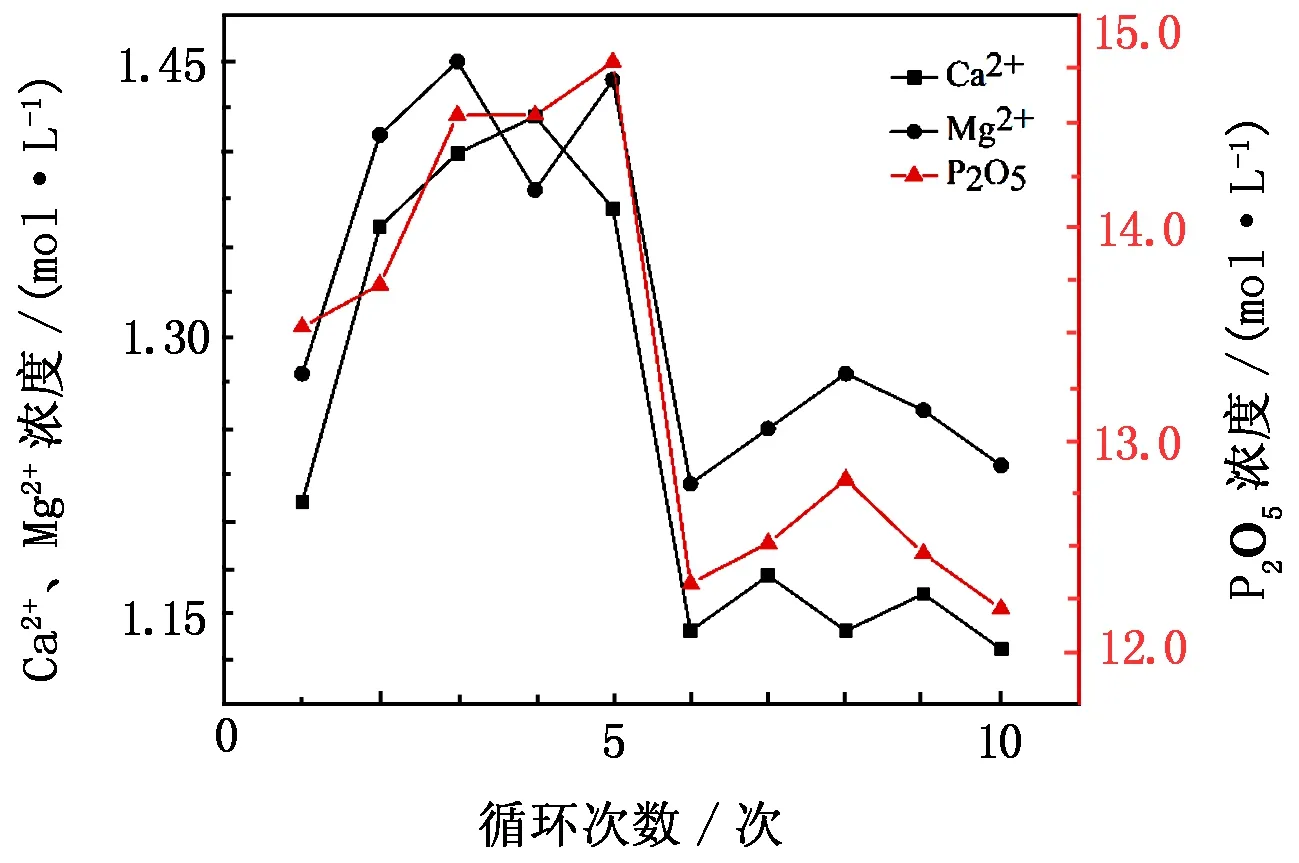
图5 磷尾矿分解过程中Ca2+、Mg2+、P2O5的浓度变化
由图5可以看出,随着循环次数的增加,Ca2+、Mg2+、P2O5的浓度先升高后降低至趋于平稳,Ca2+浓度大致稳定在1.15 mol/L、Mg2+浓度大致稳定在1.25 mol/L、P2O5浓度大致稳定在12.45 mol/L。磷尾矿呈粉末状,与盐酸混合搅拌后充分反应,很快达到反应平衡[19-20]。Ca2+、Mg2+、P2O5的浓度呈上升趋势是因为循环酸解磷尾矿使其中的白云石、氟磷灰石和方解石被分解,有效成分钙镁磷在酸解液中得到了富集。Ca2+、Mg2+、P2O5的浓度呈下降趋势可能是因为回用于分解磷尾矿的酸化滤液中含有少量SO42-以及微溶的CaSO4,磷尾矿分解后产生大量Ca2+,SO42-与Ca2+结合产生CaSO4沉淀,附着于未分解的磷尾矿表面,阻碍了这部分磷尾矿的分解,故液相中的离子浓度略有下降。酸解液经过转晶与酸化后得到的酸化滤液中含有极少量的Ca2+、Mg2+、P2O5,它们对分解磷尾矿的抑制作用不大,因为加入的盐酸体积很大,足以将磷尾矿充分分解,故不考虑同离子效应对分解过程的影响,因此液相中Ca2+、Mg2+、P2O5的浓度随循环次数的增加并不会有太大变化。
2.3 析钙过程中Ca2+、Mg2+、P2O5的浓度变化
在析钙过程中,取2/3体积的酸解液与碳化磷石膏产生的硫酸铵溶液进行反应,生成二水石膏和析钙滤液。分别检测析钙滤液中Ca2+、Mg2+、P2O5的浓度,结果如图6所示。

图6 析钙过程中Ca2+、Mg2+、P2O5的浓度变化
由图6可以看出,随着循环次数的增加,Ca2+、Mg2+浓度稳定、P2O5浓度先升高后降低然后平稳,Ca2+浓度大致稳定在0.19 mol/L、Mg2+浓度大致稳定在0.93 mol/L、P2O5浓度大致稳定在9.75 mol/L,与分解过程相比浓度均有下降。经检测可知,硫酸铵溶液中SO42-的浓度为2.20~2.50 mol/L,且SO42-与Ca2+等摩尔结合,故根据Ca2+的总摩尔量加入等摩尔的硫酸铵,Ca2+几乎全转化为二水石膏析出,因此析钙滤液中的Ca2+保持在低浓度,说明此过程除钙彻底。同时,经检测可知,析钙生成的二水石膏中P2O5质量分数为0.53%、MgO质量分数为0.57%、CaO质量分数为23.38%,说明有少量P2O5和Mg2+附着在二水石膏表面。P2O5的波动趋势与分解过程相似,这是因为此阶段磷并未发生反应,故延续上一阶段的变化情况。
2.4 酸化过程中Ca2+、Mg2+、P2O5的浓度变化
在酸化过程中,向转晶液中加入浓硫酸将体系中的部分Ca2+以CaSO4·2H2O的形式提取出来,检测酸化滤液中Ca2+、Mg2+、P2O5的浓度,结果如图7所示。由图7可知,随着循环次数的增加,Ca2+、Mg2+和P2O5浓度保持平稳,Ca2+浓度约为0.73 mol/L、Mg2+浓度约为1.08 mol/L、P2O5浓度约为11.55 mol/L,与分解过程相比浓度均略有下降。在酸化过程中,浓硫酸的量是根据Ca2+的摩尔量加入的,溶液含有大量SO42-与Ca2+,浓硫酸与绝大部分Ca2+反应生成二水石膏,且CaSO4微溶于水,故滤液中的Ca2+浓度比分解液中的低,在较低浓度保持平稳状态,说明酸化除钙较为彻底。由检测可知,酸化石膏中P2O5质量分数为0.32%,说明酸化生成的二水石膏表面伴有少量P2O5,因此酸化液中的P2O5浓度也比分解液中的低。
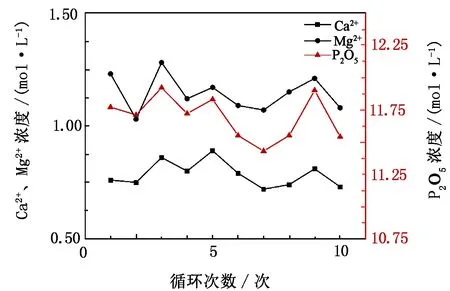
图7 酸化过程中Ca2+、Mg2+、P2O5的浓度变化
2.5 磷石膏碳化过程中CaCO3的产量和转化率的变化
在磷石膏碳化过程中,CaSO4微溶于水,溶液中有少量的SO42-和Ca2+,而通入的CO2气体以CO32-的形式大量存在于溶液中,CO32-与Ca2+生成更难溶的CaCO3沉淀,随着Ca2+浓度的降低,CaSO4的溶解平衡向着溶解的方向移动,最终CaSO4逐渐溶解转化为CaCO3。CaCO3的产量和转化率的变化如图8所示。
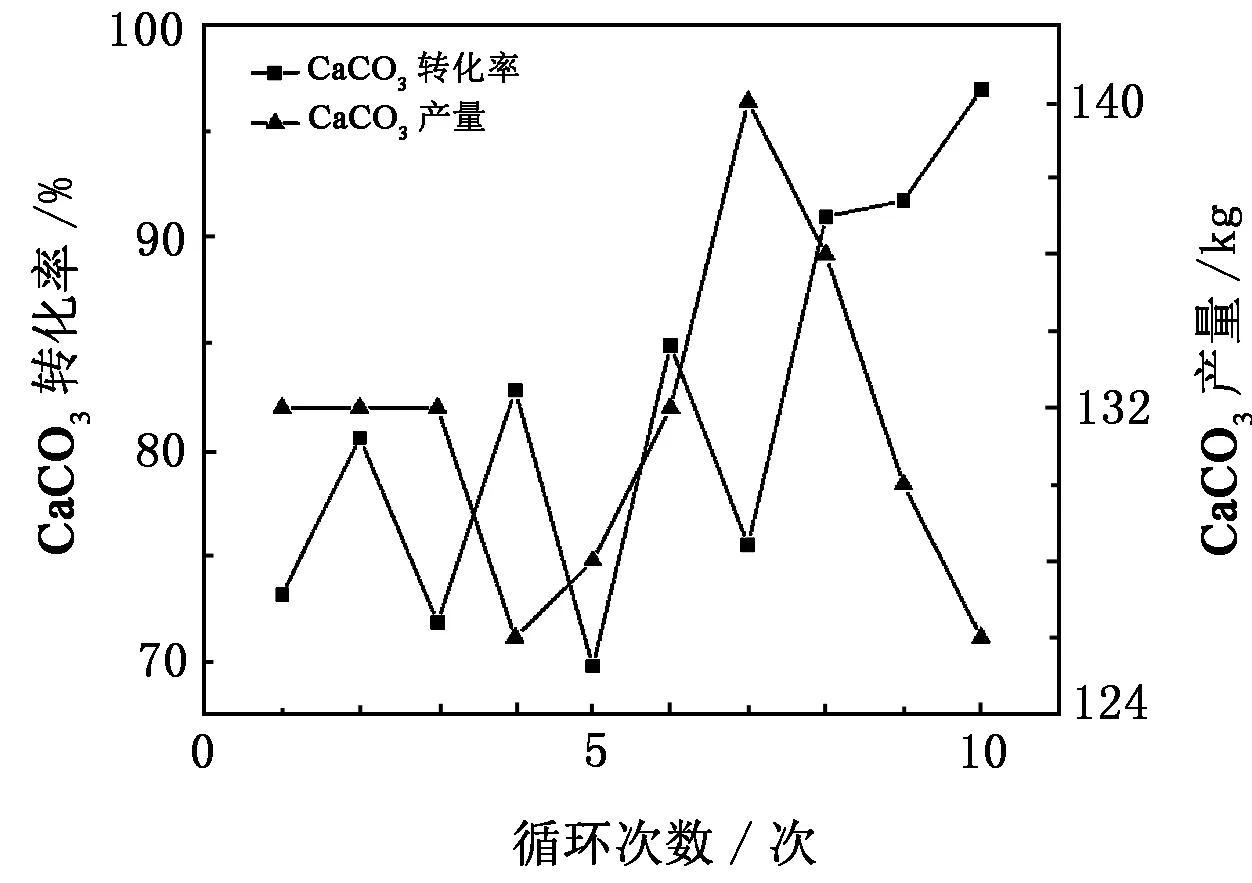
图8 CaCO3产量与转化率的变化
由图8可以看出,加入160 kg磷石膏和160 L氨水,可以产生大约130 kg CaCO3,CaCO3的产量基本稳定,转化率呈上升趋势,最高可达96.94%。此阶段较难控制的部分可能是CO2的通入量,磷尾矿分解时可能产生等量的CO2,但通入到碳化反应罐中时,不能保证全部的CO2都被通入,即使CO2全部被通入,CO2流速也不易控制,溶液pH有差异,这便导致溶液中CO32-的含量不同,从而结合的Ca2+量也不同,转化的程度也不同,因此CaCO3的转化率有一定差异。而且产生的CaCO3可能附着于磷石膏表面,阻碍磷石膏与氨水及二氧化碳充分接触,因此也会影响CaCO3的产量和转化率。
2.6 磷石膏和磷尾矿中有用元素的回收利用
磷石膏和磷尾矿中含有磷、钙、镁等有用元素,试验过程中还引入了氮元素,这些均具有回收价值。后续处理过程中析磷、浓缩、析镁工段的主要产物为MgNH4PO4·6H2O、NH4Cl、MgCO3,可以实现资源的二次利用。产物的主要化学成分分析结果见表3。
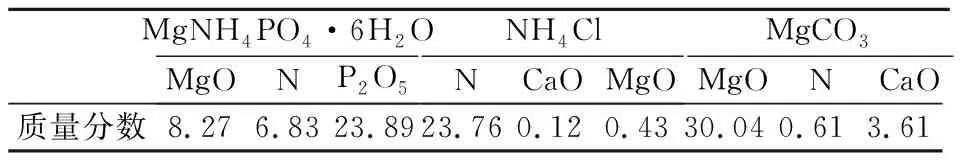
表3 “双废”联用工艺后续产物主要化学成分分析结果 单位:%
MgNH4PO4·6H2O又称鸟粪石,呈淡黄色,无国家标准要求,通常用作氮磷缓释肥料,在农业上具有应用价值。NH4Cl中N的质量分数为23.76%,满足GB/T 2946-2018《氯化铵》中农用氯化铵的氮质量分数要求,该标准对Ca、Mg及其化合物并无要求,可以用作氮肥。MgCO3一般分为轻质碳酸镁和重质碳酸镁:轻质碳酸镁质地疏松,呈白色无定形粉末状,不溶于纯水和有机溶剂,可溶于酸和铵盐溶液,常用于制备搪瓷、陶瓷、耐火坩埚等,还可以用作黏合剂、磨光剂、纸张、涂料等的填料,或是氟橡胶与氯丁橡胶的活化剂与促进剂;重质碳酸镁质地致密,呈白色或米黄色粉末状,易与水结合,常用于玻璃纤维钢、水泥等。本试验产生的碳酸镁为轻质碳酸镁,可用于涂料、阻燃剂等[21]。
3 结论
a.磷尾矿酸解液中Ca2+、Mg2+和P2O5的浓度大致分别稳定在1.15、1.25、12.45 mol/L,析钙滤液中Ca2+、Mg2+和P2O5的浓度大致分别稳定在0.19、0.93、9.75 mol/L,酸化滤液中Ca2+、Mg2+和P2O5的浓度大致分别稳定在0.73、1.08、11.55 mol/L,析钙彻底,数据稳定。磷石膏碳化过程中CaCO3转化率最高可达96.94%。
b.通过分解磷尾矿、碳化磷石膏、转晶、酸化、析钙、析磷、浓缩、析镁等工艺分离提取磷石膏和磷尾矿中的钙、镁、磷,可以生产出二水石膏、半水石膏等建筑材料,磷酸铵镁、氯化铵等农业肥料以及可作为填料、阻燃剂的碳酸镁。本联用工艺无废气产生,废渣也较少,溶液呈闭路循环,有效解决了磷化工“双废”大量堆积对环境造成污染的问题,所得产品在工农业上应用广泛。

