结合网络药理学从JAK2/STAT3信号通路探讨麻杏甘石汤抗流感病毒的效应机制
陈纯静,赵 澄,张香港,王 平,肖 荣,胡 珏,卢芳国,2
(1.湖南中医药大学医学院,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410000)
流行性感冒的病原体是流感病毒,据世界卫生组织最新发布的报道,每年全球有约10亿例流感病例,其中300万~500万为重症病例,导致29万至65万患者死亡[1]。流感病毒属正黏病毒科,病毒基因组为节段性负单链RNA,根据其抗原性和基因序列的不同,分为甲(A)、乙(B)、丙(C)、丁(D)四型。其中,甲型流感病毒(influenza A virus,IAV)是引起人及动物流感的主要病原体[2],多次引起世界范围内的大流行,严重威胁人类健康。研究表明,在流感病毒感染过程中,JAK/STAT信号通路被激活,在病毒介导的免疫病理反应中发挥着重要作用[3]。
中医药预防和治疗流感在临床中发挥着重要的作用。源自《伤寒论》的麻杏甘石汤,由麻黄、杏仁、甘草、石膏配伍而成,具有辛凉宣泄,清肺平喘之功效。我们的前期研究表明,麻杏甘石汤可抑制病毒增殖,并调节细胞因子的分泌,从而发挥抗流感病毒感染作用[4]。本研究以流感病毒肺部感染模型小鼠为研究对象,结合网络药理学探讨JAK2/STAT3信号通路在流感病毒诱导的小鼠肺部炎症中发挥的作用,以及麻杏甘石汤对该通路的调控机制。
1 材料
1.1 动物BLAB/c小鼠100只,SPF级,雌雄各半,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2019-0004,实验单位使用许可证编号:SYXK(湘)2019-0009。本实验已通过湖南中医药大学动物实验中心动物伦理委员会同意。
1.2 病毒株A型流感病毒小鼠肺适应株(A型,IAV,A/PR/8/34),由湖南师范大学病毒研究室惠赠。
1.3 药物麻杏甘石汤组方药材(麻黄、杏仁、石膏、甘草)购自湖南中医药大学第一附属医院中药房。磷酸奥司他韦胶囊(规格:75 mg,以奥司他韦计×10粒,批号M1057,意大利Delpharm Milano S.r.l.生产,上海罗氏制药有限公司分装)购自中南大学湘雅三医院门诊药房,用蒸馏水配制成质量浓度为2.165 g·L-1的混悬液;抗病毒颗粒(规格:9 g×10袋,批号:2001089,四川光大制药有限公司)购自湖南中医药大学附属第一医院门诊药房,用蒸馏水配制成质量浓度为0.39 kg·L-1的溶液。
1.4 试剂兔抗鼠JAK2抗体(Abcam,ab39636)、STAT3抗体(Abcam,ab109085);β-actin抗体(Proteintech,0070175);RNA simple总RNA提取试剂盒(TIANGEN,DP419)、NovoScript cDNA合成试剂盒(Novoprotein,E047-01B)、NovoStartSYBR qPCR Super Mixture(Novoprotein,E096-01A);PCR引物由上海生工生物工程有限公司合成;小鼠IL-1β、IL-4 ELISA试剂盒(Elabscience,E-EL-M0037c,E-EL-M0043c)。
1.5 仪器组织光学扫描显微镜(Axioscope 5)+Axiocam 503 color显微镜摄像头(蔡司科技(苏州)公司);ELX-800多功能酶标仪(美国Bio-Tek公司);LightCycler96荧光定量PCR仪(瑞士罗氏公司)。
2 方法
2.1 麻杏甘石汤治疗流感病毒感染的潜在靶点的筛选设置口服生物利用度(OB)≥30%、类药性(DL)≥0.18,利用中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)检索麻黄、苦杏仁、甘草的主要活性化合物,并查询筛选主要活性化合物的作用靶点,该数据库未检索到的矿物药“石膏”采用文献研究方法查阅其主要活性化合物及靶点[5];以“Influenza A virus”为关键词,分别通过GeneCards(https://genecards.weiz-mann.ac.il/v3/);OMIM(https://omim.org/);PharmGkb(https://www.pharmgkb.org/);TTD(http://db.idrblab.net/ttd/);DrugBank(https://www.drugbank.ca/)数据库筛选获得IAV作用于人体的相关靶点;通过R4.0.3软件将各数据库获取的靶点进行合并并去除重复靶点。运用R4.0.3软件对麻杏甘石汤主要活性成分调控的靶点与流感病毒的疾病靶点取交集。
2.2 KEGG通路富集分析利用R4.0.3软件对交集靶点进行KEGG通路富集分析。
2.3 制备麻杏甘石汤水煎液根据《方剂学》和《中药药理学》中麻杏甘石汤的药物组成、剂量、制备方法制备该方水煎液,按其组成比例精确称量麻杏甘石汤1剂的药材量,加入10倍体积蒸馏水后煮沸,改小火后再煎煮30 min,煎煮完毕后滤过;二煎加入7倍体积蒸馏水,煮沸后再煎煮2 0 min,煎煮完毕后滤过,合并2次滤液,水浴浓缩至含生药605 g·L-1。
2.4 分组与给药100只BLAB/c小鼠适应性喂养2 d后,随机将小鼠分为正常对照组、模型对照组、奥司他韦组(西药对照组)、抗病毒颗粒组(中药对照组)和麻杏甘石汤组,每组20只小鼠。除正常对照组外,其余组建立A型流感病毒肺部感染模型。感染24 h后,各药物组按临床等效剂量灌胃给药,每天1次,每次0.2 mL,连续给药3、7 d。奥司他韦、抗病毒颗粒、麻杏甘石汤组的给药剂量分别为0.0216、3.9、6.05 g·kg-1·d-1。对照组和模型组均给予等量生理盐水。
2.5 标本采集分别于给药治疗d 3、7,将小鼠禁水禁食8 h后,每组随机选取10只小鼠,称动物体质量后,摘眼球放血法处死小鼠,转移至超净工作台内进行解剖,取出小鼠肺脏,用生理盐水冲洗脏器表面血迹,用滤纸吸干后称取小鼠肺脏质量,取部分肺组织置于4%多聚甲醛中固定,部分肺组织置于1.5 mL EP管中,冻存于-80 ℃超低温冰箱备用。
2.6 指标检测
2.6.1体质量及肺指数 肺指数(mg·g-1)=肺脏质量(mg)/体质量(g)
2.6.2肺组织病理变化情况 取出固定于4%多聚甲醛中24 h的肺组织,经石蜡包埋、切片(5 μm)、二甲苯脱蜡、梯度酒精脱水后进行HE染色,在光学显微镜下(×100)观察肺组织病理变化。
2.6.3RT-PCR法检测肺组织中JAK2、STAT3、IL-1β、IL-4mRNA的表达水平 取出-80 ℃保存的肺组织,按照总RNA提取试剂盒说明书提取各组样品的总RNA,去DNA后逆转录合成cDNA。以cDNA做模板,按NovoStartSYBR qPCR Super Mixture试剂说明,分别加入β-actin、JAK2、STAT3、IL-1β、IL-4引物进行扩增,引物序列见Tab 1。PCR反应体系为20 μL,反应体系含cDNA 2 μL,NovoStartSYBR qPCR Super Mixture 10 μL,10 μmol·L-1上下游引物各2 μL,以dd H2O补足至20 μL。反应条件:95 ℃ 1 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 30 s,40个循环;95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s绘制熔解曲线。采用2-ΔΔCt法计算目的基因相对表达量。

Tab 1 Primer sequences for RT-PCR
2.6.4Western blot法检测肺组织中JAK2、STAT3蛋白的表达水平 取出-80 ℃保存的肺组织,加入适量细胞裂解液与蛋白酶抑制剂,使用组织研磨器进行组织匀浆,冰上静止30 min后离心,提取上清液中组织总蛋白质,应用BCA法测定蛋白浓度,取40 μg总蛋白上样,进行SDS-PAGE电泳,转膜后,封闭处理1 h,分别加入JAK2一抗(1 ∶1 000)、STAT3一抗(1 ∶2 000)、β-actin(1 ∶10 000),4 ℃孵育过夜,二抗(1 ∶5 000)室温孵育1 h,避光显影。
2.6.5ELISA法检测肺组织IL-1β、IL-4分泌水平 取出-80 ℃保存的肺组织,加入一定量PBS及蛋白酶抑制剂,使用组织研磨器进行组织匀浆,离心后取上清液,分装保存,按照ELISA试剂盒说明书进行操作,检测肺组织中IL-1β、IL-4分泌水平。
2.7 分子对接查询STAT3所对应的麻杏甘石汤活性化合物为甘草查尔酮A(licochalcone a),从PubChem(https://pubchem.ncbi.nlm.nih.gov)数据库下载其sdf格式化合物,用ChemBio3DUltra 14.0.0.117软件进行3D结构转换。从PDB数据库(http://www.rcsb.org)下载STAT3的晶体结构,利用PyMOL2.4软件删除水分子,添加氢等预处理,利用AutoDock Tools1.5.6可视化软件确定STAT3的活性口袋,利用AutoDock Vina1.1.2软件进行分子对接。
2.8 统计学分析采用SPSS 24.0统计软件进行数据分析,多组样本间比较采用单因素方差分析(One-way ANOVA),方差齐时,用LSD进行多重比较,方差不齐采用Kruskal-Wallis秩和检验。
3 结果
3.1 麻杏甘石汤治疗流感病毒感染的潜在靶点筛选按照OB≥30%、DL≥0.18的条件,通过TCMSP数据库及文献查阅筛选麻杏甘石汤主要活性化合物,并查询主要活性化合物调控的靶点信息,共筛选出对应的作用靶点共2 124个,去除重复后共234个。分别在GeneCards、OMIM、DrugBank、PharkGkb、TTD数据库中检索流感病毒作用于人体的潜在靶点,去掉重复得到2 089个流感病毒相关靶点。运用R4.0.3软件将麻杏甘石汤主要活性成分调控的靶点与流感病毒的疾病靶点取交集,得到110个共同靶点,即麻杏甘石汤治疗流感病毒感染的潜在靶点,见Fig 1。
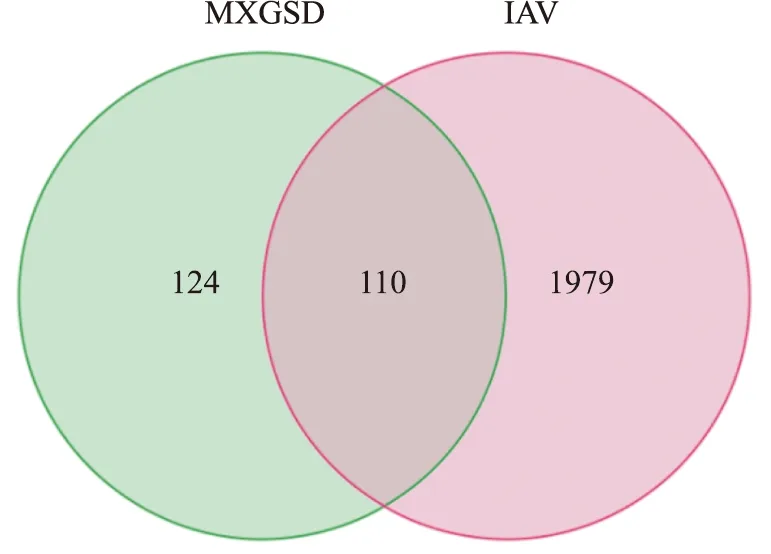
Fig 1 Venn plot of intersection target of Maxing Ganshi Decoction and influenza virus
3.2 潜在靶点KEGG通路富集分析通过R语言对110个潜在靶点进行KEGG分析,发现交集靶点共富集于170条信号通路,主要与病毒或病原微生物感染、各细胞因子介导的信号转导通路有着密切联系。根据P值大小进行排名,前三位分别是AGE-RAGE、Hepatitis B、Kaposi sarcoma-associated herpesvirus infection信号通路。根据富集的靶点数目排名,最多的为Hepatitis B、Kaposi sarcoma-associated herpesvirus infection、Human cytomegalovirus infection 3条信号通路,均富集31个靶点。本研究展示了富集靶点数目排名前三的信号通路,见Tab 2。结合本课题组前期基础,本研究主要探讨JAK/STAT信号通路在流感病毒感染过程中发挥的作用以及麻杏甘石汤调控作用。根据P值大小,JAK/STAT信号通路在170条信号通路中排名84位,P=0.000 000 470 7,富集13个靶点,见Fig 2。

Fig 2 Potential targets of MXGSD on JAK/STAT signaling pathway

Fig 3 Pathological observation of lung tissues of mice in each group after 3 (upper)and 7 (lower)days of administration (HE,100 ×)
3.3 体质量及肺指数由Tab 3得知:给药治疗3、7 d后,模型对照组小鼠体质量较正常对照组降低(P<0.05或0.01);给药治疗3 d后,奥司他韦组、抗病毒颗粒组、麻杏甘石汤组体质量较模型对照组升高(P<0.05或0.01);给药治疗7 d后,奥司他韦组体重较模型对照组升高(P<0.05),抗病毒颗粒组、麻杏甘石汤组体重较模型组有升高趋势,但差异无统计学意义。由Tab 4得知:给药治疗3、7 d后,模型对照组小鼠肺指数较正常对照组升高(P<0.01);给药治疗3 d后,奥司他韦组、抗病毒颗粒组、麻杏甘石汤组肺指数较模型对照组降低(P<0.05或0.01);给药治疗7 d后,奥司他韦组、麻杏甘石汤组肺指数较模型对照组降低(P<0.05),抗病毒组肺指数较模型对照组有降低趋势,但差异无统计学意义。

Tab 2 Top three signaling pathways in number of KEGG targets

Tab 3 Comparison of body weight and weight inhibition rate in each group n=10)

Tab 4 Comparison of lung index and inhibition rate in each group of mice n=10)
3.4 肺组织病理变化由Fig 3得知,与正常对照组比较,模型对照组小鼠肺组织出现明显病理变化,表现为肺泡充血水肿,大量炎性细胞浸润,并出现实变及坏死。与模型对照组比较,各药物组小鼠肺部病理损伤明显改善,肺泡轮廓恢复正常,充血水肿减轻,炎性细胞浸润减少。
3.5 肺组织中JAK2、STAT3、IL-1β、IL-4 mRNA的表达水平由Tab 5得知,给药治疗3、7 d后,与正常对照组相比,模型对照组JAK2、STAT3、IL-1β表达量增加(P<0.01),IL-4基因相对表达量降低(P<0.01);与模型对照组相比,给药治疗3 d后,各药物组JAK2、IL-1β表达量降低(P<0.01),IL-4表达量增加(P<0.01),抗病毒颗粒组和麻杏甘石汤组STAT3表达量降低(P<0.01);给药治疗7 d后,抗病毒颗粒组和麻杏甘石汤组JAK2表达量降低(P<0.01),各药物组STAT3、IL-1β表达量降低(P<0.01),IL-4表达量增加(P<0.01)。
3.6 肺组织中JAK2、STAT3蛋白的表达水平由Fig 4、5得知,给药治疗3、7 d后,与正常对照组相比,模型对照组JAK2、STAT3蛋白表达量增加(P<0.01或P<0.05);与模型对照组相比,各药物组JAK2蛋白表达量降低(P<0.01)。给药治疗3 d后,与模型对照组相比,各药物组STAT3蛋白表达量降低(P<0.01)。给药治疗7 d后,与模型对照组相比,奥司他韦组STAT3蛋白表达量降低(P<0.05),其余两药物组STAT3蛋白表达水平无明显差异。

Fig 4 Expression level of JAK2 protein in lung tissues of mice in each group n=3)A.Control;B.Model;C.Oseltamivir;D.Antiviral particle;E.MXGSD.**P<0.01 vs control group;##P<0.01 vs model group.

Fig 5 Expression level of STAT3 protein in lung tissues of mice in each group n=3)A.Control;B.Model;C.Oseltamivir;D.Antiviral particle;E.MXGSD.**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.
3.7 肺组织IL-1β、IL-4分泌水平由Tab 6得知,给药治疗3、7 d后,与正常对照组相比,模型对照组肺组织匀浆中IL-1β表达量增加(P<0.01),IL-4表达量降低(P<0.01)。与模型对照组相比,给药治疗3 d后,抗病毒颗粒组和麻杏甘石汤组肺组织匀浆中IL-1β表达量降低(P<0.01),给药治疗7 d后,奥司他韦组与抗病毒颗粒组肺组织匀浆中IL-1β表达量降低(P<0.01),麻杏甘石汤组也较模型对照组降低,但差异无统计学意义。与模型对照组相比,给药治疗3 d后,奥司他韦组和麻杏甘石汤组肺组织匀浆中IL-4表达量增加(P<0.01),给药治疗7 d后,各药物组肺组织匀浆中IL-4表达量均增加(P<0.01)。

Tab 5 Relative expression of JAK2,STAT3,IL-1 β and IL-4 genes in lung tissues of mice in each group (2-△△Ct) n=3)

Tab 6 Levels of IL-1β and IL-4 in lung tissues of mice in each group n=3)
3.8 STAT3与麻杏甘石汤活性成分分子对接结果根据文献报道[6],化合物和靶标之间的结合自由能<-5 kcal·mol-1被认为具有较好的结合作用。本研究查询STAT3所对应的麻杏甘石汤小分子配体为甘草查尔酮A(licochalcone A),通过PubChem数据库及ChemBio3D Ultra软件得到甘草查尔酮A的3D结构。从PDB数据库下载STAT3的晶体结构,PDB ID为:6njs。利用AutoDock Tools1.5.6可视化软件确定STAT3的活性口袋,活性口袋网格中心的坐标为:x=-2.257,y=19.47,z=24.491。借助AutoDock Vina1.1.2软件,对STAT3与甘草查耳酮A(licochalcone A)进行分子对接,结果显示,两者的结合能为-6.3 kca·mol-1,表明STAT3与药物有较好的结合活性,见Fig 6。本研究还对西药阳性对照药物奥司他韦与STAT3进行了分子对接,结果显示,两者之间的最小结合自由能为-3.9 kcal·mol-1,意味着两者无很好的结合活性。

Fig 6 Schematic diagram of molecular dockingbetween STAT3 and licochalcone A
4 讨论
众所周知,病毒感染初期,机体固有免疫系统被激活,肺部炎症细胞募集,产生炎性细胞因子和趋化因子参与机体免疫应答,发挥抗病毒作用。但在流感病毒持续感染或重症感染的过程中,免疫系统持续激活,导致免疫应答反应过度,免疫稳态失衡,进而释放大量炎症因子,诱导细胞因子的级联放大效应,形成“细胞因子风暴”,出现肺部免疫病理损伤,引起弥漫性肺泡损伤、透明膜形成、纤维蛋白渗出等。“细胞因子风暴”导致的急性肺损伤被认为是流感病毒感染致死的主要原因[7]。目前,关于流感病毒感染后发生“细胞因子风暴”的机制尚未完全阐明,有研究发现,甲型流感病毒感染后,宿主细胞内STAT、NF-κB等多条信号通路激活,导致IL-1β、IL-6、IL-18等炎症因子的过度表达,且炎症因子的水平与疾病的严重程度呈正相关,提示相关信号通路的激活及下游效应分子的分泌可能在流感“细胞因子风暴”的发生中起到一定作用[8]。JAK/STAT信号转导通路是多种细胞因子发挥作用的重要信号通路之一,参与许多重要生理反应过程,与“细胞因子风暴”的发生密切相关[9]。JAK2作为Janus激酶家族成员之一,广泛存在于各种组织和细胞中,其下游效应分子为STAT3,STAT3被JAK2磷酸化后发生二聚化,然后穿过核膜进入核内调节相关基因的表达。JAK2/STAT3信号通路在免疫调节和多种炎症过程中发挥着重要的作用。有研究发现,JAK2过表达可促进H5N1流感病毒的复制,而特异性抑制JAK2表达后,病毒复制减轻,JAK2可能成为抗流感病毒治疗的潜在靶点[10]。
在流感病毒感染的小鼠肺组织中,JAK2、STAT3基因表达水平及蛋白表达量较正常小鼠均增加,说明机体JAK2/STAT3信号通路被激活,在流感病毒导致的肺部炎症中发挥着一定的作用。在数据库中筛选流感病毒的靶点时,物种为“Homo”即人类,我们进行动物验证实验的对象为小鼠,通过NCBI对人和小鼠的JAK2、STAT3蛋白序列进行查找及blast比对,其一致性分别为93.58%、99.48%(E value=0.0)。同时,本课题组还检测了IL-1β、IL-4两种炎症因子,发现与正常对照组相比,模型对照组肺组织匀浆中IL-1β表达量增加,而IL-4表达量降低。IL-1β是感染过程中的关键细胞因子,具有广泛的促炎活性,能够活化多种炎症细胞,介导炎症介质、趋化因子的释放[11]。IL-4可抑制TNF-α和IL-6等炎症因子的表达,是一种重要的免疫调节细胞因子。本研究结果提示,JAK2/STAT3信号通路在流感病毒诱导小鼠肺部炎症的发病机制中有着重要的作用,其机制可能是该信号通路激活后下游细胞因子的表达水平发生变化,免疫稳态失衡,促炎因子增多,进而引起炎症反应。在早期干预该信号通路的激活,可以有效减轻肺部免疫病理损伤。
中药在流感防治中发挥着重要的作用。麻杏甘石汤组方精当,疗效显著,为历代医家所重视。现代研究表明,麻杏甘石汤具有较好的解热、抗炎、抗病毒等作用,对甲型H1N1流感有很好的疗效[12]。国家卫生健康委员会发布的2018-2020版《流行性感冒诊疗方案》中,均将该方作为中医热毒袭肺证的基础治疗方[13]。有研究表明,麻杏甘石汤可减轻哮喘大鼠气道炎症反应,其机制可能与STAT4及IL-13/STAT6/黏蛋白途径有关[14]。本研究发现,临床等效剂量麻杏甘石汤能够下调流感病毒感染的小鼠肺组织中JAK2、STAT3基因表达和蛋白表达水平,降低肺组织中IL-1β分泌水平,增加IL-4分泌水平,改善肺部炎症。提示该方可通过抑制流感病毒诱导的JAK2/STAT3信号通路的激活,调节炎症因子表达,以抵抗流感病毒感染导致的急性肺损伤。我们查询了核心靶点STAT3所对应的麻杏甘石汤活性化合物,结果显示,麻杏甘石汤中与STAT3具有结合作用的活性化合物为甘草查尔酮A。分子对接结果表明,二者之间的结合能为-6.3 kcal·mol-1,具有较好的结合活性。甘草查尔酮A来源于甘草,属于麻杏甘石汤方中佐使药,既能益气和中,又能防止石膏寒凉伤中,调和于寒温宣降之间。研究发现,甘草查尔酮A具有明显的抗炎活性,可通过调节相关信号通路来抑制骨关节炎和类风湿性关节炎的发生发展[15],我们的研究为阐明甘草查尔酮A的抗炎机制及丰富其临床应用提供了一定的启发。同时,我们对西药阳性对照药物奥司他韦与STAT3进行了分子对接,两者之间的最小结合自由能为-3.9 kcal·mol-1,无很好的结合活性。奥司他韦属于神经氨酸酶抑制剂,可通过抑制流感病毒的复制及播散,发挥抗流感效应。我们的实验结果表明,麻杏甘石汤可通过调节宿主相关信号通路,缓解流感病毒引起的炎症因子失衡。这也是对中医药“整体观”的一种体现,整体观讲究免疫平衡,流感的发生不仅是“外邪”的入侵,也与机体本身的免疫状态密切相关,麻杏甘石汤通过调节机体的免疫平衡,维护免疫稳态,在此过程中,甘草查尔酮A作为其有效的物质基础,通过结合STAT3,发挥抗炎作用。同时我们还发现,麻杏甘石汤对JAK2也具有一定的调节作用,这与网络药理学的结果并不完全一致。
综上所述,本研究初步奠定了JAK2/STAT3信号通路在流感病毒感染导致的肺部炎症中的地位,并证实麻杏甘石汤通过抑制该信号通路的激活,减轻肺部炎症,为中医药防治流感提供了一定的数据支持。但本研究尚存在诸多不足,例如在药物剂量方面,我们目前选取的是临床等效剂量,实验结果表明,该剂量的麻杏甘石汤对JAK2/STAT3信号通路具有一定的作用,但这种作用是否具有量-效关系还有待进一步的研究,量-效关系的研究将有助于指导临床给药剂量的优化。此外,在进行相关指标基因及蛋白表达水平的检测时,选取的样本数目较少,后期在进行量-效关系的验证时,我们将会进一步加大样本量,以增强实验结果的可信度。