二十二碳六烯酸对注意缺陷多动障碍儿童临床疗效、血清胶质源性神经营养因子及炎症因子水平的影响
乔娟,熊子珺,苏邹,陈红源
注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)是我国儿童常见的神经发育障碍性疾病之一,主要表现为注意集中困难、注意持续时间短暂、活动过度或冲动。ADHD的病因十分复杂,而二十二碳六烯酸(DHA)缺乏可能是ADHD儿童发病的危险因素。有研究发现,ADHD患儿外周血红细胞膜中DHA水平显著低于健康儿童[1],且40%的ADHD患儿存在着口渴/皮肤干燥症状,此症状与DHA缺乏症表现一致[2]。目前,治疗ADHD的一线药物为中枢神经兴奋剂盐酸哌甲酯。虽然盐酸哌甲酯能显著改善ADHD的核心症状,但也存在有效剂量个体差异大、易复发及认知功能缺陷等缺点[3]。为了减少盐酸哌甲酯的不良反应,并改善ADHD儿童的认知功能,DHA常作为增效剂在ADHD儿童治疗中广泛运用,但研究结果存在争议。Crippa等[4]发现,单用DHA(500 mg/d)6个月后能改善ADHD儿童的行为和认知障碍。而Cornu等[5]认为3个月DHA联用二十碳五烯酸(EPA)并不能改善ADHD患儿的临床症状。神经营养因子是一类对神经元的发育、存活和凋亡起重要作用的蛋白质,其中胶质源性神经营养因子(glial-derived neurotrophic factor,GDNF)的水平与ADHD的诊断及治疗有密切的关系[6]。本研究给予ADHD儿童口服DHA,观察DHA对患儿临床疗效、血清GDNF水平的影响。
1 对象和方法
1.1 对象
为2017年10月至2019年10月在湖北省武汉市武东医院门诊首次诊断的ADHD患儿,合计132例。纳入标准:①符合美国《精神障碍诊断与统计手册》第5版(DSM-5)儿童ADHD诊断标准;②未接受抗精神病药治疗;③韦氏儿童智力量表第4版(WISC-IV)智商>80。排除标准:①盐酸哌甲酯禁忌证;②有癫痫、抽动症等共患疾病;③对水产品过敏;④精神发育迟滞及严重精神神经疾病。本研究方案已获得监护人知情同意及本院医学伦理委员会审批。
1.2 方法
1.2.1 研究方法 利用随机数字表,将132例ADHD儿童随机分为对照组和研究组。所有ADHD儿童均给予盐酸哌甲酯控释片治疗,剂量为18~36 mg/d。研究组加用含300 mg/d DHA的软胶囊,对照组加用空白安慰剂,两组均治疗8周。
1.2.2 临床指标检测 ①注意缺陷多动障碍SNAP-IV评定量表(中文版)(SNAP-IV):量表共26个条目,每个条目采用4级评分法(0~3分)。该量表分为3个分量表:注意缺陷量表、多动冲动量表、对立违抗量表。分数越高说明症状越严重。量表由患儿家长独立填写,在治疗前及治疗8周后分别记录一次。②美国康纳简易多动症行为评价量表(Conner):共48个条目,每个条目采用4级评分法(0~3分)。该量表主要评价患儿的身心障碍、多动冲动、品行、焦虑、学习及多动指数。分数越高,说明症状越严重。③不良反应:记录两组患儿治疗过程中食欲下降、睡眠障碍、头痛头晕、恶心的发生率。
1.2.3 实验指标检测 所有研究对象于入组次日及治疗8周后当日清晨,分别空腹静脉取血5 ml,3 000 r/min离心10 min。超高效液相色谱-串联质谱(UPLC-MS/MS)法测定患儿血浆中DHA水平;血清中胶质源性神经营养因子(GDNF)、白介素1β(IL-1β)、白介素6(IL-6)、肿瘤坏死因子α(TNF-α)水平采用武汉赛维尔生物公司的ELISA试剂盒测定。
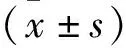
2 结果
2.1 两组基线资料比较
对照组:男45例,女21例;年龄6~12岁,平均(11.27±4.32)岁;病程12~36个月,平均(18.35±5.69)个月;其中注意缺陷型32例,多动/冲动型7例,混合型27例。研究组:男47例,女19例;年龄6~12岁,平均(10.38±3.62)岁;病程12~36个月,平均(17.92±4.37)个月;其中注意缺陷型34例,多动/冲动型8例,混合型24例。两组在性别、年龄、病程、及临床分型上比较差异均无统计学意义(P均>0.05)。
最终118例ADHD儿童完成研究。其中对照组因药物疗效不佳脱落6例,失访2例,实际完成58例;研究组因经济原因脱落4例,药物疗效不佳脱落2例,实际完成60例。
2.2 两组SNAP-IV评分比较
两组治疗8周后SNAP-IV总分、注意缺陷分、多动/冲动分、对立违抗分较治疗前降低;研究组SNAP-IV总分、注意缺陷分下降幅度显著高于对照组,差异均有统计学意义(P<0.05或P<0.01)。见表1。

表1 两组SNAP-IV评分比较
2.3 两组Conner评分比较
经8周治疗后,两组Conner中学习、品行、心身、冲动、焦虑、多动指数评分较治疗前降低,两组学习、心身、多动指数评分下降幅度差异有统计学意义(P<0.05或P<0.01)。见表2。

表2 两组Conner评分比较
2.4 两组实验室指标比较
经8周治疗后,研究组血浆中DHA水平显著高于对照组及治疗前;血清中GDNF水平显著高于对照组及治疗前,而IL-6、TNF-α水平显著低于对照组及治疗前,差异均有统计学意义(P<0.05或P<0.01)。见表3。

表3 两组实验室指标水平比较
2.5 两组不良反应发生率比较
两组食欲下降、睡眠障碍、头痛、头晕、恶心发生率比较,差异均无统计学意义(P均>0.05)。见表4。
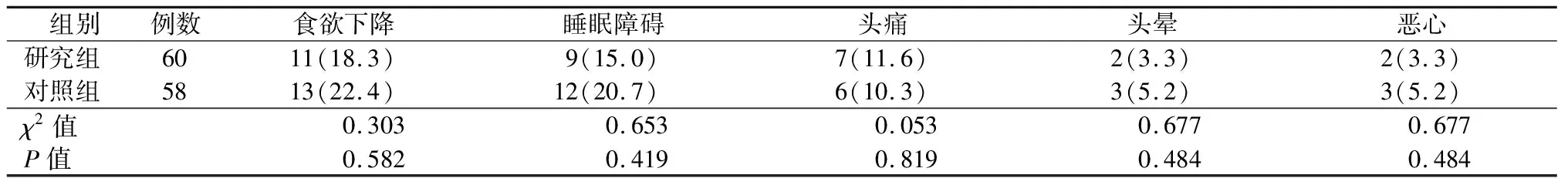
表4 两组不良反应发生率比较(例数,%)
2.6 相关性分析
将研究组治疗前后DHA、GDNF、IL-6、TNF-α水平差值分别记为ΔDHA、ΔGDNF、ΔIL-6、ΔTNF-α;研究组治疗前后SNAP-IV总分、注意缺陷分、多动/冲动分、对立违抗分差值分别记为ΔSNAP-IV总分、Δ注意缺陷分、Δ多动/冲动分、Δ对立违抗分。研究组ΔDHA与ΔSNAP-IV总分呈负相关(r=-0.326,P=0.037);ΔGDNF与Δ注意缺陷分(r=-0.318,P=0.025)、Δ多动/冲动分(r=-0.407,P=0.031)及ΔTNF-α(r=-0.297,P=0.041)呈负相关。
3 讨论
ADHD是一种慢性神经发育障碍性疾病。由于DHA在神经及大脑的发育中有重要作用,因此DHA能否作为药物增效剂来改善ADHD的症状,引起学者们广泛的兴趣。本研究发现,经8周DHA联合治疗后,研究组血浆DHA水平显著高于对照组,两组SNAP-IV总分、注意缺陷分、Conner中学习、心身、多动指数评分差异具有统计学意义,此结果与Milte等[7]、Crippa等[4]比较一致,均认为DHA能改善ADHD儿童的临床症状。但也有学者认为,补充Omega-3/6多不饱和脂肪酸并不能改善ADHD儿童的Conner评分,对ADHD的治疗并无帮助[8]。由于研究对象的性别、年龄、人种及处理因素(Omega-3/6多不饱和脂肪酸、Omega-3多不饱和脂肪酸、DHA)的不同,可能是导致研究结论不一致的主要原因。此外,研究对象可能还有其他共患病,补充营养制剂的时间长短也是影响结论的重要因素。
多巴胺系统缺陷是ADHD病理生理基础之一。GDNF是一种神经营养因子,对神经发育(尤其是多巴胺神经元)有特异性营养及神经保护作用。临床研究发现,ADHD儿童血清中GDNF水平显著低于健康儿童[9]。动物实验发现,ADHD大鼠海马、纹状体和前额叶皮质中GDNF水平显著低于正常对照组[10]。益智宁神颗粒均能通过促进自发性高血压(SHR)大鼠大脑中GDNFmRNA的表达,来减轻海马多巴胺神经元损伤,最终改善ADHD症状[11]。GDNF可能是改善ADHD的重要靶点。体外细胞实验发现,DHA能促进星形胶质细胞分化,并促进神经营养因子GDNF分泌,最终发挥抗精神病作用,其原因可能与其能升高环磷酸腺苷(cAMP)反应原件结合蛋白(CREB)的活性有关[12]。本研究发现,ADHD儿童通过8周DHA的补充,体内DHA、GDNF水平显著升高,且ΔDHA与ΔSNAP-IV总分存在负相关;ΔGDNF与Δ注意缺陷分、Δ多动/冲动分存在负相关。以上结果说明,DHA改善ADHD儿童症状,可能与GDNF水平增高有关。
炎症也是ADHD的重要病理生理机制之一[13]。与正常儿童比较,ADHD儿童血清中IL-6、IL-1β水平增高,而TNF-α降低,IL-1β与ADHD儿童注意缺陷因子呈正相关,TNF-α含量与ADHD儿童的行为问题呈负相关[14]。ADHD合并癫痫患儿血清中促炎因子IL-6、TNF-α水平显著高于单纯癫痫患儿,并且促炎因子水平与Conner评分呈正相关[15]。中枢神经发生炎症后,将影响ADHD儿童多巴胺能系统的功能,最终导致认知功能障碍[16]。动物研究发现,ADHD小鼠灌胃omega-3多不饱和脂肪酸能降低其脑组织匀浆液中IL-1β及TNF-α水平,从而改善脑组织中炎症状态[17]。抗炎抗氧化物质(萝卜硫素、N-乙酰半胱氨酸)可改善ADHD的炎症环境及氧化应激水平,从而对ADHD的治疗有一定作用[18]。本研究发现,经过8周DHA辅助盐酸哌甲酯治疗后,研究组血清IL-6、TNF-α水平显著低于对照组及治疗前,其原因可能与DHA能抑制促炎症转录因子NF-κB活性,提升抗炎过氧化酶增殖激活受体-γ(PPAR-γ)活性,最终起到抗炎作用有关[19]。本研究发现,ΔGDNF与ΔTNF-α水平存在负相关,说明改善炎症环境能升高体内GDNF水平,最终有助于ADHD临床症状的改善。
综上所述,DHA对改善ADHD儿童的症状有益,其原因可能与升高体内GDNF水平及降低炎症因子IL-6、TNF-α水平有关。本研究为DHA用于ADHD儿童的辅助治疗提供了依据,但本研究样本量还比较小,儿童的膳食行为未完全控制,这些都是本研究的缺点,本课题组将在将来的研究中进一步完善。

