健脾通里中药芪黄煎剂对胃切除大鼠肠黏膜生物屏障损伤的影响
周富海,于庆生,沈 毅,张 琦,刘举达,王 振,经文善
(1.安徽中医药大学第一附属医院普外一科,安徽 合肥 230031;2.安徽省中医药科学院中医外科研究所,安徽 合肥 230031)
肠道是人体内最大的贮菌场所和内毒素库。正常情况下,细菌与内毒素比例协调、功能正常,肠道发挥其生物屏障作用。当机体遭受手术、感染、创伤后,肠腔内细菌和内毒素发生移位,引起脓毒血症和肠源性全身性感染,触发全身炎症反应综合征和多器官功能障碍综合征,影响疾病的转归和预后。
因此,临床上为了防治细菌和内毒素移位,除了保护肠黏膜机械屏障和免疫屏障,目前还有研究[1]通过调节肠腔内或者附着于肠壁上的微生物,维持肠道微生态平衡,发挥其对肠黏膜生物屏障的修复作用,抑制细菌和内毒素移位。而中医中药对肠黏膜生物屏障的修复也起到重要作用[2]。课题组前期研究[3-4]表明,芪黄煎剂对大鼠胃切除后肠黏膜免疫屏障和机械屏障具有调节作用,但芪黄煎剂调节两种屏障的机制之间是否存在联系,尚不清楚。
本研究采用胃切除法复制大鼠肠黏膜上皮损伤模型,探讨健脾通里中药芪黄煎剂保护肠黏膜生物屏障的机制。
1 材料
1.1 实验动物 雄性清洁级SD大鼠,共90只,体质量300~330 g,7周龄。购自安徽省动物实验中心[生产许可证号为SCXK(皖)2020-001]。
1.2 药物 按照既往研究方法[5],芪黄煎剂(由黄芪、党参、白术、大黄、厚朴、枳实、黄芩、丹参组成,质量比为20∶20∶10∶10∶10∶12∶15∶15,总质量234 g):饮片均由安徽中医药大学第一附属医院中药制剂中心提供,经过煎煮、过滤、浓缩,制成1.0 g/mL的生药煎剂,放入4 ℃冰箱内保存,给药前复温至30 ℃。肠内营养制剂能全素(整蛋白型粉剂):荷兰纽迪希亚出口有限公司,生产批号为H20200172。
1.3 主要试剂与仪器 TPY琼脂培养基(HB0397)、伊红美蓝琼脂平板(HBPM007)、肠球菌琼脂(HB0133)、乳酸杆菌选择性琼脂(HB0392):均购于青岛海博生物;BCA蛋白定量检测试剂盒(P0009):上海碧云天生物科技公司;SDS-PAGE凝胶制备试剂盒(G8200):杭州科研云生物;Trizol试剂:上海翊圣生物科技公司;HRP标记山羊抗兔二抗(SA00001-2):武汉三鹰生物科技公司;RT-PCR引物:由美国Invitrogen公司合成;荧光实时定量PCR仪(12K Flex):美国ABI Quant StudioTM;DYY-6B型稳压稳流电泳仪:北京六一仪器厂。
2 方法
2.1 动物分组、胃切除模型复制及给药方法 将大鼠适应性喂养1周后,随机分成空白对照组,假手术组,肠内营养组,芪黄煎剂低、中、高剂量组,每组15只。参照既往动物模型复制方法[5],采用10%水合氯醛按3 mL/kg腹腔注射麻醉,经腹部正中切口,行胃体部大小弯之间的前壁部分切除。同时,在距Treitz韧带15 cm处空肠前壁,用针头戳孔,将直径1.0 mm硅胶导管置入空肠内,进行双层荷包缝合固定,导管尾端经腹壁戳口通过皮下隧道潜行由颈背部双侧肩胛区皮肤引出,外套弹簧保护装置固定,用作手术后肠内滴注中药和营养液。假手术组仅行腹部正中切口,不进行胃切除术,手术后自由饮水进食,不给予肠内营养和中药。肠内营养组仅给予能全素肠内营养,即手术当天禁食、禁水,术后第1天开始给药,通过硅胶管用10 mL注射器通过微量注射泵缓慢、匀速、持续注入小肠内。每日能全素肠内营养量为4.3 mL[(120 kJ/kg×0.3 kg)/8.3 kJ/mL]。每只大鼠按300 g计算。每日滴注2次,速度控制为2 mL/h,连续应用1周。滴注完成后以2 mL生理盐水封管,防止硅胶管堵塞。芪黄煎剂低、中、高剂量组每日通过微量注射泵分别按照5、10、15 g/kg剂量单纯滴注中药芪黄煎剂,滴注方法、疗程均与肠内营养组相同。
2.2 标本制作与指标检测方法 对所有大鼠干预1周后,用10%水合氯醛麻醉取材,严格进行无菌操作。
2.2.1 大鼠体内内毒素浓度检测 从肠系膜根部找出门静脉,用4-0丝线结扎门静脉近心端,待门静脉充盈后用1 mL无菌注射器自门静脉采集0.3 mL血液,用于血清中内毒素浓度检测。分别留取盲肠内容物,称质量后加入灭菌注射用水混匀并离心,上清液以灭菌注射用水连续10倍稀释后,用于检测肠道内毒素浓度。剪取大鼠小肠系膜淋巴结,研碎,加稀释液2 mL匀浆,取匀浆液100 μL用于肠系膜淋巴结内毒素浓度检测。
2.2.2 大鼠肠道菌群变化检测 结扎盲肠制备无氧环境,用注射器抽取1 mL盲肠内容物,加0.9%氯化钠注射液进行10倍稀释,在振荡器上震碎、混匀,此为10-1比例,之后依次配成10-2、10-4、10-6、10-8稀释倍数,编号依次为2、4、6、8管,在此4管内各取0.01 mL菌液接种在4种培养基上。TPY琼脂培养基培养双歧杆菌,伊红美蓝琼脂平板培养大肠杆菌,肠球菌琼脂培养肠球菌,乳酸杆菌选择性琼脂培养乳酸杆菌。将乳酸杆菌和双歧杆菌置于厌氧罐,并于37 ℃孵箱培养72 h,将肠球菌和肠杆菌置于37 ℃孵箱培养48 h。
2.2.3 大鼠肠黏膜上皮结构的变化 参照课题组前期研究方法[6-7],取距回盲部2 cm以上的小肠组织约3 cm,固定后,标本采用苏木精-伊红(hematoxylin-eosinstaining,HE)染色法染色,石蜡切片,光学显微镜下观察肠黏膜上皮形态和结构变化。取空肠标本时注意避免人为损伤。用Chiu氏6级评分法[8]评价肠黏膜损伤程度。
2.2.4 实时荧光定量PCR检测小肠组织中紧密连接蛋白(zonula occluding-1,ZO-1)、封闭蛋白(claudin)、咬合蛋白(occludin)的mRNA表达水平 取上述准备好的标本100 mg,液氮中研成粉末,收集入Eppendorf管,Trizol试剂提取肠黏膜上皮细胞总RNA,紫外分光光度计检测吸光度(optical density,OD)值,计算RNA浓度和含量。采用逆转录cDNA试剂盒进行mRNA反转录反应。实时荧光定量方法进行RT-PCR反应,数据采用仪器自带软件分析,自动得出荧光曲线及CT值。采用2-ΔΔCT法计算mRNA的相对表达水平。
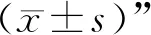
3 结果
3.1 各组大鼠体内内毒素水平比较 与假手术组比较,肠内营养组和芪黄煎剂低、中、高剂量组大鼠的肠道、门静脉血和肠系膜淋巴结中内毒素水平均显著升高(P<0.05);与肠内营养组比较,芪黄煎剂低、中、高剂量组内毒素水平显著降低(P<0.05),芪黄煎剂的效应呈现明显的剂量依赖性。见表1。
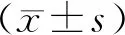
表1 各组大鼠体内内毒素水平比较
3.2 各组大鼠肠道菌群数量比较 胃切除手术创伤后,大鼠肠道菌群数量有明显降低趋势;肠内滴注药物干预后,菌群数量均明显升高;与肠内营养组比较,芪黄煎剂低、中、高剂量组菌群数量明显增加(P<0.05);其中芪黄煎剂高剂量组肠道菌群数量显著大于芪黄煎剂中、低剂量组(P<0.05)。见图1、表2。
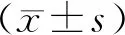
表2 各组大鼠肠道菌群数量比较

注:A.肠杆菌;B.乳酸杆菌;C.双歧杆菌;D.肠球菌
3.3 各组大鼠肠上皮黏膜形态及Chiu氏病理评分比较 大鼠遭受手术创伤应激后,肠道出现缺血再灌注损伤,肠道黏膜上皮出现不同程度受损。空白对照组大鼠小肠绒毛正常完整;假手术组大鼠小肠顶端绒毛上皮下间隙增大,伴少量瘀血;肠内营养组大鼠部分肠绒毛上皮下间隙扩张,部分绒毛上皮顶端与固有层分离,部分肠绒毛有充血水肿,有大量的黏液渗出;芪黄煎剂低剂量组大鼠绒毛破损伴随固有层毛细血管暴露,固有层中性粒细胞增多,有出血;芪黄煎剂中剂量组大鼠上皮下间隙扩张,伴黏膜上皮层与固有层中度分离和淋巴细胞浸润;芪黄煎剂高剂量组大鼠肠绒毛上皮受损较轻,绒毛上皮顶端固有层分离,部分肠绒毛有疤痕形成。见图2。与假手术组比较,肠内营养组,芪黄煎剂低、中、高剂量组肠黏膜Chiu氏病理评分明显升高(P<0.05),芪黄煎剂降低Chiu氏病理评分的效应呈现明显的剂量依赖性。见表3。
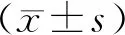
表3 各组大鼠小肠黏膜Chiu氏病理评分比较

注:A.空白对照组;B.假手术组;C.肠内营养组;D.芪黄煎剂低剂量组;E.芪黄煎剂中剂量组;F.芪黄煎剂高剂量组
3.4 各组大鼠小肠组织中ZO-1、claudin、occludin mRNA表达水平比较 与假手术组比较,肠内营养组和芪黄煎剂低、中、高剂量组大鼠小肠组织中ZO-1、claudin、occludin mRNA表达水平均显著下调(P<0.05);与肠内营养组比较,芪黄煎剂低、中、高剂量组ZO-1、claudin、occludin mRNA表达水平均显著上升(P<0.05)或呈上升趋势(P>0.05);芪黄煎剂升高ZO-1、claudin、occludinmRNA的效应呈现明显的剂量依赖性。见表4。
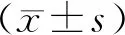
表4 各组大鼠小肠组织中ZO-1、claudin、occludin的mRNA表达水平比较
3.5 各组大鼠小肠组织中ZO-1、claudin、occludin蛋白的表达水平比较 与假手术组比较,肠内营养组、芪黄煎剂低剂量组小肠组织ZO-1、claudin、occludin蛋白的表达水平显著降低(P<0.05);与肠内营养组比较,芪黄煎剂低、中、高剂量组小肠组织ZO-1、claudin、occludin蛋白的表达水平显著升高(P<0.05)。见图3、图4。

注:A.空白对照组;B.假手术组;C.肠内营养组;D.芪黄煎剂低剂量组;E.芪黄煎剂中剂量组;F.芪黄煎剂高剂量组
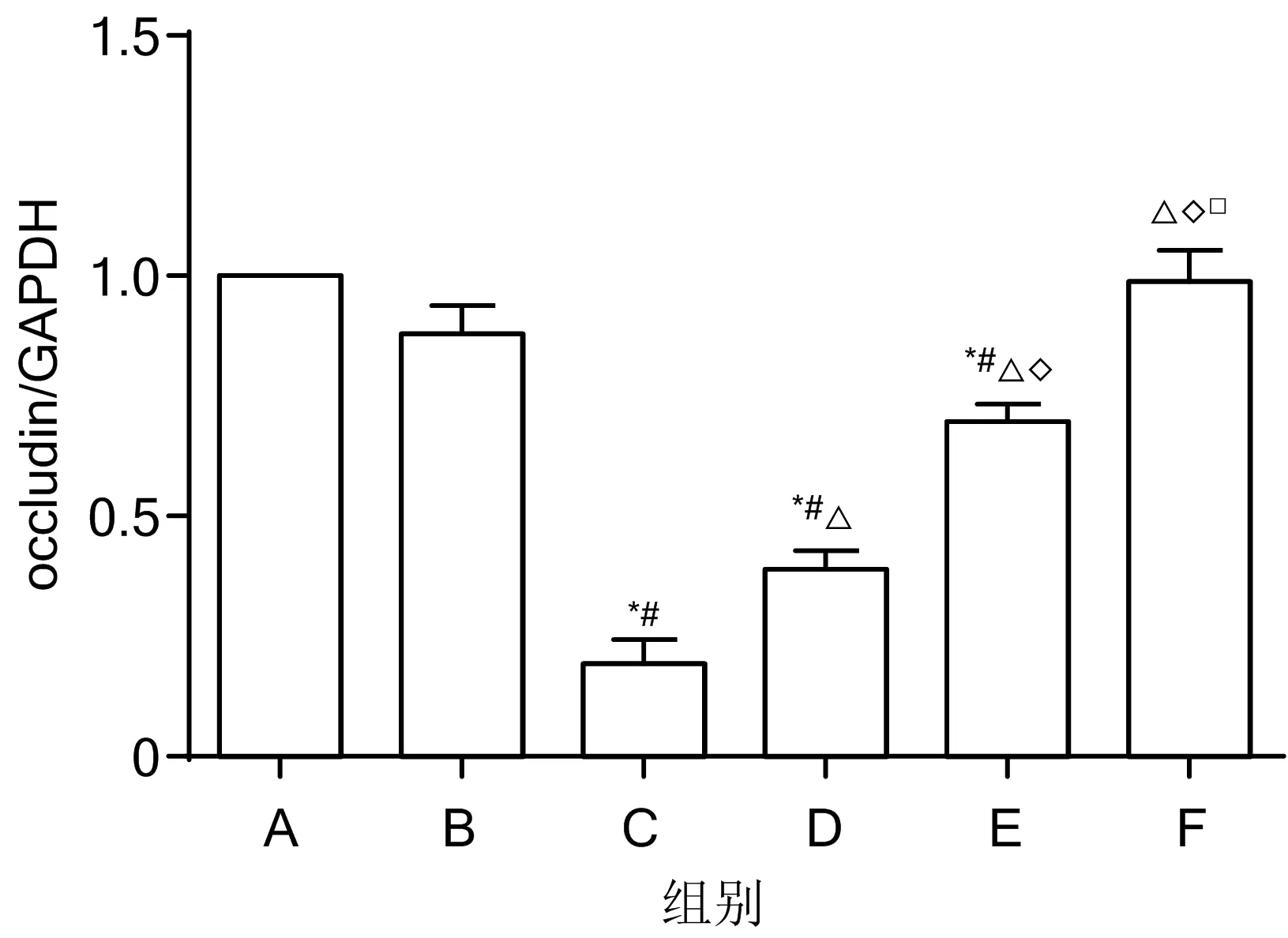
注:A.空白对照组;B.假手术组;C.肠内营养组;D.芪黄煎剂低剂量组;E.芪黄煎剂中剂量组;F.芪黄煎剂高剂量组;与空白对照组比较,*P<0.05;与假手术组比较,#P<0.05;与肠内营养组比较,△P<0.05;与芪黄煎剂低剂量组比较,◇P<0.05;与芪黄煎剂中剂量组比较,□P<0.05
4 讨论
人体肠道是细菌的良好培养基,肠道细菌中多数为厌氧菌,还有少数的需氧菌与兼性厌氧菌。这些菌群之间构成良好的比例,与人体形成相互依赖、相互作用的微生态系统。厌氧菌粘附于肠黏膜上,共同形成肠黏膜的细菌生物膜,削弱其他肠腔菌群附着或定植于肠上皮的能力,发挥着肠黏膜生物屏障的保护作用。一方面,肠黏膜生物屏障通过抑制或者减少致病菌数量,分泌短链脂肪酸来降低肠道的pH值以及抑菌肽,如Spinler等[9]研究表明,罗氏菌素有明显抑制肠道致病菌的作用。另一方面,肠黏膜生物屏障通过增加专属厌氧菌,形成稳定的细菌生物膜以减轻致病菌的定植拮抗作用,如Jones等[10]研究发现,双歧杆菌及乳酸杆菌均能在肠黏膜表面形成生物膜,乳酸杆菌形成的生物膜具有抗菌和调节肠道免疫的作用。而肠上皮细胞间的紧密连接是肠黏膜机械屏障重要组成部分,是抵抗各类病原体及抗原的第一道屏障。肠上皮紧密连接由跨膜蛋白咬合蛋白、封闭蛋白和ZO蛋白家族构成。Lindfors等[11]研究显示,双歧杆菌可减少小麦醇溶蛋白对结肠上皮细胞间紧密连接的保护作用,调节肠上皮机械屏障ZO-1紧密蛋白表达,也可有效修复肠黏膜生物屏障的损伤。
健脾通里中药对肠黏膜生物屏障损伤的修复发挥重要作用,张仁岭等[12]发现,四君子汤能够促进术后早期恢复,电子显微镜下观察发现小肠内绒毛长度及密度显著升高,小肠黏膜通透性降低,保护肠黏膜生物屏障。陈海龙等[13]发现,通里攻下方大承气汤能显著减少肠道内革兰氏阴性杆菌的数量,显著提高双歧杆菌和乳酸杆菌的数量。本实验结果同样也证实胃切除术后创伤使肠道的细菌和内毒素发生移位,芪黄煎剂高剂量组可修复小肠黏膜病理损伤,明显抑制大鼠体内的内毒素浓度,调节大鼠肠道菌群失衡。
中医学认为,脾主运化,为“气血生化之源”,胃为“水谷之海”。本课题组经过长期的实验与临床实践观察发现,胃切除手术创伤后,脾胃功能受损,出现气短、乏力、舌淡、苔白、脉细弱症状,术后又因麻醉创伤影响,脾胃的运化功能尚未恢复,又有腑实气滞表现,如进食后腹胀、肛门停止排气排便。其属于气血虚弱与腑实气滞并存的证候。健脾通里方“芪黄煎剂”依据《脾胃论》补中益气汤和《伤寒论》大承气汤组方而成,主要有健脾中药黄芪、党参、白术和通里攻下中药大黄、枳实、厚朴等。手术、创伤后肠黏膜结构受损、血流减少、屏障减弱为“虚证”,手术麻醉后的胃肠麻痹、细菌感染引起内毒素淤积在肠道为“实证”,故在治则治法上健脾通里。
脾主运化功能与肠道菌群关系密切,二者在机体消化吸收、生长发育、抗御外邪等方面起重要作用。脾运失健可引起肠道菌群失衡,出现消化吸收功能紊乱、免疫力减弱等症状,健脾益气中药可修复肠道生物屏障的损伤,调整肠道的酸碱度以及生成的抑菌肽,抑制肠道厌氧菌和外来菌的定植和生长,扶植有益菌生长,抑制炎症因子,保护肠道黏膜生物屏障[14]。
现代药理学研究[15]也发现,黄芪主要活性成分黄芪多糖具有明显扶植肠道内益生菌中双歧杆菌和乳酸杆菌数量,对致病菌中的肠杆菌与肠球菌具有一定的抑制作用,但是复方具有双重效应,对肠黏膜生物屏障的保护作用取决于复方制剂主要成分的药物活性,其作用机制可能为抑制肠黏膜的炎症因子,促进肠内的有益菌定植,平衡肠道微生态。朱珊[16]研究发现,健脾止泻颗粒(以黄芪、太子参、山药为主药)中黄芪有效成分能修复小肠黏膜及其上皮细微绒毛,减轻小肠上皮的炎症反应,有健脾止泻功效。党参补脾养胃,健运中气,具有抗菌、抗病毒作用,对大肠埃希菌、伤寒沙门氏菌具有显著抑制作用。通里中药促进胃肠道蠕动,减少这类菌群在肠道的停留时间,抑制致病菌生长,抑制需氧菌的过度繁殖,调节其种类、数量、比例、定位来纠正紊乱的菌群结构,改善肠黏膜生物屏障。现代药理学研究[17]证实,大黄有效成分大黄素可减少内、外源性内毒素吸收,降解和灭活血液循环和消化道中的细菌和内毒素含量,减轻肠黏膜屏障损伤及破坏,防止肠道菌群移位。
本研究证实,手术创伤可以引起肠道菌群结构紊乱、数量失衡,肠道上皮黏膜结构破坏,肠黏膜机械屏障和生物屏障受损,出现细菌和内毒素移位,两者之间相辅相成。芪黄煎剂对肠黏膜生物屏障的修复机制包括两方面:一方面,芪黄煎剂通过自身药物活性成分对肠道菌群和游离菌群进行调节;另一方面,芪黄煎剂通过对肠黏膜机械屏障的上皮细胞进行调节,通过调节ZO-1、claudin、occludin的表达,抑制ZO-1的磷酸化水平,恢复肠黏膜上皮紧密连接的连续性和完整性。

