肾阳亏虚证泄泻的现代生物学内涵
李小雅, 谭周进
李小雅, 谭周进, 湖南中医药大学 湖南省长沙市 410208
李小雅, 博士研究生, 研究方向方剂配伍疗效的微生态学机理研究.
0 引言
随着现代生活节奏的加快、工作压力的加重以及生活习惯的改变, 泄泻的发病率日益增长, 泄泻过程中常伴随其他疾病的发生影响人们生活质量, 给国家和社会带来巨大经济负担. 中西医结合作为我国医疗卫生的特色行业, 在疾病治疗过程中获得重要成绩. 病证结合是中西医结合中常见诊疗模式, 继承并创新了传统医学模式和现代医学模式. 在病证结合基础之上融合现代生物学、生物信息学等方法, 对于中医辨证客观化和规范化发展具有重要价值. 此外, 有助于中医证候宏观和微观病理生理机制的阐释, 促进中西医结合辨证论治的水平和临床疗效的提高. 本文将通过从肠道菌群、信号通路、“肾-肠轴”相关分子角度整理归纳影响肾阳亏虚证泄泻的作用因素, 揭示肾阳亏虚证泄泻存在机制, 探究肾阳亏虚证泄泻现代生物学本质, 有助于发现肾阳亏虚证泄泻的生物标记物, 为后续肾阳亏虚证泄泻的临床诊治提供理论依据.
1 肠道菌群影响肾阳亏虚证泄泻的发生发展
1.1 肠道菌群与肾阳亏虚证泄泻关系密切 人体是以五脏为中心, 联络六腑、奇恒之腑及其他组织器官而构成的一个有机整体. 肠道微生态在长期进化过程中, 经过个体的适应和自然的选择, 形成了一个不同种类菌群之间, 菌群与宿主之间, 菌群、宿主与环境之间对立统一的完整系统. 中医“肾肠相合”理论的提出从多维度阐释了两者在人体生命规律中的相似性, 为今后多种疾病的防治提供了新思路. 研究表明, 肠道菌群在泄泻发生中起重要作用, 体内某些特定菌群的变化可能成为影响某些疾病的主要原因. 不同中医证型泄泻的疾病本质存在差异, 因此其肠道菌群也会有所不同. 张晨阳等发现,,,等细菌对脾胃虚弱证泄泻有明显的干预作用. 食滞胃脘证泄泻小鼠肠道中脱硫弧菌、拟杆菌、普雷沃氏菌、沙特菌属等细菌变化较为明显. 肠道湿热证泄泻模型组小鼠肠道乳杆菌数量高于正常组, 肠杆菌及双歧杆菌数量则低于正常组. 陈志敏等发现脾肾阳虚泄泻大鼠肠道中长双歧杆菌、乳酸杆菌水平降低, 大肠埃希菌、粪肠球菌明显升高, 提示这些菌属可能参与并影响脾肾阳虚泄泻的发生发展. 在脾肾阳虚腹泻型肠易激综合征(irritable bowel syndrome-diarrhea, IBS-D)患者体内也出现了肠道菌群紊乱, 其乳酸杆菌、双歧杆菌含量降低, 大肠杆菌、肠球菌含量升高. 肾阳亏虚证泄泻与肠道菌群失调常双向影响. 肠道菌群紊乱, 肠上皮细胞间的紧密连接下降, 肠黏膜通透性增加, 菌群代谢性内毒素进入血液, 激活局部和全身免疫反应, 这也是肾阳亏虚证泄泻患者处于微炎症状态的重要原因之一. 故肾阳亏虚证泄泻常常伴随着肠道菌群失调, 而菌群紊乱又会进一步加重肾阳亏虚证泄泻. 可见, 肾阳亏虚和菌群失调体现的是泄泻不同层面的病机和病理变化, 肠道菌群失调是肾阳亏虚证泄泻发生的重要机制. 深入研究证候表型与肠道微生态的相关性, 分析肾阳亏虚证泄泻发生过程中肠道菌群的变化, 有利于阐明其发病机制, 加速肾阳亏虚证泄泻肠道菌群靶向调节作用.
1.2 肠道菌群代谢产物调节肾阳亏虚证泄泻 肠道菌群代谢产物短链脂肪酸(short-chain fatty acids, SCFAs)作为宿主-肠道微生物相互作用的重要体现, 有效阐释机体整体代谢功能及肠道健康状态, SCFAs含量变化也被描述为泄泻诊断的特征性生物标志物, 它可通过改善肠道炎症反应, 维护肠黏膜屏障功能, 调节肠道菌群平衡影响肾阳亏虚证泄泻. 研究发现, 肾阳亏虚证泄泻发生会诱发肠黏膜上皮屏障破坏, 使得机体出现肠道免疫功能损伤及低度炎症的表现, 炎症反应促进肠道菌群失调, 菌群失调反向诱导炎性反应, 如此循环. SCFAs激活G蛋白偶联受体、抑制组蛋白去乙酰化酶, 发挥肠道免疫调节功能. 诸如乙酸和丙酸诱导T细胞分化为调节性T细胞(regulatory T lymphocyte, Treg), 丁酸激活GPCRs途径活化结肠内巨噬细胞发挥免疫调节功能. 一方面, SCFAs在提供菌群自身生长所需能量的同时, 通过降低肠道内pH值, 改善肠道微环境使其更适宜有益菌生存, 抑制有害菌繁殖, 调节肠道菌群结构. 另一方面, 它在抵御病原体的侵入过程中, 保护肠黏膜化学屏障(促进黏蛋白、抗菌肽、免疫球蛋白A分泌)及机械屏障(上调紧密连接蛋白1、闭合蛋白表达), 维持菌群平衡. 另外, 它能够调节肠上皮细胞的增殖基因和凋亡基因, 维持肠黏膜形态. 因此, SCFAs在肾阳亏虚证泄泻的发生过程扮演积极作用, 维持体内SCFAs水平正常对于控制肾阳亏虚证泄泻的发生具有重要意义.
作为菌群的另一种代谢产物胆汁酸和菌群之间存在双向调节关系, 它可通过与菌群的相互调节改善肾阳亏虚证泄泻出现的有害菌增长以及肠道蠕动加快的现象. 这也是胆汁酸在肾阳亏虚证泄泻发生发展中扮演重要角色的原因. 主要表现在肠道菌群能影响胆汁酸的转化与结合. 例如双歧杆菌、乳酸杆菌、梭菌属等肠道细菌产生的胆汁盐水解酶催化解离甘氨酸与牛磺酸之间的酰胺键, 使结合型胆汁酸转变为游离型胆汁酸. 拟杆菌属、埃希菌属、优杆菌属、乳杆菌属等可将初级胆汁酸转变为次级胆汁酸. 学者们在分析胆汁酸增加的IBS-D患者与胆汁酸减少的IBS-D患者粪便中菌群差异时, 明确提示梭菌属参与IBS-D胆汁酸分泌增加过程, 证实了其在胆汁酸代谢中的重要性. 另外, 胆汁酸对肠道菌群有直接的抗菌作用, 脱氧胆酸能够显著抑制肠道乳酸杆菌、产气荚膜梭菌、双歧杆菌及脆弱拟杆菌等肠道细菌繁殖. 故胆汁酸与肠道菌群之间形成了一种双向调控关系, 肠道菌群紊乱容易造成体内胆汁酸稳态失衡. 胆汁酸稳态失衡, 使其大量积聚于肠中, 导致结肠蠕动增快, 从而发生泄泻. 由于大部分胆汁酸通过粪便排出, 体内反馈机制会促进胆汁酸分泌, 形成恶性循环. 脾肾阳虚IBS-D大鼠菌群紊乱的同时伴随胆汁酸吸收障碍. 在IBS-D患者中会出现合并胆汁酸吸收不良的现象. 可见, 胆汁酸间接参与肾阳亏虚证泄泻的发生过程, 保护体内胆汁酸代谢功能有利于控制肾阳亏虚证泄泻的发生.
2 信号通路调控肾阳亏虚证泄泻中的发生发展
信号通路作为连接分子与疾病的桥梁, 直接或间接参与疾病进程. 近年来, 信号通路成为肾阳亏虚证泄泻的研究热点, 从不同角度影响肾阳亏虚证泄泻的发生发展, 故探究不同信号通路调控肾阳亏虚证泄泻至关重要.
2.1 胆汁酸相关信号通路 法尼醇受体(farnesoid X receptor, FXR)及G蛋白偶联胆汁酸受体5(takeda G protein receptor, TGR5)胆汁酸相关信号通路在肠黏膜屏障功能、肠道炎症状态、肠道动力等方面影响肾阳亏虚证泄泻.
2.1.1 FXR通路: FXR为胆汁酸的核受体, 在肝脏、肠道、肾上腺等组织中表达. FXR通路对肠道内胆汁酸含量的调控主要通过抑制胆汁酸源头合成以及激活胆汁酸在回肠的重吸收两个方面实现. 其中FXR通路通过抑制肝脏内小异源二聚体伴侣削弱胆固醇7α-羟化酶表达, 或通过促进肠道内纤维细胞生长因子19分泌, 激活纤维细胞生长因子4, 减少胆固醇7α-羟化酶表达, 控制肝脏胆汁酸合成, 维持机体胆汁酸代谢平衡. 另外, FXR通路能够激活回肠末端Na/胆汁酸转运体, 增加胆汁酸的重吸收量. 研究发现, IBS-D患者胆汁酸代谢紊乱与其通路信号传导异常密不可分. 杨保伟等发现IBS-D患者肠黏膜FXR阳性表达率较低, 且与其病情严重程度密切相关. 在对比临床中健康人和IBS-D患者肠道胆汁酸含量时发现, 患者肠道胆汁酸合成明显增加, 这主要涉及纤维细胞生长因子19表达受到抑制. 同样, FXR通路参与抑制肠道炎症发生和保护肠黏膜屏障过程. 在FXR缺失小鼠肠道中白介素-1β、肿瘤坏死因子-α、白介素-6含量明显高于野生小鼠, 且紧密连接蛋白含量降低. 该通路激活血管生成素1、碳酸酐酶12、一氧化氮合成酶等基因诱导肠上皮细胞产生抗菌肽并且调控肠道酸碱环境保护肠道酸碱平衡, 抑制肠道细菌过度增长, 维持肠腔正常的生理状态和肠道菌群稳态, 由此对肾阳亏虚证泄泻产生治疗和保护作用. 故FXR通路通过调控体内胆汁酸稳态, 平衡肠道微环境, 积极控制肾阳亏虚证泄泻发生.
2.1.2 TGR5通路: TGR5是一种胆汁酸特异性G蛋白偶联受体, 在肠神经元、结肠嗜铬细胞、结肠L细胞上均有表达. 研究发现, IBS-D患者结肠黏膜TGR5的表达水平显著高于健康人, 提示IBS-D患者中肠道胆汁酸的代谢异常可能影响结肠黏膜TGR5的表达. 此外, 和野生型小鼠相比, TGR5小鼠体内胆汁酸对结肠收缩无促进作用, 结肠传输时间明显增加, 排便频率及粪便含水量减少, 表明TGR5对于促进结肠动力作用明显. 随后, 经证实胆汁酸促进结肠收缩的机制在于通过结合TGR5刺激5-羟色胺的释放. 而肾阳亏虚证泄泻存在5-羟色胺含量异常. 武志娟等发现, 脾肾阳虚IBS-D大鼠血清中5-羟色胺含量明显升高, 导致肠道蠕动、分泌增加, 从而出现腹泻和稀便的现象. 故胆汁酸含量和及TGR5受体表达存在异常可能是导致肾阳亏虚证泄泻发生的原因之一.
2.2 氨基酸相关通路 目前, 以甲硫氨酸(methionine, Met)、色氨酸(tryptophan, TRP)为主的氨基酸通路通过参与能量代谢、调节肠屏障功能、改善胃肠蠕动影响肾阳亏虚证泄泻.
2.2.1 Met通路: Met是人体的必需氨基酸. 它经转化后形成琥珀酰CoA进入三羧酸循环, 间接参与机体供能过程. 王均衡等发现阳虚质人群粪便中Met含量较平和质人群明显减少, 提示阳虚体质人群存在机体能量供应不足. 肾阳亏虚证泄泻由于脾胃运化功能失职, 受纳腐熟水谷输布精微过程受挫, 对食物消化、吸收能力减弱, 难以满足机体对蛋白质氨基酸的需求, 常常出现畏寒、怕冷、四肢不温的症状. 另一方面, Met一碳代谢物S-腺苷甲硫氨酸能够维持肠黏膜屏障的完整性. 在仔猪饲料中添加Met会使肠道中闭合蛋白-3显著增加. 另外, 饲粮添加L-Met也可增加仔猪肠上皮细胞跨膜电阻值, 提示Met能够很好的保护仔猪肠黏膜屏障功能. 而肠黏膜屏障损伤是肾阳亏虚证泄泻重要生理病理基础. 可见, Met通路介导能量供给正常及肠黏膜屏障功能对于改善肾阳亏虚证泄泻至关重要.
2.2.2 TRP通路: TRP及其代谢产物在调控肠道免疫耐受、维持肠道微生物稳态及抑制炎症中发挥关键作用. TRP摄入不足会引起肠道炎症和泄泻发生, 并伴随肠道结构破坏、肠道菌群紊乱及免疫调控失衡. TRP在机体内主要通过犬尿氨酸及5-羟色胺通路两条途径完成分解代谢. 膳食中约小部分TRP经羟化和脱羧作用产生5-羟色胺. 5-羟色胺作为胃肠道中的信号分子在调节胃肠运动、收缩等方面效果明显. 张庆伟等发现脾肾亏虚IBS-D患者血清中5-羟色胺含量较对照组明显升高, 提示脾肾阳亏虚IBS-D发生与5-羟色胺表达相关. 而膳食中大部分 TRP沿犬尿氨酸通路在色氨酸2,3-双加氧酶和吲哚胺2,3双加氧酶作用下生成犬尿氨酸. 除了以上两条代谢通路外, 部分TRP激活mTOR发挥生物学功能. Osawa等证实激活后的mTOR促进肠道上皮细胞分泌β-防御素. 同样, 犬尿氨酸也可通过调控免疫细胞释放白介素-17、白介素-22, 促进上皮细胞分泌β-防御素. 动物实验也发现脾肾阳亏虚IBS-D发生与结肠组织中β-防御素-2蛋白及其mRNA高水平表达相关. 可见, TRP通过调控犬尿氨酸及5-羟色胺代谢通路直接或间接影响肾阳亏虚证泄泻.
2.3 G蛋白偶联环腺苷酸-环腺苷酸依赖性蛋白激酶通路 G蛋白偶联环腺苷酸(cyclic adenosine monophosphate, c AMP)-环腺苷酸依赖性蛋白激酶(protein kinase A, PKA)通路通过调控肠道水液代谢平衡影响肾阳亏虚证泄泻. c AMP-PKA通路在细胞外信号分子刺激下激活腺苷酸环化酶, 诱导胞内c AMP增加, 加速效应物蛋白激酶A升高, 参与各种细胞生理活动. 水通道蛋白(aquaporins, AQPs)作为一种能够调节水平衡的膜蛋白, 广泛存在于肠道中. 当受到外界刺激时, AQPs含量增加或减少, 对于促进或抑制肠道水液代谢具有重要作用. 肾阳亏虚证泄泻出现粪便含水量升高、排便次数增加等症状主要是由于肠道水液代谢不平衡有关, 其中AQPs参与其中. 脾肾阳虚IBS-D大鼠出现排便次数增加、粪便稀软、肛周污秽等现象, 结肠组织中AQP8含量降低, 提示AQP8在脾肾阳虚IBS-D发病中作用明显. 研究发现, c AMPPKA信号通路参与了AQPs的调控, 其作用机制体现在c AMP酶被激活后, 胞内c AMP含量激增, 磷酸化活化AQPs, 导致细胞胞膜对水液通透性增加. 可见, c AMPPKA介导AQPs表达异常在肾阳亏虚证泄泻病理生理过程中起关键作用.
2.4 Toll样受体4/髓样分化因子88/核因子κB通路 Toll样受体4(Toll-like receptor 4, TLR4)/髓样分化因子88(myeloid differentiation factor 88, MyD88)/核因子κB(nuclearfactor κB, NF-κB)通路在肾阳亏虚证泄泻调控炎症反应中起重要作用. 研究证实, IBS-D发病与肠黏膜低度炎症反应密切相关, 这可能是由于TLR4/MyD88/NF-κB通路破坏促炎细胞因子与抗炎细胞因子的平衡而发生. TLR4/MyD88/NF-κB通路可以诱导下游炎性反应因子基因转录和翻译, 释放如白介素-1β、肿瘤坏死因子α、白介素-6等入血, 导致IBS-D患者肠道炎症反应增加. 牛冰玉等研究显示, 脾肾阳虚IBS-D患者肠黏膜TLR4和NF-κB蛋白含量升高, 血清中MyD88、炎性细胞因子白介素-1β及白介素-6分泌水平显著升高, 提示脾肾阳虚IBS-D经过TLR4/MyD88/NF-κB通路导致炎性因子的失衡, 进而造成脾肾阳虚IBS-D的发生发展. 因此, 平衡TLR4/MyD88/NF-κB通路, 抑制机体炎症反应发生, 对于肾阳亏虚证泄泻发生发展尤为重要.
2.5 NF-κB/Notch 1通路 研究发现, NF-κB/Notch1信号通路在肾阳亏虚证泄泻发病过程中调节肠黏膜通透性, 是影响肠道紧密连接蛋白的重要细胞因子, 主要体现在调控肠道干细胞分化成杯状细胞的过程中. 该通路异常表达不仅加速转录因子Hes-1含量, 同时明显抑制ATOH1, 这样肠道干细胞分化成杯状细胞过程受阻, 肠黏膜屏障功能降低, 影响肠道正常紧密连接功能. 陈贤家等发现IBS-D大鼠结肠组织NF-κB、Notch1 mRNA和蛋白水平较正常组明显增加, 同时促进血清中肿瘤坏死因子α、白介素-2、二胺氧化酶表达, 提示IBS-D激活了NF-κB/Notch1通路, 引起大鼠肠黏膜屏障受损. 可见, 维持NF-κB/Notch 1通路正常传递将成为肾阳亏虚证泄泻诊断治疗研发的关键作用靶点.
2.6 p38丝裂原活化蛋白激酶通路 p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路是MAPK家族中重要传导路径, 对胃肠动力功能紊乱和炎症反应异常具有高敏感性. 生理状态下, 低活性的p38 MAPK可被多种细胞因子激活, 活化后的p38 MAPK刺激下游多种酶及转录因子表达, 加速炎性因子释放. 炎性因子释放对细胞又形成新的干扰, 导致机体出现MAPK信号通路再次激活的现象, 由此形成正反馈调节, 最终炎症因子过量表达. 过量的炎症因子不仅促进肠道炎症和肠黏膜屏障损伤, 还可引起肠道运动功能紊乱. 因此, 保护机体p38 MAPK稳定尤为重要. 郭军雄等发现IBS-D大鼠结肠组织中 p38 MAPK 蛋白表达明显高于正常组, 且与白介素-1β、白介素-6和肿瘤坏死因子α呈正相关, 提示IBS-D通过激活p38 MAPK通路, 刺激p38 MAPK表达, 上调白介素-1β、白介素-6和肿瘤坏死因子-α, 引发肠黏膜低度炎症. 因此, p38 MAPK通路在调节肾阳亏虚证泄泻胃肠动力功能和炎症水平方面具有潜在指导意义.
2.7 脑源性神经营养因子/酪氨酸激酶受体B通路 脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)/酪氨酸激酶受体B(tyrosine kinase receptor B, TrkB)通路参与调控肠道蠕动功能影响肾阳亏虚证泄泻. BDNF在肠道表达, 可通过增加平滑肌的收缩频率及幅度, 促进肠道蠕动反射而影响肠道动力. 另外, BDNF表达异常能够激活肠胶质细胞网络, 诱导肠胶质细胞释放生物活性物质, 协同促进IBS-D发生. TrkB是BDNF高亲和力受体, 两者结合后促进TrkB活化过程, 激活TrkB-PLC/IP3信号通路, 引起一系列底物磷酸化, 作用于肠道平滑肌, 导致肠道动力增强. 侯理伟等证实脾肾阳虚IBS-D大鼠肠道受到刺激后, 引起BDNF蛋白及TrkB受体呈现高表达, 随后启动系列神经级联反应, 引起脾肾阳虚IBS-D肠道症状. 同样, 在脾肾阳虚IBS-D患者血清中出现了BDNF、TrkB含量高水平表达. 可见, 从BDNF/TrkB通路入手可为调节肾阳亏虚证泄泻肠道蠕动加快提供新的思路.
3 “肾-肠轴”相关分子干预肾阳亏虚证泄泻的发生发展
近年来, 从现代科学角度阐述中医理论的内涵已成为中医现代化的重要研究方向. 现代研究证实了“肾”与“肠”在生理功能内涵上呈现明显相似性, 肾肠病变亦可互相传变, 这与现代“肾-肠轴”学说相互印证. “肾-肠轴”的正常传递受多种分子的调控. 而肾阳亏虚证泄泻的发生直接或间接影响“肾-肠轴”相关分子的传递, 我们将从“肾-肠轴”中能量代谢、炎症反应、氧化应激相关因子几个角度对肾阳亏虚证泄泻的调控机制进行阐述.
3.1 能量代谢相关分子 能量代谢相关分子经“肾-肠轴”传递从能量代谢角度影响肾阳亏虚证泄泻. 研究发现, 肾阳亏虚会造成机能减弱或衰退、代谢减缓、产热不足的病理状态, 患者常出现畏寒肢冷、精神不振、喜静萎靡等症状, 与现代医学理论中的基础代谢率及能量代谢水平下降而导致的供能不足所表现的症状相似. c AMP、环磷酸鸟苷(cyclic guanosinc monophosphate, c GMP)作为细胞调控作用的重要调节物质, 在细胞代谢及多种生理效应中发挥关键作用. 同时, c AMP、c GMP也是一对相互拮抗又制约的物质. 潘新等发现脾肾阳虚泄泻模型大鼠体内出现c AMP、c GMP代谢失衡现象, 其中模型组血清c AMP含量降低, c GMP含量升高. Na- K- ATP酶及Ca-Mg-ATP酶作为基础代谢下产热的酶, 能够衡量机体能量代谢水平, 两者活性的高低与机体能量代谢成正比. 陈志敏等发现, 脾肾阳虚泄泻大鼠体内能量代谢减弱, 肝组织中Na-K-ATP酶及Ca-Mg-ATP酶活性明显低于正常大鼠. 此外, 琥珀酸脱氢酶和乳酸脱氢酶分别作为机体有氧氧化和无氧氧化的标志酶, 其含量变化代表机体有氧代谢和无氧代谢能力的高低. 大鼠脾肾阳虚泄泻期间伴随琥珀酸脱氢酶活性显著降低及乳酸脱氢酶活性显著升高. 可见, 以上分子含量高低在诱发阳虚证(肾)一系列病理学表现的同时影响泄泻(肠)的发病过程. 基于此, 它们作为调控能量代谢的关键分子在“肾-肠轴”调控肾阳亏虚证泄泻中发挥重要作用.
3.2 炎症相关分子 炎症相关分子经“肾-肠轴”传递通过调控炎症反应角度影响肾阳亏虚证泄泻. 肠黏膜免疫功能失调直接或者间接地影响肾阳亏虚证泄泻患者的肠道动力和肠黏膜屏障功能, 肠黏膜免疫功能失调与炎性细胞因子的过度释放相关. IBS-D期间伴随炎症因子高表达, 它们经过神经、内分泌等途径调控肠黏膜层和平滑肌层的神经纤维加速肠蠕动, 从而引起泄泻. 脾肾阳虚IBS-D患者出现血清肿瘤坏死因子-α含量升高, 加重肠黏膜免疫功能失调, 诱发肠黏膜炎症反应, 使患者病情反复. 此外, 脾肾阳虚IBS-D患者血清中白介素-6、白介素-8含量显著高于正常. 白介素-6升高削弱肠黏膜屏障功能, 促进机体发生免疫应答, 改变胃肠道动力系统. 白介素-8作为炎症趋化因子参与了肾阳亏虚证泄泻发病. 辅助性T淋巴细胞1/辅助性T淋巴细胞2 (T lymphocytes1/T lymphocytes2, Th1/Th2)相互制约的稳定状态对于维持机体良好的防御状态具有积极作用. 都业馨等发现脾肾阳虚IBS-D患者由于体内Th1/Th2制约失衡, Th1细胞的细胞因子干扰素-γ水平明显升高, Th2细胞的细胞因子白介素-4含量异常降低, 导致肠道稳定性降低, 诱发炎症反应发生. 同样, 辅助性T细胞17/调节性T细胞(T lymphocytes17/Treg, Th17/Treg)细胞因子平衡状态影响肾阳亏虚证泄泻的发生发展. 当平衡打破机体肠道常驻菌群的耐受状态受到威胁, 抗原微生物免疫和异物排斥反应增强, 同时肠黏膜细胞结构发生变化, 诱发肠内炎性因子表达, 影响人体的胃肠道的运动、感觉及分泌功能. 张铭承等发现IBS-D患者体内Th17/Treg细胞因子失衡, 作为Th17细胞因子白介素-17在患者血浆中呈现高水平表达, 而Treg细胞因子白介素-10呈现低水平表达. 可见, 以上因子可诱导肠黏膜结构及功能损伤, 诱导免疫应答, 也是引发肾阳虚证的主要免疫机制. 而肾脏疾病的发生过程中也会会出现全身微炎症反应, 大量炎症因子异常表达, 入血后循环至肠, 引起肠壁充血水肿, 随后肠道缺血低氧会破坏肠黏膜屏障而发生菌群失调. 综上, 它们作为调控炎症反应的关键分子在“肾-肠轴”调控肾阳亏虚证泄泻中发挥重要作用.
3.3 氧化应激相关分子 氧化应激相关分子经“肾-肠轴”传递参与机体氧化应激过程影响肾阳亏虚证泄泻. 研究发现, 肠道中含有丰富的微生物群, 对氧化应激较为敏感, 机体遭受刺激后, 促氧化与抗氧化之间的平衡被打破, 细胞内活性氧(reactive oxygen species, ROS)不断产生, 大量自由基的释放加速氧化产物产生量增加, 呈现机体组织受损. 自由基所致脂质过氧化作用造成生物膜损伤, 与肾阳亏虚的病理原因也有密切的关系. 此外, 氧化应激的发生伴随肠道菌群紊乱, ROS会被降解在肠腔中, 通过氧化酶相关基因促进肠道中条件致病菌繁殖. 同时, 氧化应激也会损伤肠道上皮屏障, ROS直接作用于紧密连接蛋白和黏附蛋白, 破坏紧密连接相关蛋白的三级结构、生成蛋白交联聚合物、加速相关蛋白肽链断裂和降解、使紧密连接相关蛋白分子中色氨酸等触发氧化. 肾阳亏虚证泄泻发病期间也会出现肠道菌群紊乱及肠黏膜屏障损伤, 这可能与疾病过程中发生氧化应激相关. 动物实验证实, IBS-D大鼠发生氧化应激反应, 主要通过抑制血清中超氧化物歧化酶(superoxide dismutase, SOD)表达以及激活丙二醛(malondialdehyde, MDA)表达实现. 此外, 这些分子的异常表达会刺激促纤维化细胞因子释放, 诱导肾小管间质纤维化的发生, 引起肾损伤. 而当肾损伤发生后, 其排泄功能降低, 有害代谢产物不能及时排出, 不断蓄积于体内, 高浓度有害代谢产物会经肠壁血管进入肠腔, 引起肠内pH值发生变化, 出现肠道菌群紊乱, 肠黏膜屏障损伤, 如此恶性循环. 因此, 它们作为调控氧化应激反应的关键分子在“肾-肠轴”调控肾阳亏虚证泄泻中发挥重要作用.

表 1 肾阳亏虚证泄泻的现代生物学内涵
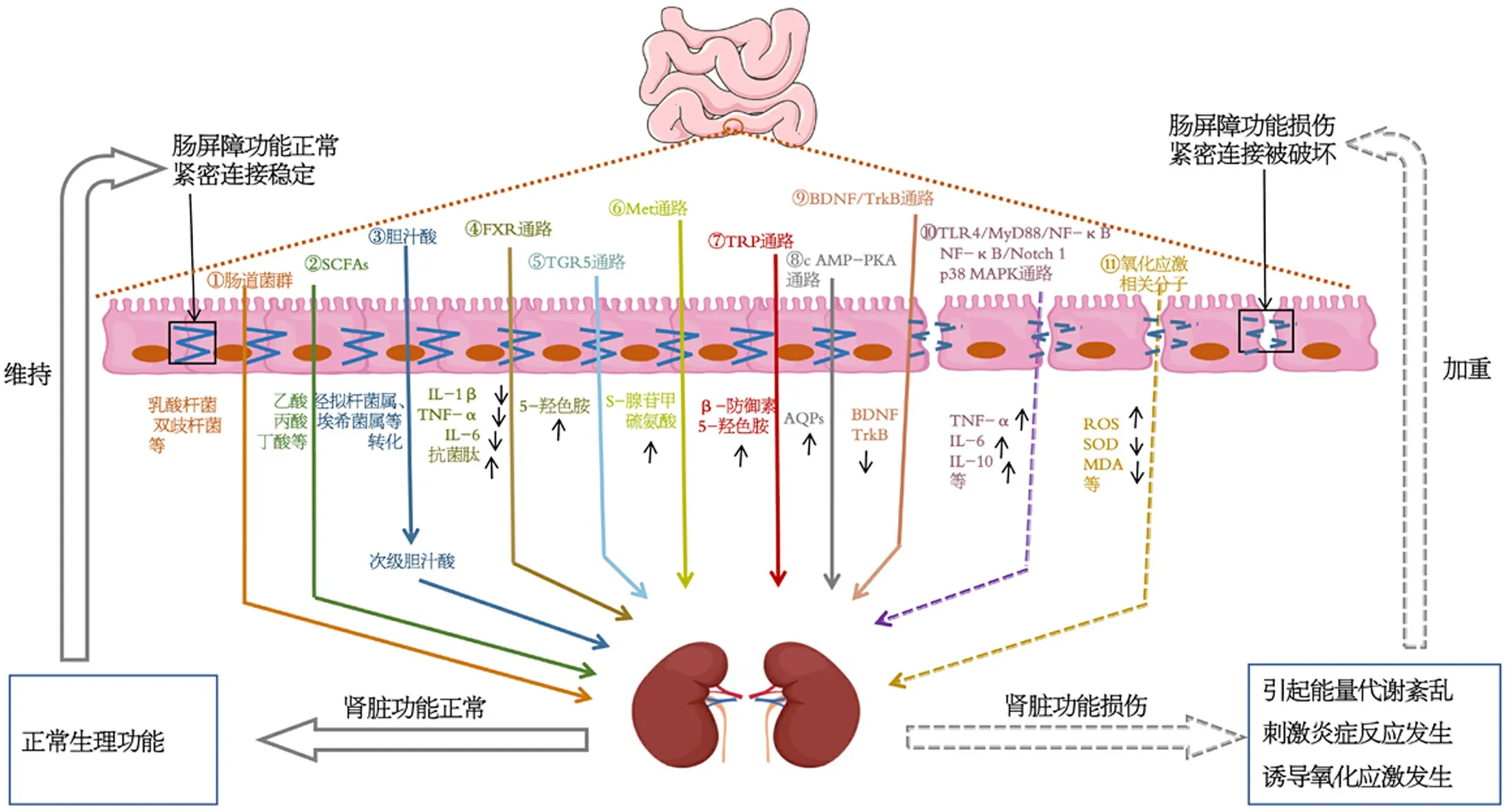
图 1 “肾-肠轴”的机制假说图. 图中实线代表正调控作用; 虚线代表负调控作用; 不同颜色代表不同影响因素的调控作用.
4 结论
证候研究一直是中医基础理论学科探索的主要领域, 证候科学内涵的阐释是指导临床辨证论治的重要依据. 其中肾阳亏虚证泄泻的基础研究已持续多年, 虽然为揭示泄泻中医证候的科学内涵提供了参考, 但其发生机制尚未明确且与现代医学疾病的诊断仍存在不可逾越的鸿沟. 因此, 本文对肾阳亏虚证泄泻的现代生物学内涵进行综述(表1, 图1), 总结出肠道菌群及其代谢产物, 信号通路及“肾-肠轴”相关分子可从平衡肠道微环境, 保护肠黏膜屏障功能, 维持肠道菌群稳态, 调节水液代谢过程, 介导肠道蠕动功能, 减轻肠道炎症反应, 调控能量代谢过程, 干预氧化应激反应多个层面改善肾阳亏虚证泄泻, 为今后肾阳亏虚证泄泻的诊断和治疗提供更多方向.

