钙信号抑制剂加剧低钾胁迫对烟草幼苗光合特性及钾吸收的影响
代晓燕,徐高强,石秋环,王英锋,陈培钰,张铜津,刘 灿,张小全*,符云鹏
(1 河南农业大学烟草学院/烟草行业烟草栽培重点实验室,河南郑州 450002;2 河南省烟草公司洛阳市公司,河南洛阳471023)
钾是植物生长发育所必需的大量营养元素之一,它直接参与植物光合作用、渗透调节等重要生理过程[1-2],且能改善烟叶颜色、身份、燃烧性和吸湿性,并对一些芳香类物质的合成积累有促进作用[3]。但由于我国北方植烟土壤钾固定及南方土壤钾淋失问题,导致我国植烟土壤供钾能力不足及钾肥利用率低等现象一直存在,严重影响着我国烟叶钾含量[4],因此,研究低钾胁迫下调控烟株钾吸收的关键因子尤为重要。烟株钾吸收与外界钙浓度之间的关系十分复杂,有研究发现,增加外源钙浓度可促进烟株对钾的吸收[5-6],但浓度过高则会抑制钾吸收[7]。本课题组前期研究结果表明,外源添加适当的Ca2+浓度可促进烟株K+吸收,但过高的Ca2+浓度则会抑制烟株K+吸收,水培条件下钙浓度为5 mmol/L时最利于烟株生长发育及钾吸收[8]。其实Ca2+作为第二信使是植物响应低钾胁迫最重要的信号调控系统之一[9]。逆境刺激下,Ca2+从细胞外环境通过细胞膜或内质网流入细胞质,导致胞质Ca2+浓度升高并流向细胞核,细胞核中的Ca2+可调节蛋白质的磷酸化或去磷酸化,进而调控信号转导[10]。植物在低钾环境下可诱导细胞内钙离子浓度升高,随后结合钙信号传感器包括钙调蛋白(CaM)、CaM样蛋白(CML)、钙依赖性蛋白激酶(CDPK)、钙调神经磷酸酶B 亚基样蛋白(CBL)、与CBL相互作用的蛋白激酶(CIPK)等,对逆境因子进行感知、解码,引导植物响应低钾胁迫[11]。徐江等[12]研究表明,在低钾水平下,拟南芥胞内增加的游离Ca2+与钙传感器结合激活CIPK,进而通过磷酸化激活AKT1,促进植物钾的吸收与转运,提高植株耐低钾能力。此外,钙信号途径是植物光合作用中光能吸收和转化的重要传导通路之一[13]。当植物面临环境刺激时,叶绿体中的钙振荡触发下游事件进而调节光合途径[14]。例如,Ca2+信号转导途径可以调节依赖叶黄素循环的非光化学猝灭(NPQ)[15]。王旭等[16]研究表明,钙离子浓度变化可影响低氧胁迫下黄瓜的叶绿素荧光。研究植物细胞内钙信号传导的常见方法之一,是通过添加Ca2+抑制剂影响细胞质内Ca2+浓度变化进而阻碍钙信号的产生。异搏定(Vp)是一种Ca2+通道有机阻断剂;氯化镧(LaCl3)是一种Ca2+通道无机抑制剂;EGTA是一种Ca2+螯合剂,通过螯合细胞外的Ca2+,从而降低细胞质的Ca2+浓度。研究表明,钙通道抑制剂可直接抑制烟草原生质体向外整流的钾离子传导[17]。
目前,有关钙信号及其传感器参与调控植株钾吸收的研究已有报道,但低钾胁迫下钙信号传导途径参与响应烟草钾吸收和维持光合作用关系的机理尚缺乏深入研究。通过研究钙信号抑制剂对低钾胁迫下烟草光合特性和钾吸收的影响,解析钙信号传导与烟株响应低钾能力和光合功能维持的关系,以期为提高植物体内钾素含量提供参考。
1 材料与方法
1.1 供试材料与培养
供试材料为烟草品种K326,试验于2020年在河南农业大学国家烟草栽培生理重点实验室进行。种子消毒催芽后,选大小均匀的烟苗移栽到装有珍珠岩的小黑盆中,每日补充Hoagland全营养液,然后放置在光照培养箱中生长。培养条件为:昼温(28±2)℃,夜温(18±2)℃,光周期14 h,相对湿度65%~70%,光照强度4000 lx。
1.2 试验处理
试验包括常钾水平 (K+5 mmol/L)和低钾水平(K+0.15 mmol/L);两个钾水平下,均设添加钙通道抑制剂异搏定 50 μmol/L (Vp)、氯化镧 200 μmol/L(LaCl3)、钙离子螯合剂乙二醇双2-氨基乙醚四乙酸2.5 mmol/L (EGTA) 3个处理,均设置不抑制钙对照,常钾水平的对照记为CK(+)、低钾水平的对照记为CK(-),共8个处理。待烟苗长至3片真叶时选择长势均匀一致的烟苗,于蒸馏水中进行钾饥饿处理24 h,再分别置于不同钾水平的Hoagland全营养液中处理8 天,营养液每4 天更换一次。钾处理8天后同时进行钙抑制处理。EGTA使用时用氢氧化钠按100 mg/mL比例进行溶解,pH调节至6.5~7.0。培养期间,使用充气泵每日通气8 h。处理4天后,取样测定相关指标,每处理6个生物学重复。
1.3 测试指标和方法
1.3.1 根系及地上部鲜重和干重 分别取植株根系及地上部称鲜重,在105℃烘箱中杀青15 min,并于65℃烘干至恒重,分别测定地上部及根系干重。
1.3.2 植株生理特征 采用考马斯亮蓝G-250比色法测定叶片中的可溶性蛋白含量[18]。取鲜样6份,各0.1 g,放进50 mL离心管中,加入10 mL蒸馏水后室温下浸泡处理12 h,采用电导率仪(DDS-307型)测定提取液电导率R1,沸水浴加热30 min后冷却,摇匀后测定提取液电导率R2,得到相对电导率=R1/R2×100%[19]。
1.3.3 活性氧积累量 根据H2O2与硫酸钛可生成黄色的过氧化钛复合物,利用其在415 nm有特征吸收的性质测定植株叶片中H2O2含量,根据试剂盒使用说明书按步骤测定(试剂盒购自南京建成生物工程研究所);同理测定超氧阴离子含量。
1.3.4 叶片抗氧化酶活性 叶片超氧化物歧化酶(SOD)活性采用核黄素NBT法测定;过氧化物酶(POD)活性采用愈创木酚法[19]测定。
1.3.5 光合作用 每个处理选取6株长势均匀一致的烟苗,选择第3片真叶用光合仪CIRAS-3 (PP-systems,英国)测定净光合速率、气孔导度、胞间CO2浓度、蒸腾速率、水汽压饱和亏、水分利用率等光合参数,测定环境条件严格控制,其中光强(PAR)设定为 1000 μmol/(m2∙s),CO2摩尔分数为390 μmol/mol,温度为25℃,测定时间为上午9:00—11:00。
1.3.6 叶绿素含量的测定 取鲜样0.3 g,共3份,放入研钵中,加少量石英砂和碳酸钙粉及2~3 mL 96%乙醇研成匀浆,再加乙醇10 mL,继续研磨至组织变白,静置3~5 min后用乙醇定容至25 mL容量瓶中,摇匀,利用酶标仪测定叶绿素a、叶绿素b和叶绿素总量[18]。
1.3.7 植株各部位钾含量测定 将样品烘干研磨粉碎并过0.2 mm筛后,精确称量0.1000 g,采用1 mmol/L盐酸提取法[20],使用FP6400火焰光度计测定植株地上部及根系钾含量。
1.3.8 钾吸收及钙通道相关基因的相对表达量 钾处理8天后同时添加不同钙信号抑制剂,处理4天后取根部于液氮中。钾吸收及钙通道相关基因的相对表达量采用实时荧光定量PCR法测定:使用GeneMark公司试剂盒提取总RNA,琼脂糖凝胶电泳检测RNA完整性,根据ABM公司试剂盒将待测RNA逆转录成cDNA。在IQ5光循环仪系统(Bio-Rad)中使用SYBR Green PCR Master Mix (中国天根生物技术有限公司)进行RT-qPCR分析。PCR程序:95℃ 3 min,95℃ 5 s,58℃ 10 s,40 个循环,72℃ 10 min。内参基因为烟草NtActin基因,引物序列见表1,最后采用2-ΔΔCt法计算基因表达量。
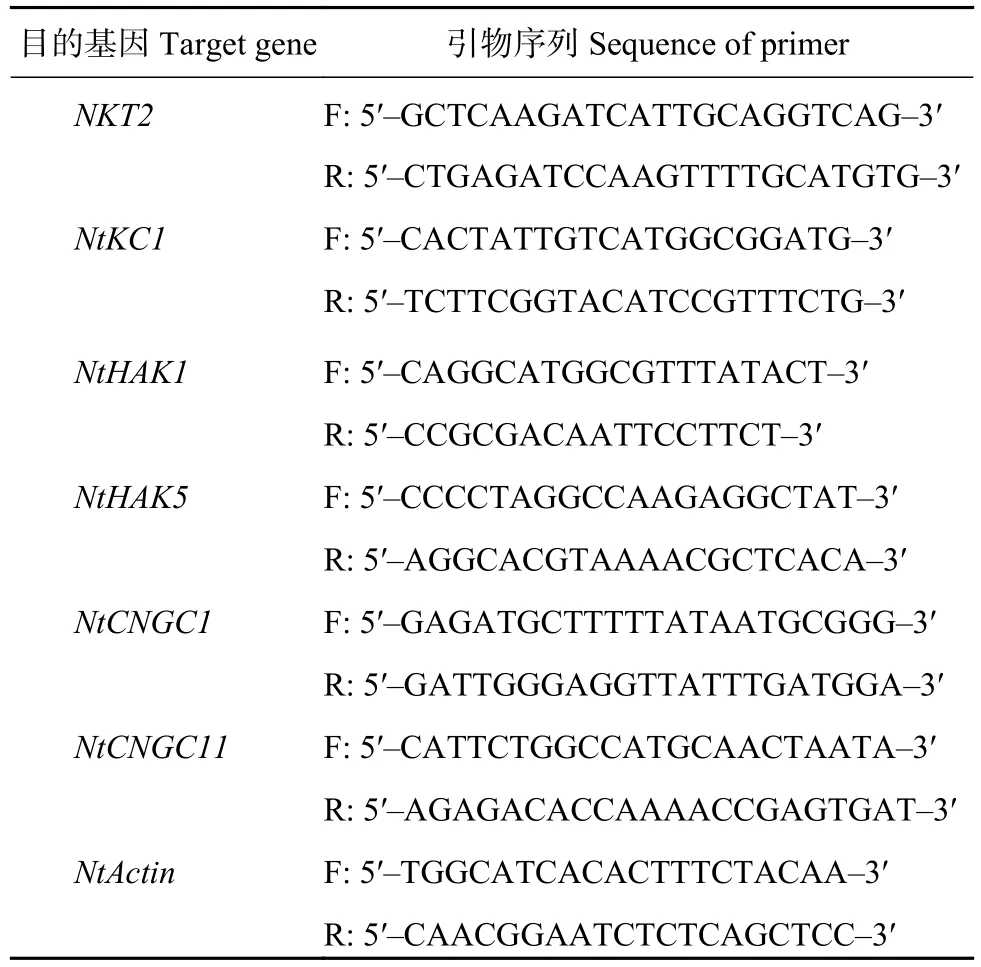
表1 烟草钾离子吸收相关基因引物序列Table 1 Primer sequences of genes related to potassium absorption in tobacco
1.4 数据处理
采用Excel 2016进行数据整理,运用DPS (v 7.05)进行数据统计分析,使用Duncan新复极差法进行差异显著性检验,利用GraphPad Prism (v 8.0.2)作图。
2 结果与分析
2.1 钙抑制剂处理对不同钾水平下烟株生长发育的影响
2.1.1 植株地上部及根系的鲜重和干重 如表2所示,低钾水平下CK(-)植株地上部及根系的鲜重和干重显著低于常钾水平CK(+),其中低钾水平下地上部和根系鲜重、干重分别比常钾水平下降低了51.58%、59.29%和48.19%、39.82%。在低钾水平下,3个钙抑制剂处理的植物地上部及根系的鲜重和干重较CK(-)显著增加,Vp、LaCl3、EGTA处理地上部鲜重和干重与CK(-)相比分别增加了39.06%、67.81%、57.19%和58.54%、90.24%、68.29%,根鲜重和干重较CK(-)分别显著增加了55.00%、59.00%、45.00%和30.94%、25.18%、29.98%。常钾水平下3个钙抑制剂处理植株地上部和根系干鲜重与CK(+)相比差异均不显著。

表2 不同钾水平下不同钙抑制剂处理烟株地上部及根系鲜重和干重(g/plant)Table 2 Fresh and dry weight of shoots and roots of tobacco plants under different Ca inhibition treatments at normal and low K supply levels
2.1.2 植株叶片可溶性蛋白含量及相对电导率 无钙抑制处理,低钾水平下的叶片可溶性蛋白含量和相对电导率与常钾水平相比,分别显著增加了39.37%和44.31%。钙抑制剂处理增加了常钾水平下叶片可溶性蛋白含量。在低钾水平下,Vp处理的叶片可溶性蛋白含量与CK(-)相比无显著变化,LaCl3和EGTA处理显著高于CK(-) (图1)。两种钾水平下,钙抑制剂处理的植株相对电导率均比CK(+)或CK(-)显著增加(图1)。

图1 不同钾水平下钙抑制剂处理对植株叶片可溶性蛋白含量及相对电导率的影响Fig. 1 Effects of Ca inhibition treatments on soluble protein content and relative electrical conductivity of plants leaves under normal and low potassium levels
2.1.3 活性氧积累量 如图2所示,无钙抑制处理时,低钾水平下叶片过氧化氢和超氧阴离子含量均高于常钾水平,其中低钾水平下CK(-)与常钾水平CK(+)相比过氧化氢含量显著提高了69.86%。两种钾水平下,3个钙抑制剂处理烟草叶片过氧化氢和超氧阴离子含量与CK(+)或CK(-)相比均显著增加,其中低钾水平下Vp、LaCl3、EGTA 3个钙抑制剂处理与CK(-)相比分别增加59.96%、64.23%、151.40%(图2),超氧阴离子含量分别显著增加了23.54%、23.54%、15.17% (图2)。
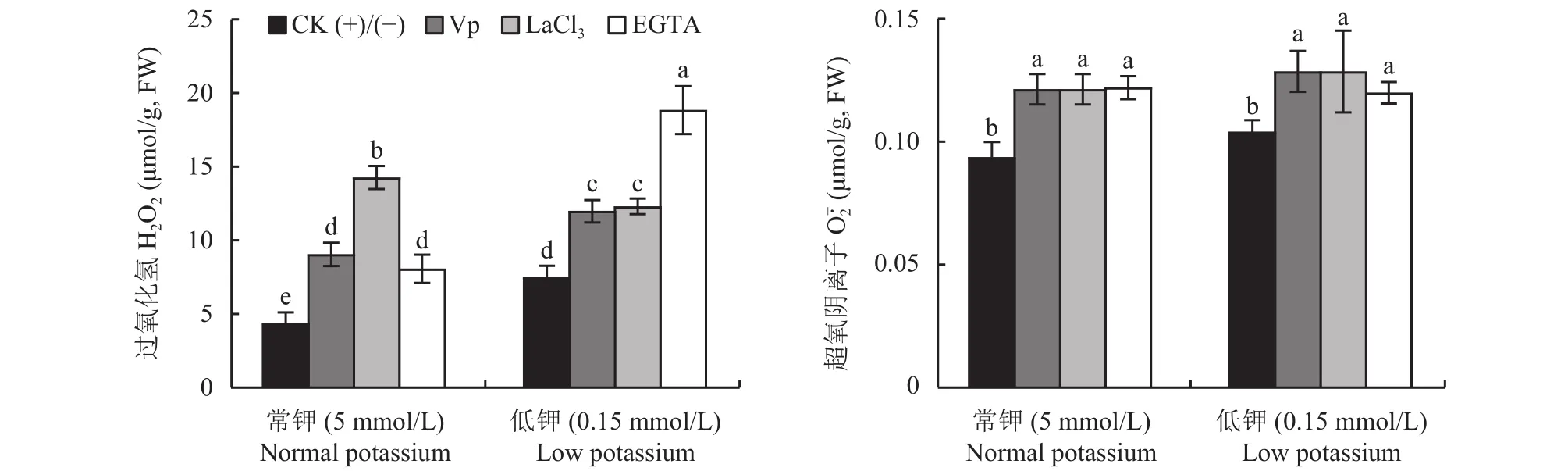
图2 不同钾水平下钙抑制剂处理对植株叶片活性氧积累量的影响Fig. 2 Effects of Ca inhibition treatments on accumulation of active oxygen of plants leaves under normal and low potassium levels
2.1.4 叶片抗氧化酶活性 如图3所示,不进行钙抑制处理,常钾水平植株叶片抗氧化酶过氧化物酶(POD)和超氧化物歧化酶(SOD)活性显著高于低钾处理。进行钙抑制剂处理后,常钾水平叶片Vp、LaCl3和EGTA处理的POD活性与CK(+)相比分别显著降低了51.00%、52.49%、60.60% (图3),低钾水平叶片Vp、LaCl3和EGTA处理的SOD活性与CK(-)相比分别降低了37.42%、33.81%和10.07% (图3)。

图3 不同钾水平下钙抑制剂处理对植株叶片抗氧化酶活性的影响Fig. 3 Effects of Ca inhibition treatments on antioxidant enzyme activities of plant leaves under normal and low potassium levels
2.2 不同钾水平下钙抑制剂处理对烟株叶片光合特性的影响
2.2.1 叶绿素含量 如表3所示,无钙抑制处理时,常钾水平下CK(+)叶片叶绿素a含量显著高于低钾水平CK(-),叶绿素b含量无差异。但从整体上看,两种钾水平下,3个钙抑制剂处理的叶绿素含量与CK(+)或CK(-)相比明显降低(叶绿素a含量低钾LaCl3处理除外),其中常钾水平下,3个钙抑制处理与CK(+)相比显著降低。低钾水平下,除施加Vp外,其余处理的叶绿素b含量与CK(-)相比显著降低,且Vp、LaCl3和EGTA叶绿素总含量与CK(-)相比分别降低了16.94%、12.42%和42.42%。

表3 不同钾水平下钙抑制剂处理植株叶片叶绿素含量(mg/g)Table 3 Chlorophyll content of plant leaves under different Ca inhibition treatments at normal and low K supply levels
2.2.2 叶片光合特性 如图4所示,除水汽压饱和亏外,无钙抑制处理时,低钾水平CK(-)与正常钾水平CK(+)相比,光合特性指标净光合速率、气孔导度、胞间CO2浓度、蒸腾速率、水分利用率分别显著降低了15.79%、20.24%、12.44%、23.08%、39.52%,无论常钾水平还是低钾水平下,3个钙抑制剂处理与CK(+)或CK(-)相比,叶片净光合速率、气孔导度、胞间CO2浓度、蒸腾速率和水分利用率均明显降低,其中净光合速率、胞间CO2浓度、水分利用率显著降低。常钾水平下,Vp、LaCl3、EGTA钙抑制剂处理的净光合速率与CK(+)相比分别显著降低了73.68%、46.05%、48.68%,低钾水平下分别显著降低了32.81%、21.88%、73.44%。常钾水平下,Vp、LaCl3、EGTA钙抑制剂处理的气孔导度与CK(+)相比分别显著降低了53.57%、32.14%、63.10%;胞间CO2浓度分别显著降低31.10%、15.78%、30.08%。低钾水平下,施加LaCl3、EGTA处理的蒸腾速率与CK(-)相比分别显著降低了35.00%、60.00%。无钙抑制处理时,低钾植株叶片的水汽压饱和亏显著高于常钾处理。2种钾水平下,3个钙抑制剂处理的水汽压饱和亏与CK(+)或CK(-)相比显著升高。低钾水平下,Vp、LaCl3、EGTA钙抑制剂处理的水分利用率与CK(-)相比分别显著降低了26.67%、32.00%、45.33%。
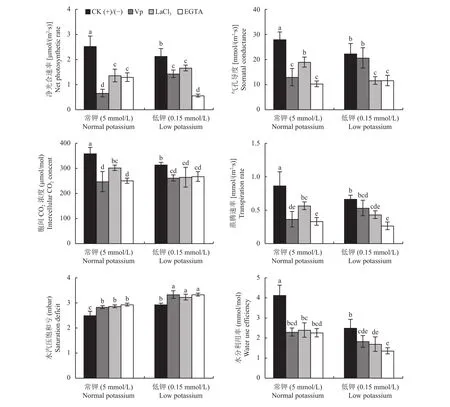
图4 不同钾水平下钙抑制剂处理对植株叶片光合特性的影响Fig. 4 Effects of Ca inhibition treatments on photosynthetic characteristics of plants leaves under normal and low potassium levels
2.3 不同钾水平下钙抑制剂处理对烟株体内钾素含量的影响
2.3.1 植株各部位钾含量 由表4可知,钾水平和钙抑制剂以及两者互作对植株地上部和根系钾含量的影响不同,钾水平对地上部和根系钾含量的贡献率均最高,分别为60.38%和79.77%;其次是钙通道抑制剂和螯合剂,贡献率分别达到32.09%和13.73%;两者互作对于钾含量的贡献率最低。
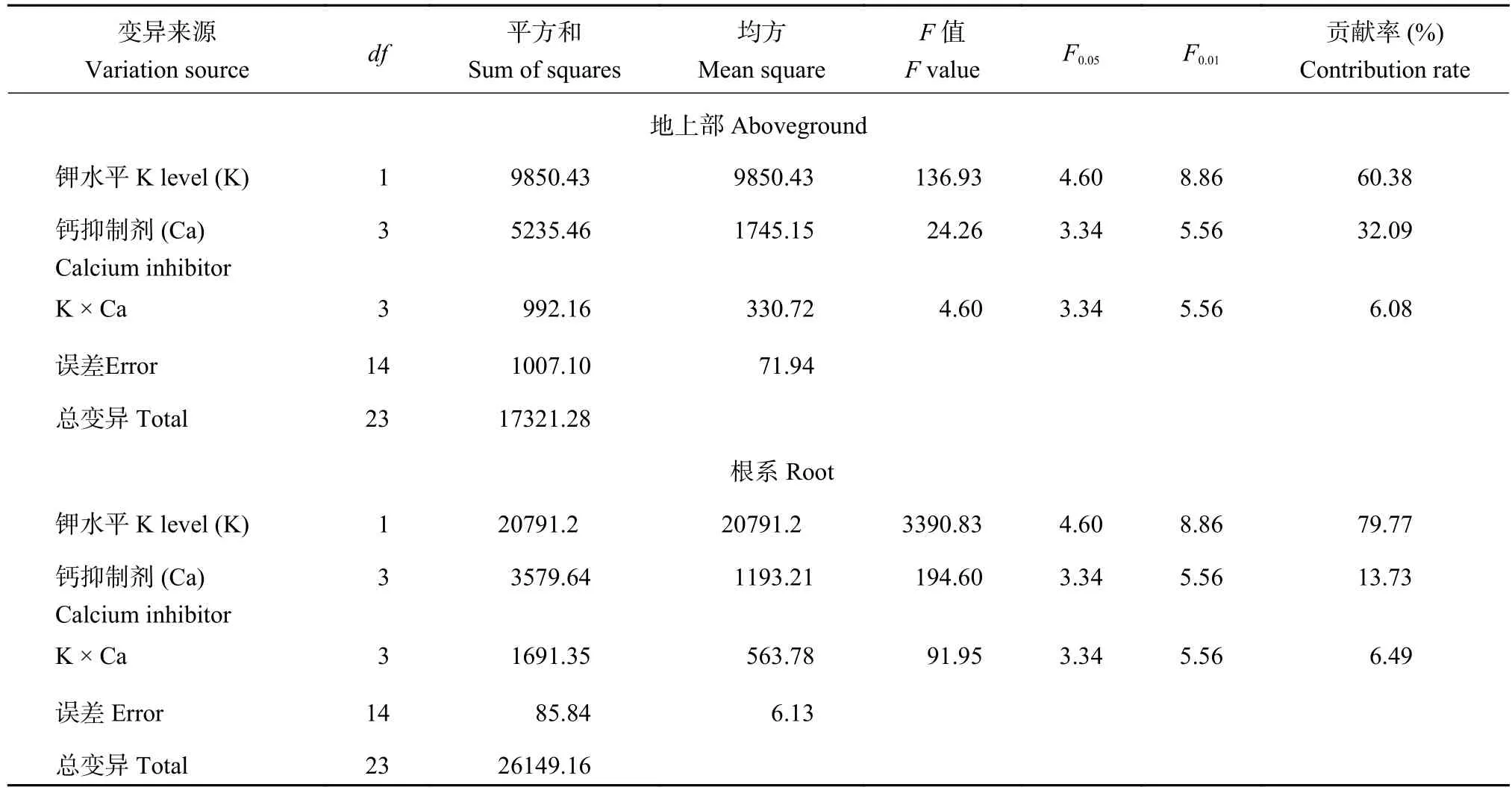
表4 不同的钾水平和钙通道抑制剂或螯合剂处理对植株钾含量影响的方差分析Table 4 Variance analysis of effects of different potassium levels and calcium channel inhibitor or chelating agents on potassium concentration in plant
如图5所示,无论是根系还是地上部,无钙抑制处理时,常钾水平下其钾素含量显著高于低钾水平,CK(-)比CK(+)地上部钾含量显著降低了39.31%,根系钾含量显著降低了77.05%。低钾水平下,Vp、LaCl3、EGTA钙抑制剂处理的地上部钾含量与CK(-)相比分别降低了22.95%、32.94%、20.73%,平均降低25.54%;根系钾含量分别显著降低了55.24%、62.34%、42.49%,平均降低53.36%。常钾水平下,添加钙通道抑制剂和螯合剂后烟株地上部和地下部钾含量也显著降低。

图5 不同钾水平下钙抑制剂处理对植株地上部及根系钾素含量的影响Fig. 5 K content in plant shoots and roots as affected by Ca inhibition under normal and low K supply levels
2.3.2 植株根系钾吸收及钙通道相关基因的相对表达量 如图6可知,低钾水平下植株根系中NKT2、NtKC1、NtHAK1、NtHAK5、NtCNGC1、NtCNGC11基因的相对表达量整体上高于常钾处理,其中,低钾水平CK(-)的NKT2、NtKC1、NtHAK1、NtHAK5基因的相对表达量与常钾水平CK(+)相比分别显著提高了2.09、3.32、3.23、12.34倍。低钾胁迫下,Vp、LaCl3、EGTA钙抑制剂处理的根系NKT2、NtKC1、NtHAK1、NtHAK5、NtCNGC1、NtCNGC11基因的相对表达量与CK(-)相比显著降低,其中NKT2基因的相对表达量分别降低了61.61%、55.48%、64.72%,平均降低了60.60%;NtKC1分别降低了34.95%、43.37%、73.53%,平均降低了50.62%;NtHAK1分别降低了34.09%、39.32%、42.43%,平均降低了38.61%;NtHAK5分别降低了80.28%、68.95%、60.14%,平均降低了69.79%;NtCNGC1分别降低了96.83%、98.59%、90.64%,平均降低了95.36%;NtCNGC11分别降低了81.65%、87.99%、91.47%,平均降低了87.05%。常钾水平下,当施加3个钙抑制处理时,根系中NtHAK1、NtHAK5基因表达量与未添加钙抑制剂时相比有明显增加,但NtCNGC1和NtCNGC11基因的相对表达量与CK(+)相比则显著降低。
3 讨论
本研究结果表明,与常钾水平相比低钾胁迫显著降低植株地上部及根系的干物质积累,这与实验室前期的研究[8,21]结果一致。前人研究表明,在低钾胁迫下过量的活性氧(ROS)会严重抑制植株的生长发育[22],而钙信号的有效传导可提高抗氧化酶活性,减轻活性氧积累并维持细胞膜稳定性[23]。本研究发现,低钾胁迫下施加钙信号抑制剂处理的植株抗氧化酶活性明显降低,ROS含量却显著升高,其原因可能是钙信号被抑制后植株无法通过提高自身抗氧化酶活性来降低活性氧引起的损伤。这说明钙信号传导在提高植株抗逆性中起重要作用。
烟草是一种喜光作物,光合作用是决定其产量品质的重要因素之一[24]。本研究发现,未施加钙信号抑制剂时,常钾水平下的光合特性(除水汽压饱和亏外)显著高于低钾处理,这与徐新翔等[25]研究结果一致,说明外界钾素水平可影响作物的光合作用。研究表明,逆境胁迫对叶绿素及光合机构的影响与活性氧的产生有关,活性氧可抑制光和系统PSⅡ损伤修复功能,但钙信号传导可直接激活一些抗氧化酶,并在逆境胁迫下维持光合系统的稳定性[26]。本研究表明,低钾胁迫下,施加钙抑制剂处理后,植株光合特性(除水汽压饱和亏外)及叶绿素总含量明显降低,这说明低钾胁迫下钙信号传导受到抑制后,烟草叶片叶绿素难以合成,进而影响植株的光合作用。结合活性氧的结果,本研究推测低钾胁迫下抑制钙信号传导后光合作用降低的可能原因是超量的ROS破坏了光合器官器质性[27],抑制了烟株叶绿素的合成及光合作用。
本研究发现,外施钙抑制剂处理可以显著影响低钾胁迫下烟草根系和地上部钾含量。未施加钙信号抑制剂时,低钾胁迫下,植株地上部及根系钾含量显著降低,这与王英锋等[8]研究结果一致,但在施加钙信号抑制剂后,两种钾水平处理下,植株地上部及根系钾含量显著降低,说明抑制钙信号传导后不利于烟株对钾的吸收。双因素方差分析结果表明,外界钾水平对烟株钾吸收的贡献率最高,地上部及根系分别为60.38%和79.77%,但施用钙抑制抑制剂抑制钙信号传导后,钙抑制剂与钾水平二者互作的贡献率急剧下降。由于在烟草钾吸收转运中K+通道和转运蛋白基因鉴定研究较少,因此本研究结合其他作物如拟南芥、水稻等并根据在烟草中鉴定出的基因,重点分析目前普遍公认的在低钾水平下参与调控植物钾吸收的几个重要的基因表达量。其中NKT2可调控细胞膜电压并负责参与K+转运,拟南芥中的AtKC1是根毛钾离子吸收通道的重要组成单位,HAK是钾离子高亲和转运蛋白,能介导植物根系对钾离子的吸收,并响应低钾胁迫[28-29],CNCG家族成员参与钠离子、钾离子及钙离子等阳离子的吸收,并调节植物生长发育,其中NtCNGC1、NtCNGC11在根中具有较高的表达量[30]。本试验中,未施加钙信号抑制剂时,低钾植株的钾吸收相关基因表达量显著高于常钾水平,说明低钾胁迫可增加钾吸收相关基因的转录水平,提高植株响应低钾的能力,但低钾水平属于一种逆境胁迫,低钾下植株钾素含量显著低于常钾植株。低钾胁迫下施加钙信号抑制剂后,植株根系中NKT2、NtKC1、NtHAK1、NtHAK5、NtCNGC1、NtCNGC11基因的相对表达量显著减少,研究认为钙信号通过调控根系中钾通道和转运蛋白相关基因的转录水平参与烟草钾素的吸收。近几年大量研究发现,钙信号传导参与调控植株体内钾转运蛋白和钾离子通道对K+的吸收,如低钾胁迫下,超量ROS诱导钙信号产生并激活CBLCIPK通路调控AtHAK5转录水平上调[31];AtCBL1-AtCIPK23复合物可磷酸化AtHAK5,增加AtHAK5对拟南芥根系吸钾的影响[32]。也有研究表明,低钾水平下编码AKT1通道阳性调节因子CIPK23基因的相对表达量增加,而编码AKT1通道的负调节因子CBL10基因的转录水平下调[33];OsAKT1介导的水稻根系钾离子吸收受OsCBL1-OsCIPK23复合物的调节等[34]。植物钾吸收是多种复杂代谢机制的综合体现[35]。例如,超量表达钾转运蛋白基因虽能促进植株的生长,但并不能增加钾的吸收和积累[36],本研究发现低钾胁迫下,施加钙通道抑制剂或螯合剂会显著增加植株地上部及根系生物量,但钾吸收相关基因表达量及钾含量却显著降低。本研究认为低钾胁迫下,钙信号与ROS之间存在某种关联,并通过调节植物体内抗氧化酶活性和钾吸收相关基因的表达介导植物吸钾,其具体机理有待进一步研究。
4 结论
低钾胁迫可明显抑制烟草叶片光合作用及钾吸收。低钾胁迫下,通过添加钙通道抑制剂或螯合剂抑制钙信号传导后可导致烟株叶片抗氧化酶活性和光合作用降低,活性氧积累,各部位钾含量和根系中NKT2、NtKC1、NtHAK1、NtHAK5、NtCNGC1、NtCNGC11的相对表达量减少,造成植株K+吸收量减弱。

