不同基因型谷子对干旱胁迫的调控机制
于国红,刘朋程,郝洪波,崔海英,郭安强,李明哲
(河北省农林科学院旱作农业研究所/河北省农作物抗旱研究重点实验室,河北衡水053000)
谷子是我国北方地区主要粮食作物之一,其脱壳后为小米,小米含有丰富的蛋白质、脂肪等营养物质,营养价值较高,其在膳食多样性和食品安全中是不可或缺的[1]。谷子的种植区域主要集中在北方干旱和半干旱地区,其中,河北省是种植面积较大的地区,但近年来,河北省地下水位严重下降,谷子生长季自然降水量呈减少趋势[2-3]。因此,对谷子抗旱性进行遗传改良迫在眉睫,而抗旱种质资源的鉴选和利用是抗旱育种的重要前提[4]。不同品种间抗旱性强弱差异较大,在利用抗旱种质资源前,应当对其进行抗旱性鉴定和筛选[5]。
干旱胁迫下,谷子植株体内生理变化、基因表达情况可作为评价其抗旱性的依据。由于谷子抗旱机制较为复杂,仅用某一生理指标或某一基因评价其抗旱性有失偏颇,因此本研究通过分析多个生理指标及多个相关基因在干旱胁迫下的变化,以期阐明不同基因型谷子抗旱调控机制。张海燕等[6]发现,渗透调节能力的大小会影响油菜对干旱的适应程度,脯氨酸、丙二醛和可溶性糖的含量可以作为体现作物抗旱能力的指标[7-8]。李云等[9]和朱永波等[10]认为,植物在受到干旱胁迫时,通过改变细胞体内抗氧化酶来维持活性氧的动态平衡,因此,可以将抗氧化酶作为鉴定抗旱的指标。随着栽培谷子基因组测序的完成与公布,有关谷子抗旱基因表达的研究逐渐增加。窦祎凝等[11]通过在拟南芥中过表达谷子基因SiNAC18进行干旱处理试验,结果表明SiNAC18可能通过 ABA 信号传导和氧化胁迫调控等途径来提高植物抗旱性。王新博等[12]研究发现,干旱胁迫诱导小麦植株中TaEF-1α基因上调表达,利用VIGS技术将TaEF-1α基因沉默后,植株叶片下垂,丙二醛含量显著升高,抗旱性降低。综合运用不同抗旱相关指标分析、隶属函数分析、聚类分析和转录组测序分析手段解析不同基因型谷子抗旱性调控机制。孟林等[13]和张娜等[14]对苜蓿和燕麦进行抗旱鉴定研究时发现,隶属函数分析和聚类分析得到的抗旱性结果较一致,两者共同分析更能增加置信度。本研究通过对不同基因型谷子进行抗旱性对比试验,从多方面综合评价其抗旱性,旨在为抗旱谷子种质筛选和新品种培育提供材料,为谷子抗旱调控机制提供理论依据。
1 材料与方法
1.1 试验设计
盆栽试验于 2020 年 6 月在河北省农林科学院旱作农业研究所移动防雨棚内进行,以豫谷18为对照,以衡谷13和农家品系239、280、290、428和718为供试材料。其中,衡谷13由河北省农林科学院旱作农业研究所培育,239、280、290、428和718由中国农业科学院作物科学研究所刁现民研究员课题组提供。营养土与蛭石按2∶1的比例混合作为培养基质,将每个品种(系)12粒种子点播于白色塑料盆(长80 cm、宽50 cm、高40 cm)中,每盆7个品种(系),一个品种(系)一行。每个品种(系)3个处理:1)全生长期正常供水;2)谷子8叶期起用12% PEG-6000进行干旱胁迫处理,直到取样; 3)干旱胁迫处理1周后,恢复正常供水。每个处理6个重复。干旱胁迫处理前和出现表型后分别取样,样品于液氮中速冻,后储存于-80℃冰箱中,用于后续生理指标测定和转录组测序试验。
1.2 测定指标与方法
1.2.1 生理指标 丙二醛 (malondialdehyde,MDA)含量采用硫代巴比妥酸法测定[15];脯氨酸(proline,Pro)含量采用酸性茚三酮法测定[16];可溶性糖(soluble sugar,SS)采用蒽酮比色法测定[17]。超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑法测定[18];过氧化物酶(peroxidase,POD)活性采用愈创木酚法测定[19];过氧化氢酶(catalase,CAT)活性采用紫外吸收法测定[20]。
1.2.2 转录组测序 采用Trizol法提取样品RNA,用Nanodrop 2000测 OD260、OD280值。为保证测序所用到的RNA 的质量达到标准,利用琼脂糖凝胶电泳检测 RNA 降解和污染情况。测序利用HiSeqTM2500来完成,测序实验和数据初步分析由华大基因科技股份有限公司完成。
1.3 数据处理
数据处理和作图分析利用 Microsoft Excel 2013、SPSS 24.0 、Adobe Photoshop CS5 和 Adobe Illustrator CS5软件完成。
2 结果与分析
2.1 不同供水条件下不同基因型谷子的农艺性状
谷子农艺性状调查结果(表1)显示,谷子株高因基因型不同呈现不同程度的差异;同时,生物量也呈现不同程度的差异。与正常供水条件处理相比,干旱处理条件下豫谷18和239的生物量分别减少0.75和0.85 g,而衡谷13、280和290的生物量降低了0.60~0.80 g,而428和718的生物量分别降低1.02和0.77 g;与干旱条件下相比,复水条件下豫谷18、衡谷13、239、280和290的生物量分别升高了0.09、0.16、0.32、0.15和0.13 g,而428和718由于抗旱性弱,复水后未出现明显复活状态。不同基因型谷子抗旱性表现不同。
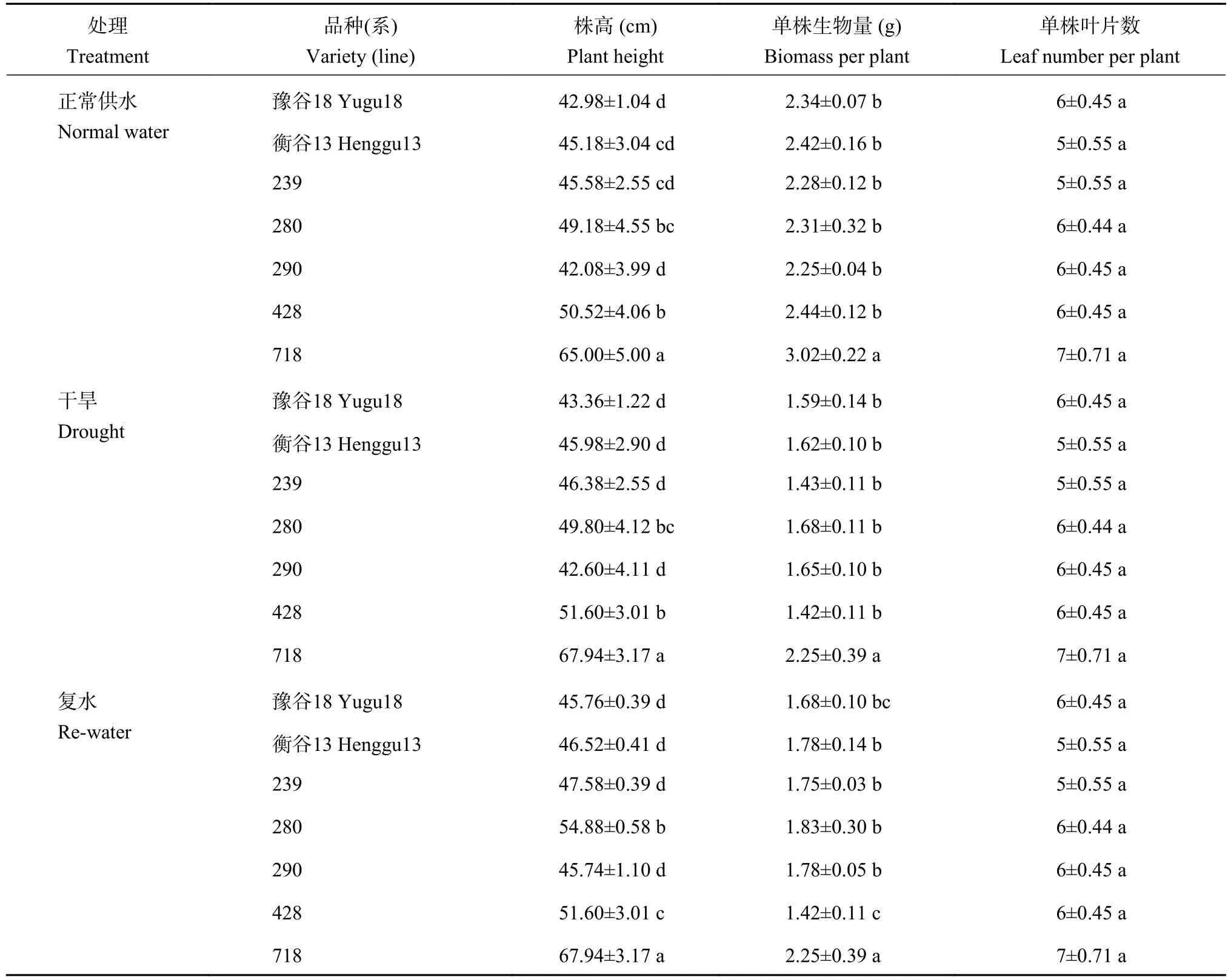
表1 不同供水条件下不同基因型谷子的农艺性状Table 1 Agronomic traits of different foxtail millet genotypes under different water conditions
2.2 不同供水条件下不同基因型谷子茎部胞容物含量分析
正常供水条件下,7个谷子品种(系)茎部脯氨酸、丙二醛和可溶性糖含量无显著差异。干旱胁迫条件下,与品种豫谷18相比,品种衡谷13和品系239、280及290脯氨酸含量显著升高了10.37~51.75 μg/g;而品系428和718分别比豫谷18低6.87和16.45 μg/g。复水后,与干旱处理相比,每个品种(系)中的脯氨酸含量都有所降低,品种豫谷18、衡谷13和品系239、280、290、428及718茎部脯氨酸含量均降低,降低幅度为14.47~49.18 μg/g(图1A)。
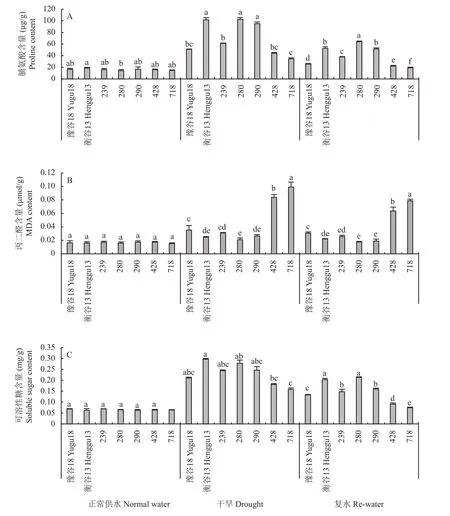
图1 不同水分条件下不同基因型谷子茎部部分胞容物含量Fig. 1 Some cellular content in the stem of different genotypes of foxtail millet under different water conditions
干旱胁迫条件下,与品种豫谷18相比,品种衡谷13和品系280、290及239丙二醛含量降低11.84%~40.46%;品系428和718较豫谷18丙二醛含量均显著升高。与干旱处理相比,复水处理后,豫谷18、衡谷13和品系239、280、290、428及7 1 8茎部丙二醛含量均降低,降低幅度为10.34%~28.66% (图1B)。
干旱胁迫条件下,与品种豫谷18相比,品种衡谷13和品系239、280及290可溶性糖含量分别显著升高40.99%、16.04%、33.28%和19.12%;品系428和718较豫谷18分别显著降低14.04%和24.64%。复水后,与干旱处理相比,豫谷18、衡谷13和品系239、280、290、428及718茎部可溶性糖含量均降低,降低幅度分别为36.82%、31.51%、39.53%、23.32%、35.26%、49.94%和53.28% (图1C)。
2.3 不同供水条件下不同基因型谷子茎部抗氧化酶活性变化
正常供水条件下,在7个品种(系)中3种抗氧化酶活性无显著性差异。干旱条件下,与豫谷18相比,衡谷13和品系239、280及290的SOD活性升高6.99%~57.52%,而品系428和718与豫谷18没有显著差异。复水后,豫谷18、衡谷13和品系239、280、290、428及718茎部SOD活性均比干旱条件下同一品种有所降低,降低幅度为6.93%~33.02% (图2A)。
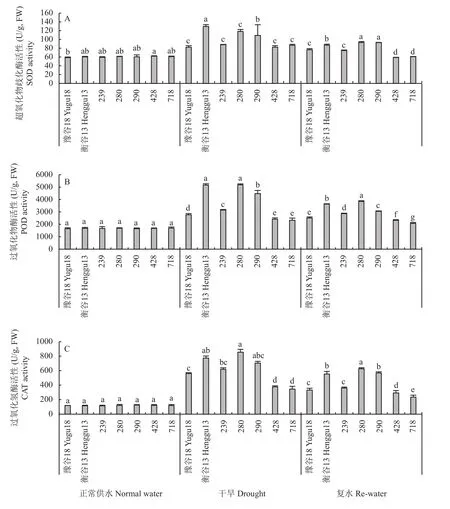
图2 不同条件下不同基因型谷子茎部部分抗氧化酶活性Fig. 2 Some antioxidant enzyme activities in the stem of different genotypes of foxtail millet under different conditions
干旱胁迫下,衡谷13和品系239、280及290的POD活性分别比豫谷18显著提高了86.25%、13.54%、87.08%和61.70%,而品系428和718较豫谷18分别显著降低12.85%和15.95%。复水后,与干旱胁迫条件下对应品种(系)相比,豫谷18、衡谷13和品系239、280、290、428及718茎部POD活性分别降低9.26%、29.66%、9.13%、25.82%、31.85%、3.90% 和 10.90% (图2B)。
干旱胁迫下,各品种茎部的CAT活性比正常供水均显著增加。与豫谷18相比,衡谷13和品系239、280及290的CAT活性均升高,升高幅度为11.34%~52.54%;品系428和718较豫谷18分别降低32.79%和38.45%。复水后,与干旱胁迫条件下对应品种(系)相比,豫谷18、衡谷13和品系239、280、290、428及718茎部CAT活性均降低,降低幅度为19.43%~41.82% (图2C)。
2.4 隶属函数分析及聚类分析
根据茎部生理指标计算的隶属函数结果(表2)可知,干旱胁迫和复水后,隶属度较大的为衡谷13和品系280,隶属度最小的为品系718。根据综合隶属度最终得出各品种(系)抗旱性由强到弱依次为280、衡谷13、290、239、豫谷18、428和718。各品种(系)在干旱胁迫下生理指标的聚类分析结果(图3)显示,当卡方距离为11时,7个品种(系)聚为3类,第一类为抗旱性强的品系280、衡谷13和品系290;第二类为抗旱性中等品系239和豫谷18,第三类为抗旱性弱的品系428和718。

表2 茎部生理指标隶属函数值及品种(系)抗旱性分析Table 2 Subjection function values of stem physiological indexes and drought resistance analysis of cultivars
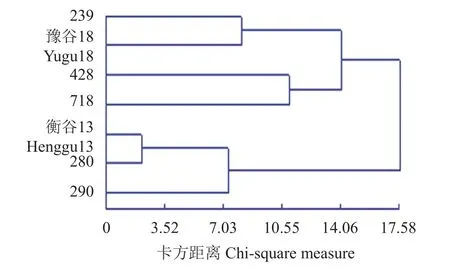
图3 干旱胁迫下不同基因型谷子抗旱性聚类分析Fig. 3 Cluster analysis of drought resistance of different genotypes of foxtail millet under drought stress condition
2.5 不同供水条件下不同基因型谷子转录组测序分析
现从不同类型抗旱水平品种(系)中选出豫谷18、衡谷13和428这3个具有代表性的品种(系)进行转录组测序分析,用以辅助解析不同基因型谷子品种(系)抗旱分子机理。如图4A所示,4个组合中的差异表达基因(DEGs)数目表现出明显差异性,PEG0_13 VS PEG0_18对比组中有11773个DEGs;PEG0_428 VS PEG0_18 对比组中有17817个DEGs;PEG12_13 VS PEG12_18 对比组中有 14434 个DEGs;PEG12_428 VS PEG12_18 对比组中有17215个DEGs。PEG0_13 VS PEG0_18对比组与PEG12_13 VS PEG12_18 对比组之间有 8357 个共同的DEGs;PEG0_428 VS PEG0_18对比组与PEG12_428 VS PEG12_18 对比组之间有 13112 个共同的DEGs。
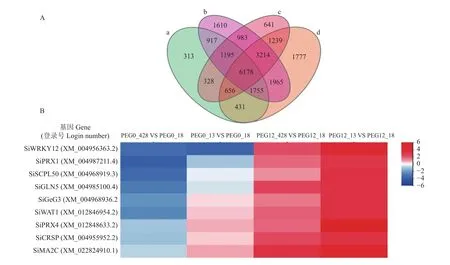
图4 水分正常和胁迫条件下不同基因型谷子中部分差异表达基因的特征Fig. 4 Characteristics of partial differential expression genes (DEGs) in different genotypes of foxtail millet under normal and water stress conditions
如图4B所示,正常供水情况下,品种衡谷13与品种豫谷18相比,前两者中的抗逆相关基因整体相对表达量不高,但是,它们在衡谷13中的相对表达量略高于在品系428中的相对表达量。干旱胁迫条件下,干旱胁迫相关的转录因子、氧化酶类基因在衡谷13中的相对表达量显著高于在428品系中的相对表达量。
用GO富集分析图来表述每一个 GO (基因本体化,gene ontology) term 中 DEGs (差异表达基因)的最终分配情况(图5A)。基因SiWRKY12、SiPRX1和SiPRX4通过调控过氧化物酶活性参与氧化胁迫反应;基因SiSCPL50和SiCRSP通过调控氧化还原酶活性参与丝氨酸类肽酶水解反应;基因SiWAT1和SiPRX4通过细胞膜组分参与跨膜转运;基因SiGLN5主要参与谷氨酰胺合成酶生物合成过程。通过KEGG(京都基因和基因组百科全书,kyoto encyclopedia of genes and genomes,http://www.kegg.jp)富集分析来研究DEGs在各种代谢途径中的富集情况(图5B)。基因在SiPRX1和SiPRX4在次生代谢物的水平上参与类苯基丙烷生物合成的次生代谢途径;基因SiGLN5和SiGeG3从能量代谢水平上分别参与氨基酸生物合成和和碳水化合物的代谢途径;基因SiWRKY12在信号转导水平上通过参与MAPK信号途径来调控干旱胁迫应答及植物-病原互作的防御反应。

图5 不同供水条件下不同基因型谷子中部分DEGs的GO和KEGG特征Fig. 5 GO and KEGG characteristics of DEGs in different genotypes of foxtail millet under different water conditions
3 讨论
3.1 不同基因型谷子的抗旱生理水平
干旱胁迫条件下,植物受体内脯氨酸含量会明显增加,从而通过降低植株内渗透势,促进抗旱能力提高[21]。干旱胁迫下,植物膜脂过氧化作用会产生丙二醛,其含量的增加明显破坏植物细胞膜结构,从而降低植物的抗旱性[22]。植物体内可溶性糖是渗透调节物质,及细胞内重要有机溶质,可调节谷子对不利环境(如干旱胁迫)的适应能力[23]。干旱胁迫下,植物体内可溶性糖含量明显高于正常供水处理,谷子品种抗旱性越强,可溶性糖含量越高[24]。
本研究结果表明,正常供水条件下,谷子各品种(系)茎部脯氨酸、丙二醛和可溶性糖含量均无显著性差异。干旱胁迫下,各品种(系)茎部脯氨酸和可溶性糖含量都明显增加,但是增加幅度有差异,增加幅度由大到小的品种(系)依次为衡谷13、280、290、豫谷18、428和718。MDA是植物受逆境胁迫时膜脂过氧化的最终产物之一,对细胞有严重的毒害作用,会严重损伤生物膜,所以丙二醛含量是用来判断植物体内细胞遭受干旱胁迫程度大小的常用指标。在干旱胁迫下,植物体内MDA含量越低,细胞膜受损程度越低,抗旱性越强;反之,MDA含量越高,细胞膜受损程度越高,抗旱性越弱[21]。干旱条件下,品种(系)衡谷13、280和290中丙二醛含量低于品种豫谷18中的含量,而428和718品系中丙二醛含量显著高于豫谷18中的含量。综合分析上述结果初步得出结论,干旱胁迫下,与豫谷18相比,品种(系)衡谷13、280和290细胞的毒害和损伤程度较低,抗旱能力较强;428和718则相反。
干旱条件下,植物体内会产生超氧自由基、过氧化氢等活性氧,活性氧的积累会导致脂类、核酸以及糖类物质的损伤。植物需动员整个防御系统如SOD、POD和CAT来抵抗过氧化带来的伤害,而防御系统中抗氧化酶活性的高低决定了植物受伤害的程度,从而反映植物对逆境的耐受能力[25]。本研究结果表明,与正常供水相比,干旱条件下各品种(系)SOD、POD、CAT活性都明显增加。与豫谷18相比,干旱胁迫下衡谷13、239、280和290的SOD、POD、CAT活性均增加,而品系428和718中的POD、CAT活性均降低。说明干旱胁迫下,品种(系)衡谷13、280和290能够迅速清除干旱胁迫产生的自由基,可以更好地抵抗干旱胁迫,而品系428和718清除自由基速度相对缓慢,更容易受到过氧化伤害。
3.2 不同基因型谷子的抗旱分子水平
干旱胁迫下,植物中与抗旱相关的转录因子如AP2、ZF和WRKY等表达量明显上调。前人研究表明,玉米转录因子ZmWRKY106提高了转基因植株的抗旱和抗热性[26]。转录因子GmWRKY12促使大豆的耐旱耐盐性提高[27]。杜梨转录因子PbrWRKY53通过调控基因PbrNCED1的表达来参与维生素C的生成,从而对提高植物的抗旱性起到积极作用[28]。转录因子基因SiWRKY12(登录号:M_004956363.2)在PEG12_13 VS PEG12_18对比组和PEG12_428 VS PEG12_18对比组中的相对表达量分别为3.16和2.37,而在PEG0_13 VS PEG0_18 对比组和PEG0_428 VS PEG0_18对比组中的相对表达量在0.45左右,此结果表明,基因SiWRKY12在干旱胁迫下表达量明显上调,可能通过参与MAPK信号转导代谢途径来提高作物的抗旱性。前人研究表明,过表达基因AgAPX1拟南芥通过增加抗坏血酸含量来提高转基因株系的抗旱性[29]。过氧化物酶基因SiPRX1(登录号:XM_004987211.4)在 PEG12_13 VS PEG12_18 对比组和PEG12_428 VS PEG12_18对比组中的相对表达量分别为4.04和2.25,而在PEG0_13 VS PEG0_18对比组和PEG0_428 VS PEG0_18对比组中的相对表达量在−3.45左右,此结果表明,基因SiPRX1在干旱胁迫下表达量明显上调,其可能通过参与抗氧化反应途径来提高作物的抗旱性。研究表明,干旱条件下谷氨酰胺合成酶突变体GS2中脯氨酸含量明显低于野生型,表明GS2参与脯氨酸响应干旱胁迫的代谢途径[30]。过表达谷氨酰胺合成酶基因TaGSs烟草的抗旱性明显高于受体[31]。过表达松树谷氨酰胺合成酶基因GS1a引起转基因白杨的抗旱性增强[32]。谷氨酰胺合成酶同工酶基因SiGLN5(登录号:XM_004985100.4)在 PEG12_13 VS PEG12_18 对比组和PEG12_428 VS PEG12_18对比组中的相对表达量分别为3.3和1.39,而PEG0_13 VS PEG0_18 对比组和PEG0_428 VS PEG0_18对比组中的相对表达量为−0.3和−2.28,结果表明,基因SiGLN5在干旱胁迫下表达量明显上调,并且在衡谷13中表达量明显高于品系428。研究发现,抗旱小麦与干旱敏感小麦的蛋白质组学分析结果表明,前者中的葡聚糖内-1,3-β-葡糖苷酶蛋白丰度明显高于后者中该蛋白的丰度[33]。葡聚糖糖苷酶基因SiGeG3(登录号:XM_004968936.2)在 PEG12_13 VS PEG12_18 对比组和PEG12_428 VS PEG12_18对比组中的相对表达量分别为5.38和1.66,而在PEG0_13 VS PEG0_18 对比组和PEG0_428 VS PEG0_18对比组中的相对表达量为0.72和−1.03,此结果表明,基因SiGeG3在干旱胁迫下表达量明显上调,并且在衡谷13中表达量显著高于品系428。在干旱条件下,428、豫谷18和衡谷13品种(系)中的抗旱基因上调表达程度依次提高,这表明3个品种(系)的抗旱性依次增强,此结果与生理指标测定结果相符,进一步为不同基因型谷子抗旱性鉴定提供了分子理论依据。
4 结论
供试7个谷子品种(系)中,抗旱性较强的品种(系)为280、衡谷13和290,抗旱性中等的品种(系)为豫谷18和239,抗旱性较差的为品系428和718。不同品种(系)通过启动体内WRKY等转录因子和谷氨酰胺合成酶等生物功能基因,使其不同程度地表达而改变部分胞容物含量和抗氧化酶活性,最终实现自身不同的抗旱性。

