二甲双胍通过FGFR4/MST1信号通路抑制皮肤瘢痕疙瘩成纤维细胞的上皮间质转化
张永红,李存涛,高明敏,张玉红
(郑州大学附属郑州中心医院 皮肤科,河南 郑州 450052)
瘢痕疙瘩是一种引起人体不适、机体功能受限以及心理障碍的皮肤疾病,瘢痕疙瘩内部常表现出缺血低氧特征[1- 3]。目前已证明上皮间质转化(epithelial- mesenchymal transition, EMT)是参与瘢痕疙瘩形成和发展的关键细胞学改变[2- 3]。二甲双胍(metformin, MET)是一种可以抑制肿瘤和糖尿病中EMT的关键药物[4- 5];MET在体外也可抑制瘢痕疙瘩形成[6]。然而MET诱导抑制瘢痕疙瘩的完整机制仍然未知,因此本研究观察MET对瘢痕疙瘩成纤维细胞(keloid fibroblasts,KFs)EMT的作用并探讨其机制。
1 材料与方法
1.1 临床样本
瘢痕疙瘩标本及邻近正常皮肤组织采集于我院皮肤科。4例瘢痕疙瘩患者均为黄种女性,年龄分别为26、31、32、35岁,瘢痕疙瘩位置均在耳垂。本研究中执行的所有程序均经我院医学伦理委员会批准,所有受试者均签署知情同意书。
KFs EMT的方法:在低氧培养箱中培养KFs以诱导EMT,KFs分为对照组和低氧组。用MET或其溶剂生理盐水(生理盐水组)低氧诱导KFs:在MET和低氧条件下用纤维母细胞生长因子受体4(fibroblast growth factor receptor 4,FGFR4)过表达载体(FGFR4overexpression vector,FGFR4- OE)或空载体(empty vector,EV)处理KFs或者在MET和低氧条件下用重组人(recombinant human,rh)巨噬细胞刺激1(macrophage stimulate 1,MST1)蛋白(rhMST1)处理KFs。
1.2 试剂与耗材
rhMST1(ab158921)购于美国Abcam公司。杜氏改良培养基(DMEM)和胎牛血清(10099- 141)购于美国Gibco公司。MET购于美国派普泰克公司。FGFR4- OE和空载体(empty vector, EV)购于上海GenePharma公司。Lipofectamine 2000试剂购于美国Invitrogen公司。细胞计数试剂盒- 8(CCK- 8)、PrimeScript RT反应混合物逆转录RNA试剂盒、Trizol试剂盒、SYBR Premix Ex Taq试剂盒购于上海碧云天公司。蛋白酶抑制剂的RIPA 缓冲液、聚偏二氟乙烯膜购于美国Sigma 公司。抗人FGFR4、E- 钙黏蛋白、抗人波形蛋白、抗人MST1一抗购于美国Cell Signaling Technology公司。
1.3 细胞培养
原代人KFs根据文献[6]报道进行分离。手术切除人瘢痕疙瘩组织的表皮和脂肪组织,只保留纤维组织的真皮层,随后切成小块。组织小块在包含1倍胶原酶裂解缓冲液的DMEM中消化2 h,4 ℃下1 500 r·min-1离心5 min后,收集沉淀物并在补充有1%的青霉素-链霉素和15%胎牛血清的DMEM(37 ℃、5%CO2)中培养。
1.4 细胞活力检测
CCK- 8实验用于测量细胞活力。将KFs(每孔1×104个)接种到96孔板中。分别在常氧下(设为对照组)和低氧培养箱(37 ℃、1%O2、5%CO2、94%N2)中培养,低氧培养箱中细胞再分为生理盐水组和MET组两组。对照组细胞培养24 h,低氧培养的两组分别加生理盐水24 h或10 mmol·L-1MET处理细胞 24 h后,每孔加入10 μl CCK- 8,37 ℃孵育2 h。使用酶标仪在450 nm 处测量3组的吸光度值。
1.5 低氧培养条件下KFs细胞的处理与分组
根据制造商提供的说明,使用Lipofectamine 2000试剂将25 μmol·L-1的FGFR4- OE或25 μmol·L-1的EV转入KFs细胞。将转染的细胞培养24 h,并收集用于实时定量PCR(quantitative real- time PCR, qRT- PCR)和蛋白免疫印迹分析。
根据是否使用MET治疗、联合使用FGFR4过表达,或联合使用rhMST1处理KFs,将KFs在低氧条件下进行实验观察。KFs在低氧条件下培养24 h,分为MET组、生理盐水组、MET联合FGFR4过表达载体转染(MET+FGFR4- OE)组、MET联合空载体(EV)(MET+EV)组、MET联合rhMST1、MET+rhMST1组。MET在4 ℃下以10 mmol·L-1的浓度储存。低氧培养环境下,MET组用10 mmol·L-1MET处理细胞24 h; 生理盐水组用等体积的生理盐水处理细胞24 h;MET+FGFR4- OE组在转染25 μmol·L-1FGFR4- OE的同时用10 mol·L-1MET处理细胞24 h;MET+EV组在转染25 μmol·L-1EV的同时用10 mmol·L-1MET处理细胞24 h,MET+rhMST1组用10 mmol·L-1MET和6 mmol·L-1rhMST1处理细胞24 h。
1.6 qRT- PCR
用Trizol试剂盒提取FGFR4- OE组和EV组KFs的总RNA。根据制造商提供的说明,使用PrimeScript RT反应混合物逆转录RNA。随后的定量PCR在7500 qPCR系统中使用SYBR Premix Ex Taq试剂进行。具体引物如下:FGFR4:正向5′- GTGCTGCTGCTCGTGGTCCCTA- 3′,反向3′- GCTTCGCGTAGGACGAAGGTGTGTC- 5′;Twist- 1:正向5′- CATTCTCAAGAGGTCGTGCCA- 3′,反向5′- CAGGCCAGTTTGATCCCAGTA- 3;E- 钙黏蛋白:正向5′- GCCCTGCCAATCCCGATGAAA- 3′,反向5′- GGGGTCAGTATCAGCCGCT- 3′;波形蛋白:正向5′- GCTTCAGAGAGAGGAAGCCGAAAA- 3′,反向5′- CCGTGAGGTCAGGCTTGGAAA- 3′;β- 肌动蛋白:正向5′- ACCGAGCGCGGCTACA- 3′,反向3′- CAGCCGTGGCCATCTCTT- 5′。根据制造商的协议,qPCR在总体积20 μl的反应混合物中进行,并按以下步骤进行扩增:95 ℃ 10 min,然后95 ℃ 15 s和60 ℃ 60 s循环40次。生物学重复为3。2-ΔΔCt方法用于计算,其中ΔCt=Ct目标基因-Ctβ- 肌动蛋白,ΔΔCt=ΔCt测定值-ΔCt校正值。
1.7 蛋白免疫印迹实验
离心收集MET组、生理盐水组、MET+FGFR4- OE组、MET+EV组、MET+rhMST1组的KFs,并用磷酸盐缓冲液洗涤。细胞在含有蛋白酶抑制剂的RIPA缓冲液中裂解。裂解物通过十二烷基硫酸钠- 聚丙烯酰胺凝胶电泳分离,随后经电印迹转移到聚偏二氟乙烯膜上。在用5%脱脂牛奶封闭后,将膜与一抗在4 ℃下孵育过夜。一抗包括抗人FGFR4、E- 钙黏蛋白、抗人波形蛋白、抗人MST1和β- 肌动蛋白。然后将印迹与二抗在室温下孵育 2 h。每个实验重复3次。使用ECL系统(GE Healthcare)和Luminescent Image Analyzer LAS3000(富士胶片)将目标蛋白条带显色。用Imgae J软件进行定量分析。
1.8 迁移小室法检测细胞的迁移
收集对照MET组、生理盐水组、MET+FGFR4- OE组、MET+EV组、MET+rhMST1组细胞,调整细胞为105个·ml-1,加入到的transwell小室的上室。温育12 h 后,使用细胞用无菌棉签小心除去膜上表面的细胞。最后将已经穿透侵入膜下表面的细胞用甲醇固定,用10%的Gimsa染色溶液染色15 min,并在显微镜下进行细胞计数。
1.9 统计学处理
采用SPSS 20.0统计软件进行统计学处理。计量数据以均值±标准差表示,正态分布且方差齐性的数据采用单因素方差分析,组间两两比较采用LSD检验;方差不齐的数据采用Dunnett’s T3检验。P<0.05为差异具有统计学意义。非正态分布的数据采用非参数检验。
2 结 果
2.1 二甲双胍抑制低氧诱导下KFs的增殖活性
检测MET对低氧环境中KFs增殖活力的影响,结果(图1)显示,低氧诱导下KFs的增殖率明显高于对照组(P<0.05)。而低氧下加入10 mmol·L-1的MET处理24 h后,与生理盐水组相比,MET组KFs的增殖率明显降低(P<0.05)。

a与对照组比,P<0.05; b 与生理盐水组比,P<0.05
2.2 MET抑制低氧诱导下KFs的迁移
进一步评估MET对低氧环境中KFs迁移能力的影响,结果如图2所示,低氧下加入10 mmol·L-1的MET处理24 h后,与生理盐水组比较,MET组KFs的迁移数目明显减少(P<0.05)。

a 与生理盐水组比较,P<0.05
2.3 MET调控KFs中EMT标志物和FGFR4/MST1信号蛋白的表达
通过蛋白免疫印迹法分析MET对FGFR4、MST1和EMT标志物Twist- 1、E- 钙黏蛋白、波形蛋白的表达,结果如图3。与生理盐水组比,MET组中FGFR4、MST1、Twist- 1、波形蛋白的表达量明显降低,而E- 钙黏蛋白的表达明显增加(P<0.05)。

a 与生理盐水组比较,P<0.05
2.4 FGFR4促进KFs中MST1的表达并诱导EMT
KFs细胞转染FGFR4- OE或EV。与EV组比较,FGFR4- OE组FGFR4的mRNA和蛋白水平都增加(均P<0.05),并且MST1的表达显著增加(均P<0.05)。FGFR4- OE组迁移细胞数和EMT标志物Twist- 1、波形蛋白的表达量均明显增高,且E- 钙黏蛋白的表达明显降低(均P<0.05)。见图4。
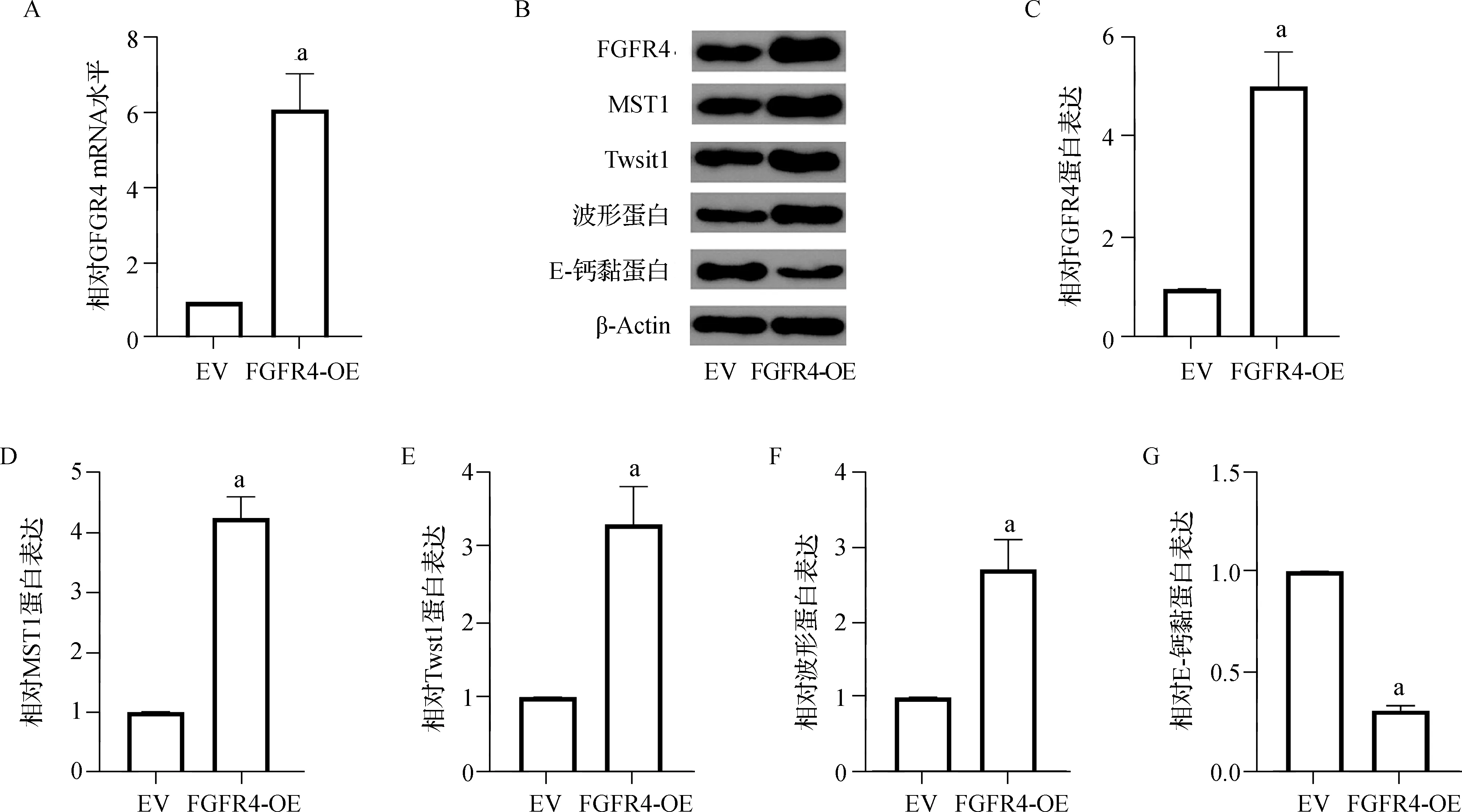
a 与EV组比较,P<0.05
2.5 MET通过抑制FGFR4/MST1通路抑制KFs的EMT
进一步研究MET影响瘢痕疙瘩EMT调控的机制,结果显示:与MET+EV组比,MET+FGFR4- OE组中细胞的迁移细胞数和EMT标志物Twist- 1、波形蛋白的mRNA表达量均明显增高,且E- 钙黏蛋白明显降低(均P<0.05);而与MET组比,MET+rhMST1组中迁移细胞数以及EMT标志物Twist- 1、波形蛋白的mRNA表达量都明显增高,且E- 钙黏蛋白明显降低(均P<0.05)。见图5。这表明MET可以抑制EMT,且其机制是通过抑制FGFR4/MST1通路抑制KFs的EMT。

a 与MET组比较,P<0.05; b 与MET+EV组比较,P<0.05
3 讨 论
KFs是瘢痕疙瘩进展的主要诱导细胞。越来越多的研究认为KFs的EMT是诱导瘢痕疙瘩进展的关键因素[7],因此我们以KFs为研究对象,着重探讨KFs在经MET处理后细胞增殖、迁移、EMT标志物的表达变化。根据本研究结果,我们发现:(1) 低氧诱导下KFs的增殖能力增加、迁移细胞数目增多,并且EMT标志物的表达明显上调;(2) 抑制KFs中的FGFR4/MST1信号通路是MET抑制KFs增殖能力、迁移和EMT标志物表达的关键机制。本研究显示MET可通过降低FGFR4和MST1来逆转EMT,表明MET参与 FGFR4/MST1信号通路的失活以抑制瘢痕疙瘩的发展。
大量研究表明,FGFR4在促进上皮细胞的EMT和细胞迁移中起着关键作用[8- 9]。FGFR4通过EMT促进细胞纤维化[10- 11]。瘢痕疙瘩主要发生在外伤后,皮肤血管网络被破坏,导致局部组织的低氧环境。此外,组织损伤引起的炎症和修复过程中的高代谢状态会显著增加耗氧量并加剧低氧[12]。因为低氧微环境下,瘢痕疙瘩中的FGFR4往往上调,而且配体FGF23/FGFR4信号明显促进心肌细胞的EMT和迁移能力[13- 14]。我们的研究结果证明,FGFR4过表达可以明显促进KFs的EMT和迁移能力,而MET可以通过抑制FGFR4表达阻碍KFs的EMT和迁移。
MST1是哺乳动物肿瘤抑制通路的核心激酶,新发现的证据亦支持MST1在许多人类疾病如肝脏和肠道再生、先天免疫疾病[15- 16]中发挥微妙而复杂的作用。有研究表明MST1可调控细胞EMT[17- 18]。本研究也观察到,人重组MST1蛋白能抑制KFs的迁移和EMT标志物Twist- 1、波形蛋白的表达,并促进E- 钙黏蛋白的表达。多项研究表明,MST1是FGFR4特异性底物,而且MST1是FGFR4相关信号通路的关键下游效应因子[19]。本研究在KFs中过表达了FGFR4,同样观察到MST1的蛋白表达被FGFR4显著上调。不仅如此,低氧诱导下,在FGFR4表达增高的同时,MST1表达也增高。本研究中我们观察到FGFR4/MST1信号轴对低氧诱导下KFs的EMT至关重要,因为过表达FGFR4不仅促进了MST1的表达,同时逆转了MET对低氧条件下EMT的抑制作用,而人重组MST1蛋白明显促进KFs的迁移和EMT标志物的表达。我们的研究结果表明FGFR4/MST1信号参与了瘢痕疙瘩的EMT。
MET已被证实还可以发挥抗瘢痕疙瘩的作用[6]。本研究同样观察到MET对KFs增殖和迁移的抑制作用,而且MET可以通过抑制FGFR4/MST1信号通路逆转KFs中低氧诱导的EMT。
综上所述,本研究表明,低氧环境通过激活FGFR4诱导的EMT促进了KFs的迁移,MET通过FGFR4/MST1信号通路抑制KFs中低氧诱导的EMT。基于上述研究数据,我们提出FGFR4/MST1通路参与低氧诱导的瘢痕疙瘩EMT,因此MET可能是治疗瘢痕疙瘩的潜在药物,而且FGFR4/MST1信号通路是一种潜在的瘢痕疙瘩治疗靶点。

