携P- SLex和TE单抗双靶向超声微泡的构建及高剪切力下靶向黏附能力的评价
朱正球,杨芳,陈苓珊,吴意贇,王银萍,马学慧,沈碧潇,黄辉
(1.江苏省中医院,南京中医药大学附属医院 超声医学科,江苏 南京 210029; 2.东南大学 生物科学与医学工程学院,生物电子学国家重点实验室,江苏省生物材料与器件重点实验室,江苏 南京 210096;3.江苏省中医院,南京中医药大学附属医院 放射科,江苏 南京 210029)
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病的重要发病基础。慢性炎症贯穿于AS的发病全过程,其诱导的动脉管壁细胞外基质弹性蛋白的弹性生成(elastogenesis,EG)功能紊乱,是动脉结构重塑、弹性衰退及AS进展的重要机制。大量研究[1]证实,EG合成弹性蛋白的前体物质弹性蛋白原(tropoelastin,TE)在正常动脉细胞外基质中含量极低;然而当动脉EG功能紊乱时,TE可在细胞外基质中及内皮细胞表面大量蓄积。这一特征使得靶向TE的超声微泡(microbubbles,MB)在理论上可实现活体状态下实时评估动脉EG功能紊乱状态。然而人体大动脉始终处于高速、高剪切力的血流状态下,单靶向超声微泡很难与动脉内皮细胞及其间隙细胞外基质上的靶分子实现有效结合。多聚唾液酸化路易斯X(polymeric sialyllewis X,P- SLex)是一种非抗体性的选择素快速结合型配基,能与动脉内皮细胞表面的P- 选择素快速但不牢固地结合[2]。这为TE缓慢结合型配基形成牢固结合提供了必不可少的时间窗与机会。本研究欲构建携P- SLex和TE单抗的双靶向超声微泡,并体外验证其在高剪切力下的靶向黏附能力。
1 材料与方法
1.1 P- SLex、TE双靶向微泡的构建
按一定摩尔比取二棕榈酰磷脂酰胆碱、磷脂酰乙醇胺和二硬脂酰磷脂酰乙醇胺生物素脂质(均为Avanti公司,美国)溶液,均匀混合后减压旋转蒸发除尽有机溶剂,在形成的脂质膜中加入磷酸盐缓冲溶液(PBS),得脂质混悬液,再填充六氟化硫气体(≥99.99%,安徽强源气体有限公司),机械振荡后加入亲和素(Sigma- Aldrich公司,美国)混合,再分离纯化后制备得到携载生物素的空载微泡(MBC)。为制备靶向微泡,按照1×107个·ml-1微泡浓度加入3.0 μg的比例,分别加入P- SLex(GlycoNZ公司,新西兰)、TE单克隆兔抗小鼠抗体(Bioss公司,中国)以及P- SLex∶TE抗体=1∶1的混合液体,均匀混合后离心分离取气泡层样品,即分别制备得到携P- SLex的单靶向超声微泡(MBP)、携TE单抗的单靶向超声微泡(MBT)以及携P- SLex和TE单抗的双靶向超声微泡(MBPT)。
1.2 靶向微泡显微表征、粒径、Zeta电位和浓度检测
将微泡溶液用PBS稀释10倍后,取10 μl滴到载玻片上,采用荧光倒置显微镜(Nikon ECLIPSE TS100, 日本),在20倍物镜下依次拍照观察显微表征(图1)。取微泡溶液,使用PBS稀释10倍后,取1.5 ml稀释液加入到高灵敏度Zeta电位及粒度分析仪样品池(Brookhaven 90Plus PALS,美国)中,测定其Zeta电位。在100 ml电解溶液中加入20 μl微泡分散液,使用颗粒细胞计数及粒度分析仪(Multisizer 4e,贝克曼公司,美国)测定其平均粒径和微泡浓度。

图1 MBC(A)、MBP(B)、MBT(C)和MBPT(D)的显微光镜表征
1.3 靶向微泡体外高剪切力靶向黏附能力评价
35 mm细胞培养皿用甲醇漂洗后干燥,再用PBS分别配备1 μg·ml-1的小鼠P- 选择素Fc段溶液(R&D公司,美国)和小鼠TE抗原溶液(Sigma- Aldrich公司,美国),按1∶1比例混匀后,用移液器滴加 200 μl 在培养皿中央,4 ℃冰箱中放置12 h,用0.05%的PBS- 吐温20溶液洗涤3遍,3%的Tris缓冲盐溶液(TBS)-小牛血清白蛋白处理1 h,再用0.05%的PBS- 吐温20溶液洗涤3遍后备用。
搭建好平行平板流动腔装置(Glycotech31- 001,Circular Flow Chamber Kit Instructions,美国),分别在0.6、2.0、4.0 dyn·cm-2(1.0 dyn·cm-2=0.1 N·m-1)的剪切应力下注射微泡样品(均约1×107个·ml-1),进行微泡结合实验评价。微泡注射6 min期间,使用20倍物镜进行视频录制(25帧·s-1)及定量分析(图2)。

图2 平行平板流动腔微泡结合实验,注射微泡0(A)、2(B)、4(C)、6 min(D)的微泡结合情况
再使用生理盐水冲洗平行流动板,清洗完静止但未结合的微泡;从0.1 dyn·cm-2剪切力开始进行冲洗,每30 s增加1倍剪切力,至镜下微泡完全解离或6 min 后达到409.6 dyn·cm-2,进行微泡解离实验评价。冲洗过程使用显微镜(20倍物镜)进行视频录制(25帧·s-1)(图3),最后采用Image J软件(NIH,美国)对视频图像进行微泡计数及定量分析。
图3 平行平板流动腔微气泡解离实验,逐步增加剪切力下0(A)、2(B)、4(C)、6 min(D)的微泡解离情况
1.4 统计学处理
采用SPSS 22.0软件对数据进行统计分析。计量资料以均值±标准差表示。不同剪切力下同一微泡类型组间比较及同一剪切下不同微泡类型组间差异比较均采用单因素方差分析,再利用析因分析分析不同微泡类型及不同剪切力两因素之间是否存在交互效应,然后利用Bonferroni检验比较两两组间差异。P<0.05为差异具有统计学意义。
2 结 果
2.1 微泡基本物理特征评价
普通光学显微镜下本研究的生物素化脂质MB为透亮微气泡(图1),分布均匀,平均粒径约为0.722 μm,平均浓度为3.89×109个·ml-1。制备的MBC、MBP、MBT及MBPT 4种微泡形态类似,平均粒径为0.699~0.869 μm,Zeta电位为-11.37~-3.98 mV,微泡浓度为1.60×109~6.11×109个·ml-1(表1)。

表1 MBC、MBP、MBT和MBPT的平均粒径、Zeta电位及微泡浓度测定结果
2.2 微泡靶向黏附结合能力的体外评价
由低至高(0.6、2.0、4.0 dyn·cm-2)的3种剪切力作用下微泡的全程(6 min)结合数目MBPT分别是MBC的2.39、1.98及30.83倍,MBP的3.12、1.29及2.84倍,MBT的6.28、2.84及3.62倍(均P<0.001)(表2)。进一步组内两两比较证实,3种剪切力之间及4种微泡之间差异均有统计学意义(均P<0.001),且4种微泡结合数目均随着剪切力的增高而显著减少(均P<0.001)(图4、5)。不同微泡类型及不同剪切力两因素对微泡结合数目的影响存在交互效应(P<0.001)(表2)。
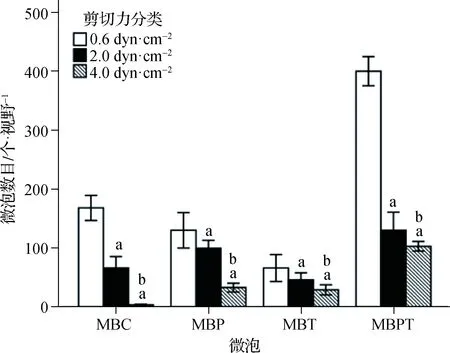
a与0.6 dyn·cm-2剪切力比较,P<0.001;b 与2.0 dyn·cm-2剪切力比较,P<0.001
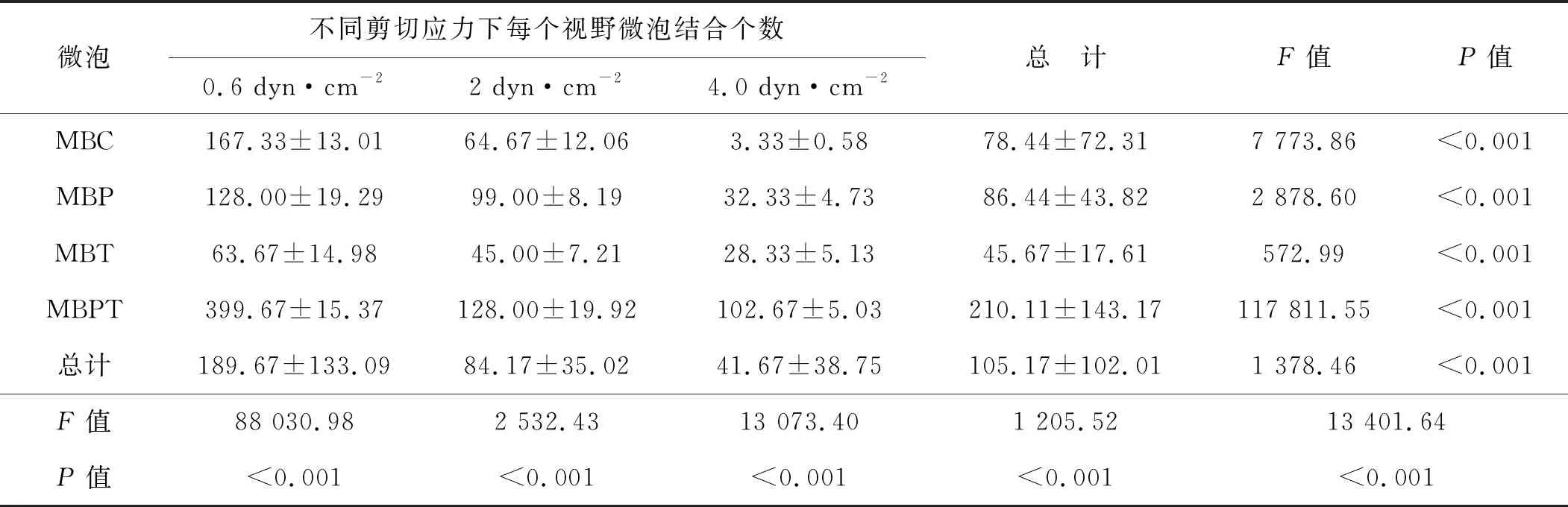
表2 不同剪切应力下的微泡结合数(6 min,n=3)
2.3 微泡靶向黏附解离能力的体外评价
在微泡解离实验中,MBC、MBT、MBP及MBPT的半数解离剪切应力依次为(11.04±1.52)、(32.83±7.54)、(22.44±5.47)及(27.82±3.84)dyn·cm-2,4组间比较差异有统计学意义(P=0.004)。在(30.62±8.68)dyn·cm-2的剪切应力下,MBC即可达到完全解离,而MBT和MBP的完全解离剪切应力分别为(111.27±15.37)及(77.14±21.88)dyn·cm-2,MBPT则为(104.23±23.92)dyn·cm-2,4组间比较差异有统计学意义(P=0.003)。

a 与MBC比较,P<0.001;b 与MBP比较,P<0.001;c 与MBT比较,P<0.001
3 讨 论
本研究利用TE的特异性单抗构建靶向超声微泡用于超声分子成像,有望实现精准化在体评估TE及EG功能紊乱状态。我们的体外研究已证实,单靶向TE的MBT超声微泡能与平行流动板的TE抗原有效结合,且其结合可较空载微泡MBC耐受更强的剪切力冲击。然而,人体大血管始终处于高速、高剪切力的血流环境下,单靶向TE的超声微泡很难与动脉内皮细胞及其间隙细胞外基质上的靶分子实现持续的有效结合,进而可能导致成像失败[3]。本研究显示,MBP的微泡结合总体数目显著优于MBC及MBT,但其与MBC一样不能很好地耐受4.0 dyn·cm-2高剪切力的冲击;相反,尽管MBT能较好耐受4.0 dyn·cm-2剪切力的冲击且拥有较高的半数及完全解离剪切力,但是其微泡在长达6 min的持续结合中的总体数目较MBP及MBC显著减少。这说明,靶向微泡表面的TE抗体确实能与动脉管壁内皮细胞表面的TE形成较为牢固的结合,可以耐受高剪切力的持续冲击。但若没有P- SLex与P- 选择素之间快速且较不牢固的结合所争取的时间窗,其最终的结合数目仍然不尽如人意。这同时也说明,单靶向微泡MBT或MBP可能都很难胜任未来实现活体状态下的大血管EG功能紊乱成像,联合二者的优势所构建的双靶向超声微泡MBPT可能才是解决问题的关键。
前已述及,慢性炎症状态在AS和心脑血管疾病的发生发展中扮演了核心机制的角色[4]。处在炎症状态的动脉管壁内皮细胞会在细胞膜表面高表达P- 选择素,以便于白细胞通过P- 选择素的相关受体与之快速结合并锚定在细胞表面,从而诱导管腔内的白细胞进入动脉管壁并发生慢性炎症反应[5- 6]。正是利用这一特征,携P- 选择素的非抗体性配基P- SLex及TE单抗的双靶向超声微泡MBPT,本研究已证实其不仅可耐受4.0 dyn·cm-2的剪切力冲击,还具有较高的半数解离剪切应力及完全解离剪切应力,特别是在高剪切力下结合数目分别为MBC的30.8倍、MBP的2.8倍及MBT的3.6倍。近期Ozawa等[7]已成功利用P- 选择素配基及抗炎性分子单抗双靶向微泡,在体外高剪切力下成功实现与靶分子的有效结合及体内的超声分子成像。然而迄今为止,利用超声分子成像技术在体评估动脉EG功能紊乱尚未见报道,故本研究所构建的双靶向微泡MBPT有望在未来活体状态的EG功能紊乱定量评估中发挥重要的可视化作用。
本研究具有一定的局限性,本研究为体外实验,且平行平板流动腔设备所需剪切力为生理盐水冲击构建,与人体循环系统内环境存在一定的差异,故靶向微泡黏附能力在未来还需进一步动物实验体内验证。
总之,本研究利用P- SLex及TE单抗构建的双靶向超声微泡MBPT,在体外微泡结合及解离实验中表现出区别于空载及单靶向微泡的黏附力和解离能力,能在较高剪切力下实现与靶分子的有效结合,有望在活体状态下实现大动脉的超声分子影像学成像并实时动态评估EG功能紊乱状态。

