胡黄连苷Ⅱ通过激活自噬作用抑制泡沫细胞的形成与炎症反应
王明霞 蔡雪峰 林静 黄宗文
(海南省安宁医院神经内科和老年精神科,海口 571100)
动脉粥样硬化(atherosclerosis,AS)是一个复杂的病变过程,涉及多种细胞机制和途径,如炎症、脂质积聚、氧化应激等,是引起心血管和脑血管疾病、心梗、冠状动脉疾病和缺血性中风的重要因素。血管内皮下巨噬细胞脂质颗粒的内化均由一系列清道夫受体(scavenger receptors,SRS)调控,每一种受体都能摄取修饰后的低密度脂蛋白(low density lipoprotein,LDL)。例如,SR-A类受体SR-AⅠ和SR-AⅡ对乙酰化低密度脂蛋白和大量氧化低密度脂蛋白具有较强的亲和力,然而SRS并不是巨噬细胞摄取氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)的唯一途径,吞噬和胞吞也可能摄取ox-LDL。
巨噬细胞自噬参与AS过程中泡沫细胞的形成与炎症反应[3],巨噬细胞与AS从脂质条纹到斑块破裂及血栓形成等各个阶段密切相关,调节病变处的脂质胆固醇代谢、炎症反应以及纤维降解等,对AS性斑块的形成、增大以及斑块的稳定性有重要作用,抑制巨噬细胞的脂质堆积和泡沫细胞形成,减少巨噬细胞向病变处的迁移和黏附可有效保持斑块的稳定。巨噬细胞也是参与炎症反应过程中的重要功能分子之一,其中包括NLRP3、ASC和caspase-1三种相关蛋白组成的炎症小体,促进IL-1β前体成熟并释放,从而产生炎症反应。相关研究结果表明,自噬可以调节巨噬细胞的炎症反应[4-5]。敲除ATG16L1或ATG7等自噬基因后,经脂多糖(LPS)诱导后,NLRP3介导的炎症反应增加,表明自噬与抑制NLRP3活化有关[6]。在炎症过程中,小胶质细胞或巨噬细胞可以激活caspase-1介导的炎症因子如IL-1β和IL-18的释放,而促进细胞自噬的药物可以抑制炎症因子的释放和caspase-1的表达。PENG等[7]研究表明ox-LDL可激活NLRP3炎症小体,从而促进巨噬细胞产生并释放成熟的IL-1β。
自噬是细胞进化上保守的自我降解过程,可降解损坏或多余的蛋白质、细胞器及大分子物质,降解物被重新吸收利用以达细胞稳态的作用,从而减轻组织细胞损伤[6]。LC3是细胞自噬过程中的标志蛋白,当细胞激发自噬时LC3Ⅰ通过降解部分多肽,形成LC3Ⅱ以促进自噬体膜的形成,beclin1作为自噬体产生的重要分子可调控自噬体的形成[8]。研究表明自噬的激活可减轻炎症反应和氧化应激[9-10]。胡黄连苷Ⅱ(化学式为C23H28O13)在许多脏器组织中具有广泛的药理作用[11-12]。然而,关于胡黄连苷Ⅱ是否可通过调节自噬及减轻炎症反应,从而抑制巨噬细胞泡沫化形成的分子机制目前未见报道。
胡黄连是我国传统中草药,可用于治疗多种疾病,根据宋代《本草图经》中记载,胡黄连能够治疗“伤寒劳复身热,大小便赤如血者”。胡黄连苷Ⅱ是其主要活性成分之一,具有广泛的药理作用,包括神经保护、肝保护、抗胆汁淤积、抗炎和免疫调节活性[13-14]。研究表明胡黄连苷Ⅱ具有抗氧化与抗炎活性[15-17]。LEE等[18]首次证明了胡黄连苷Ⅱ通过抑制MAPK和NF-κB途径抑制人单核细胞和人气管上皮细胞中IL-33的表达与分泌,表明胡黄连苷Ⅱ对于肺部炎症具有改善作用。
1 材料与方法
1.1 材料
1.1.1 细胞THP-1(人髓系白血病单核细胞)购自中国科学院上海细胞库。
1.1.2 药物胡黄连苷Ⅱ购自上海源叶生物(HPLC≥98%),用生理盐水配制成1 mmol/L胡黄连苷Ⅱ母液,过滤除菌低温保存备用。
1.1.3 试剂RPMI1640培养基、胎牛血清、胰酶购自Thermo Hyclone公司;Cell Counting Kit-8(CCK-8)相关试剂购自美国Apexbio公司;蛋白提取试剂盒、BCA试剂盒购自碧云天公司;鼠抗人LC3Ⅰ、LC3Ⅱ、beclin1、ABCA1、ABCG1、NLRP3、ASC、GAPDH一抗及TNF-α、human IL-10、human IL-6、human IL-1β ELISA Kit均购自英国Abcam;二抗(辣根过氧化物酶标记羊抗鼠IgG)购自美国Thermo Scientific公司。
1.2 方法
1.2.1 巨噬细胞泡沫化模型建立用含10%FBS的RPMI1640培养基培养THP-1细胞,置于37℃、5%CO2的培养箱中。PMA诱导分化36 h,THP-1细胞形态由悬浮的圆形细胞转变为贴壁的不规则形态细胞,同时伸出伪足,表明THP-1单核细胞已分化为巨噬细胞。
经PMA诱导分化为THP-1细胞源性巨噬细胞后,加入80 μg/ml ox-LDL培养24 h后,显微镜下细胞体积增大,细胞内含物增多,油红O染色显红色圆形脂滴,表明已形成泡沫细胞。
1.2.2 测定细胞活力THP-1细胞以1×104个/孔接种于96孔板,每组设置3个复孔,PMA诱导分化为巨噬细胞后,加入不同浓度的胡黄连苷Ⅱ(0、10、20、30和100 μmol/L),协同80 μg/ml的ox-LDL孵育48 h,加入培养液组为对照组,加入CCK-8试剂置于培养箱中培养1 h,使用酶标仪在450 nm下测定各孔吸光度,测定细胞相对活力。细胞相对活力(%)=实验组A490/对照组A490×100%。
1.2.3 油红O染色THP-1细胞以2×105个/孔接种于12孔板,每组设置3个复孔,PMA诱导分化为巨噬细胞后,加入不同浓度的胡黄连苷Ⅱ(0、5、10和20 μmol/L)与100 μg/ml ox-LDL培养24 h,4%多聚甲醛4℃固定30 min,PBS洗涤后37℃油红O染色30 min,除去油红O染液,60%异丙醇漂洗残余油红O,倒置荧光显微镜(×40)下观察拍照。
1.2.4 检测细胞内胆固醇含量THP-1细胞以2×106个/孔接种于6孔板,PMA诱导成巨噬细胞后加入不同浓度的胡黄连苷Ⅱ(0、5、10和20 μmol/L)预处理6 h,加入80 μg/ml的ox-LDL培养24 h,收集细胞用PBS清洗3次,依据游离胆固醇(FC)与总胆固醇(TC)含量检测试剂盒说明,测定各实验组中游离胆固醇与总胆固醇含量,取适量细胞上清液用BCA法测定蛋白浓度,酶标仪测定OD550值,并校正胆固醇含量。细胞内胆固醇酯(cholesterol ester,CE)=TC-FC。胆固醇酯化率(%)=CE含量/总胆固醇含量×100%。
1.2.5 Western blot THP-1细胞以2×106个/孔接种于6孔板,诱导成巨噬细胞,加入不同浓度的胡黄连苷Ⅱ(0、5、10和20 μmol/L)与80 μg/ml ox-LDL培养24 h。收集各实验组细胞,加入RIPA裂解液,冰上裂解30 min,4℃下12 000 r/min离心10 min。BCA法测定所得样品蛋白浓度,均取45 μg蛋白于10%SDS-PAGE分离蛋白,并转至NC膜上,5%脱脂奶粉封闭1 h,加入按比例稀释后的一抗ABCA1、ABCG1、NLRP3、ASC、caspase-1、LC3、beclin1和GAPDH,4℃孵育过夜;TBST洗膜后加入对应二抗,室温孵育2 h;采用ECL化学发光试剂在化学发光仪中显影曝光,使用Image Lab 5.1.0软件进行蛋白条带灰度分析。
1.2.6 ELISA法检测炎症因子THP-1细胞以1×104个/孔接种于96孔板,每组设置3个复孔,PMA诱导分化为巨噬细胞后,加入不同浓度的胡黄连苷Ⅱ(0、5、10和20 μmol/L),协同80 μg/ml的ox-LDL孵育24 h,加入培养液组为对照组。收集各组细胞培养液,ELISA试剂盒检测TNF-α、IL-1β和IL-6等炎症因子,从而评估炎症反应。
1.2.7 免疫荧光实验THP-1细胞以2×105个/孔接种于12孔板,PMA诱导分化为巨噬细胞后,加入不同浓度的胡黄连苷Ⅱ(0、5、10和20 μmol/L),协同80 μg/ml的ox-LDL孵育24 h,加入培养液组为对照组。加入4%多聚甲醛固定和0.5%Triton X-100改变细胞膜通透性,5%BCA阻断1 h,LC3Ⅱ一抗在4℃下孵育过夜,洗涤细胞后室温下避光孵育二抗1 h,DAPI溶液孵育10 min,激光共聚焦显微镜拍照。
1.2.8 自噬水平与炎症小体相关性检测THP-1细胞以2×106个/孔接种于6孔板,诱导成巨噬细胞,预先加入自噬激活剂200 nmol/L雷帕霉素(rapamycin,RAPA)或自噬抑制剂50 nmol/L巴佛洛霉素A1(bafilomycin A1,Baf-A1)处理,再加入20 μmol/L胡黄连苷Ⅱ与80 μg/ml ox-LDL培养24 h。收集各实验组细胞,实验方法同1.2.5 Western blot操作。
1.3 统计学分析使用SPSS20.0进行统计学分析及绘图。所有数据以±s表示。组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度胡黄连苷Ⅱ对THP-1细胞活力的影响如图1A所示,胡黄连苷Ⅱ在0~100 μmol/L的浓度范围内不影响THP-1细胞活力,表明胡黄连苷Ⅱ在该浓度范围内对THP-1无细胞毒性。此外,THP-1细胞与80 μg/ml ox-LDL共培养以诱导泡沫细胞的形成。经ox-LDL诱导后,THP-1细胞的细胞活力显著降低,与空白组(0 μmol/L)相比胡黄连苷Ⅱ(10~100 μmol/L)处理可显著提高ox-LDL诱导的THP-1细胞活力(图1B)。

图1 胡黄连苷Ⅱ对THP-1细胞活力的影响Fig.1 Effects of picrosideⅡon viability of THP-1 cells
2.2 油红O染色如图2所示,Control组细胞内仅有少量细小红色颗粒,巨噬细胞经ox-LDL刺激后体积增大,胞内有明显红色脂滴。5、10、20 μmol/L胡黄连苷Ⅱ处理后的细胞内红色脂滴均明显减少,随着胡黄连苷Ⅱ浓度增加,呈现出浓度依赖性减少细胞内脂质的沉积,初步表明胡黄连苷Ⅱ可有效改善巨噬细胞对脂质的积累。

图2 胡黄连苷Ⅱ对巨噬细胞内脂质积累影响(油红O,×40)Fig.2 Effects of picrosideⅡon cholesterol accumulation in macrophages(Oil red O,×40)
2.3 胆固醇积累与相关蛋白水平检测如表1所示,经ox-LDL诱导后THP-1源泡沫细胞TC水平显著增加,胡黄连苷Ⅱ干预后细胞内TC降低。空白对照组巨噬细胞的胆固醇酯化率为(72.20±3.21)%,随着胡黄连苷Ⅱ浓度的增加(5、10和20 μmol/L),巨噬细胞的胆固醇酯化率逐渐降低[分别为(60.77±7.80)%、(54.33±9.64)%和(47.59±8.73)%],表明胡黄连苷Ⅱ能够抑制巨噬细胞胆固醇酯化。采用Western blot验证胡黄连苷Ⅱ是否作用于巨噬细胞的ATP结合盒转运体A1(ABCA1)和ABCG1,从而影响巨噬细胞摄取胆固醇。Western blot结果显示(图3),5、10和20 μmol/L胡黄连苷Ⅱ处理后,与ox-LDL+PicrosideⅡ(0 μmol/L)组 相 比ABCA1和ABCG1的蛋白表达水平均显著升高(P<0.05或P<0.01),表明胡黄连苷Ⅱ可能通过促进巨噬细胞胆固醇逆转运相关膜蛋白ABCA1和ABCG1的表达,加快细胞内胆固醇外排,减少细胞内胆固醇积累。

表1 巨噬细胞内胆固醇含量Tab.1 Cholesterol content in macrophages

图3 不同浓度胡黄连苷Ⅱ对胆固醇外排蛋白表达的影响Fig.3 Effects of picrosideⅡat different concentrations on expressions of cholesterol-efflux regulatory protein
2.4 胡黄连苷Ⅱ对巨噬细胞炎症反应的影响如图4A~C所 示,ELISA实验 结果表 明,Control组与ox-LDL诱导组中TNF-α[(49.00±3.60)与(131.67±3.06)pg/ml]、IL-1β[(42.67±3.18)与(99.00±4.00)pg/ml]、IL-6[(103.00±7.21)与(303.67±11.72)pg/ml]相比较,ox-LDL诱导组中炎症因子均显著提高,与不同浓度的胡黄连苷Ⅱ共同孵育后,巨噬细胞炎症因子的分泌均减少,其中20 μmol/L胡黄连苷Ⅱ处理后的巨噬细胞炎症因子为TNF-α[(42.33±5.86)pg/ml]、IL-1β[(44.33±4.16)pg/ml]、IL-6[(138.67±9.61)pg/ml],相关炎症因子的分泌均显著降低。Western blot实验显示胡黄连苷Ⅱ在10 μmol/L和20 μmol/L的 浓 度 下 显 著 下 调ASC、caspase-1和NLRP3的表达(P<0.05,P<0.01或P<0.001),这些结果表明胡黄连苷Ⅱ能够有效抑制ox-LDL诱导THP-1细胞产生的炎症反应(图4D)。
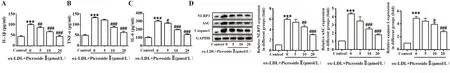
图4 胡黄连苷Ⅱ对ox-LDL诱导的THP-1炎症反应的影响Fig.4 Effects of picrosideⅡon ox-LDL-induced inflammation in THP-1 cells
2.5 胡黄连苷Ⅱ对巨噬细胞自噬活性的影响在ox-LDL诱导的THP-1细胞中评估胡黄连苷Ⅱ的自噬活性。如图5A所示,在ox-LDL诱导后,LC3Ⅱ/Ⅰ和beclin1的蛋白表达水平显著增加,表明ox-LDL诱导巨噬细胞激活自噬。5、10、20 μmol/L胡黄连苷Ⅱ处理巨噬细胞后,与空白组相比LC3Ⅱ/Ⅰ和beclin1的蛋白表达水平增加,差异有统计学意义(P<0.05,P<0.01或P<0.001),呈现浓度依赖性提高LC3Ⅱ/Ⅰ和beclin1的蛋白表达且增强自噬。此外,免疫荧光分析表明,ox-LDL可提高LC3Ⅱ的活性,而胡黄连苷Ⅱ处理可进一步增强LC3Ⅱ的活性。
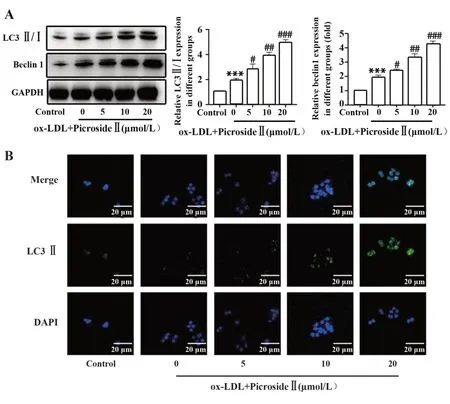
图5 胡黄连苷Ⅱ对ox-LDL诱导的THP-1自噬的影响(×20)Fig.5 Effects of picrosideⅡon ox-LDL-induced autophagy in THP-1 cells(×20)
2.6 胡黄连苷Ⅱ对巨噬细胞自噬水平与炎症小体相关性的影响如图6所示,胡黄连苷Ⅱ或自噬促进剂RAPA处理后均显著降低ox-LDL诱导的NLRP3、ASC和caspase-1蛋白表达(P<0.05或P<0.01),而自噬抑制剂Baf-A1处理后减弱了胡黄连苷Ⅱ对巨噬细胞炎症小体相关蛋白表达的作用,表明胡黄连苷Ⅱ促进巨噬细胞自噬并因此下调炎症小体相关蛋白的表达,巨噬细胞的自噬水平与炎症小体的激活呈负相关性。

图6 胡黄连苷Ⅱ通过调节巨噬细胞自噬影响炎症小体的表达Fig.6 PicrosideⅡaffects expression of inflammasome by regulating autophagy in macrophages
3 讨论
AS是心脑血管疾病的病理基础,可引发脑卒中、心肌梗塞和急性冠状动脉综合征,是世界范围内致残和死亡的主要原因之一。由于缺乏对AS治疗有效并无副作用的药物,目前研究热点是寻找毒性小,替代疗法疗效高的新药物。胡黄连苷Ⅱ是从传统中草药胡黄连(clematis chinensis)中提取的主要活性成分之一,具有抗炎活性。LAN等[19]研究表明胡黄连苷Ⅱ通过NF-κB途径抑制脊髓反应性星形胶质细胞介导的神经炎症,从而减轻大鼠CCI诱导的神经性疼痛。
然而,关于胡黄连苷Ⅱ在AS形成中的确切作用和机制知之甚少。本研究证明了黄连苷Ⅱ可以通过增强ox-LDL诱导的THP-1细胞自噬,抑制泡沫细胞的形成、胆固醇积累和炎症反应。此外,还发现胡黄连苷Ⅱ通过自噬调节ABCA1/ABCG1表达和NLRP3炎症体,从而对ox-LDL诱导的巨噬细胞发挥了保护作用。
泡沫细胞的形成是由于巨噬细胞脂质代谢失衡,导致细胞内胆固醇的过度积累,巨噬细胞内胆固醇平衡主要通过胆固醇逆向转运,排出过多胆固醇以调节巨噬细胞内外平衡。胆固醇外流是由膜转运蛋白ABCA1和ABCG1介导[20]。ABCA1由于具有胆固醇外排和磷脂调节功能而被称为胆固醇外排调节蛋白,ABCG1则可诱导胆固醇与高密度脂蛋白(HDL)结 合 外 排。YUAN等[21]证 实 在ABCA1和ABCG1敲除小鼠中,会加重泡沫细胞及AS的形成。此外,最近的研究确定了几种源自传统中草药的有效成分,如白桦蛋白和亮氨酸,均是通过上调巨噬细胞ABCA1和ABCG1的表达,促进细胞内胆固醇流出并减少细胞内胆固醇积累,有望成为减缓或防治AS的候选药物[22]。本研究证明胡黄连苷Ⅱ抑制了THP-1巨噬细胞形成泡沫细胞。此外,胡黄连苷Ⅱ上调ox-LDL诱导的THP-1巨噬细胞ABCA1/ABCG1的表达,从而促进巨噬细胞胆固醇外流。这些发现表明胡黄连苷Ⅱ通过调节ABCA1/ABCG1有效促进胆固醇外排,从而减少泡沫细胞的形成。
已有文献报道氧化应激和ox-LDL等因素可引发AS的形成,而细胞自噬可有效减缓细胞炎症并预防AS的形成[23]。本实验结果也显示当ox-LDL诱导巨噬细胞时,beclin1表达和LC3Ⅱ/Ⅰ显著增加。据报道,适度的激活巨噬细胞自噬可调节胆固醇的外排从而抑制泡沫细胞的形成和炎症反应,进而预防AS的形成[23-24]。在本研究中,黄连苷Ⅱ处理ox-LDL诱导的THP-1巨噬细胞后,LC3Ⅱ和beclin1的表达以及LC3Ⅱ/Ⅰ进一步增加,表明黄连苷Ⅱ促进自噬激活以阻止AS形成。另外,还发现巨噬细胞自噬活性与NLRP3炎症小体之间呈负相关,NLRP3炎症体被自噬负调控,黄连苷Ⅱ可能部分通过调节自噬介导的NLRP3炎性体抑制ox-LDL诱导的炎症反应。
本研究证实了黄连苷Ⅱ通过促进ox-LDL刺激的THP-1巨噬细胞中的自噬来促进ABCA1/ABCG1依赖性胆固醇外排并抑制NLRP3炎症体,从而抑制泡沫细胞的形成和炎症反应。为黄连苷Ⅱ在预防和治疗AS中提供了基础理论。