废磷酸盐与蒸氨废液共处理工艺研究
熊 萍 ,杨文振 ,李 桥 ,孙秀云 ,韩卫清
(1.南京理工大学环境与生物工程学院,南京 210014;2.化工污染控制与资源化江苏省高校重点实验室)
磷是一种重要的元素, 是生命所必须的常量元素之一。 目前,磷主要通过开采磷矿石生产,有研究指出按目前的开采速度到21 世纪末世界上的磷矿资源将全部枯竭[1]。 为应对未来磷资源紧缺的问题,研究人员从市政污水、污泥、养殖废水、工业废水、黑水等各种含磷废物中回收磷资源[2-4]。 废磷酸盐(PW)是一种以磷酸钠为主要成分的固体废物,具有较高回收价值。在各种回收磷的方法中,化学沉淀法最为简便、高效,回收产物包括磷酸钙、磷酸铁、鸟粪石(磷酸氨镁)等[5-6]。 在多种回收形式中,Ca-P 沉淀法回收磷具有工艺简单、成本低,产物附加值高等优点,但反应过程中体系需维持高 pH(一般高于 10)[7]。目前使用Ca-P 沉淀法回收磷的研究大多以CaCl2、Ca(OH)2等药剂作为钙源,以 NaOH、氨水等作为pH 调节剂[8-12]。药剂的使用大大增加了回收成本,极大地限制了磷的回收[13],因此寻求低成本的钙源至关重要。
蒸氨废液(DW)是索尔维法(Solvay,又称氨碱法)生产纯碱过程中产生的废液,其成分以CaCl2和NaCl 为主,还含有少量 Ca(OH)2和 CaSO4,pH 一般大于 11[14]。 每生产 1 t 纯碱产生约 10 m3蒸氨废液[15],目前主要是将其送入围坝中自然澄清, 待清液pH、浊度等指标达标后直接排放至河、湖或海洋[16]。围坝沉积满后就需要开辟新场地,会长期占用大量土地[17]。 废液的排放导致水体盐度和 pH 上升,生态环境遭到破坏。 有研究针对DW 中丰富的Ca 资源开发了资源化工艺,如将DW 与含SO42-的废盐泥共处理制取石膏、将DW 用于烟气脱硫、利用DW 吸收烟气中CO2以及利用DW 制备超细碳酸钙粉体等[18-21]。然而废液的产生量远高于处理量,仍有大量的废液待处理[22],因此寻求其他蒸氨废液资源化利用的方法迫在眉睫。
中国农药、 医药和生物化工等副产废盐产生量大的化工行业多分布于环渤海、 长三角地区的沿海城市(如唐山、潍坊、青岛、连云港等)以便生产原料的供给及产品的销售; 氨碱厂也多分布于沿海城市以便蒸氨废液筑坝堆存或晒盐后直接排湖或排海。两种废物产生地距离近、交通运输便利,具备可综合利用的条件。 研究基于PW 高磷含量和DW 高钙含量、高pH 的特点,提出一种基于Ca-P 沉淀的共处理工艺同步回收磷和钙资源。 通过热处理去除PW中的少量有机物杂质后制备磷储备液。 探究了不同影响因素对Ca、P 回收率和产物的影响, 并研究了回收产物的应用可能性, 以期为PW、DW 的资源化利用提供新思路。
1 实验部分
1.1 实验原料
原料:实验所用PW 取自某化工厂,DW 取自某纯碱生产企业。 两者具体成分见表1 和表2。

表1 PW 的主要成分Table 1 Main component of PW

表2 DW 的主要成分Table 2 Main component of DW
1.2 实验方法
1.2.1 工艺流程
PW 和DW 共处理工艺过程包括热处理、溶解、过滤、煮沸、共沉淀、产物陈化等步骤,工艺流程如图1 所示。
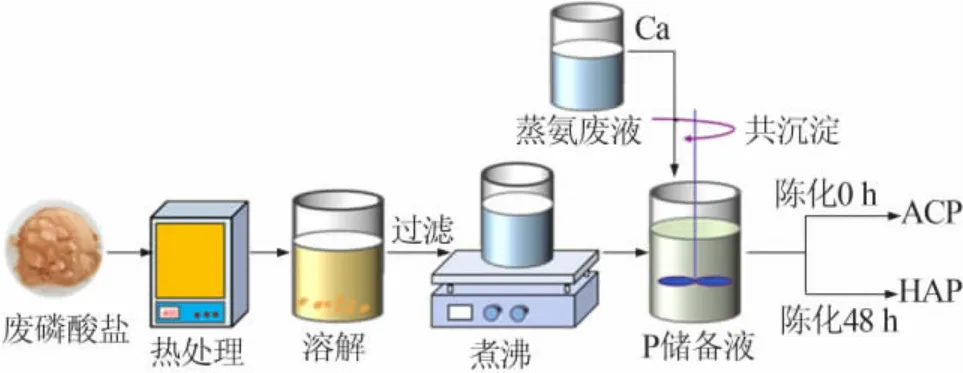
图1 PW 和DW 共处理工艺流程示意图Fig.1 Schematic diagram of PW and DW co-treatment process
1.2.2 磷储备液制备
因PW 含少量有机物杂质, 故共处理前先将其在 200~600 ℃下处理 2 h 后测定溶解性有机物(DOC)含量,选择最佳热处理温度进行处理以充分去除有机物。将PW 热处理所得的产物按100 g/L 的质量浓度溶解后过滤,取上清液加热煮沸,趁热加入去离子水至原体积, 防止溶液冷却后磷酸钠结晶析出,冷却后即得磷储备液。
1.2.3 影响因素探究
1)n(Ca)/n(P)、加药顺序。保持反应体系总体积为 100 mL,改变磷储备液与 DW 体积,使 n(Ca)/n(P)分别为 1、1.5、1.67、2、2.5、3, 加药速率设为 1 mL/min,搅拌速度设为 200 r/min。 每组 n(Ca)/n(P)各设两种加药顺序,分别为DW 加入磷储备液(Ca→P)、磷储备液加入DW(P→Ca)。反应结束后取悬浊液离心使其固液分离,测定上清液的Ca、P 浓度及pH,计算回收率。
2)DW 的浓度和 pH 变化。 在最佳n(Ca)/n(P)、加药顺序下,将DW 稀释至原来浓度的60%和20%,以模拟DW 浓度变化; 使用1 mol/L 盐酸调节DW的 pH 为 8.0、9.0、10.0 以模拟废液 pH 的变化(所取的 DW 样品 pH 为 11.2)。 反应结束后样品处理、分析方法同步骤1)。
3)陈化时间。 在不同 n(Ca)/n(P)、Ca→P 下,以1 mL/min 速率将DW 加入磷贮备液中,加药结束后继续搅拌2 h 以便充分反应,随后静置陈化,分别在加药结束后 0、6、12、24、48 h 测定溶液中 Ca、P 浓度(其中陈化0 h 的样品在搅拌5 min 后取样),计算回收率,用硝酸将产物溶解测定 n(Ca)/n(P)。 测定固相产物的晶相并分析其变化, 并就相应无定形产物进行高温煅烧以确定其成分。
1.2.4 产物应用可能性研究
有效成分分析: 准确称取0.01 g 陈化0 h 的产物,用10 mL 浓度为1 mol/L 的硝酸将其溶解后定容至50 mL,分别测定其中钙、磷的含量。按GB 20412—2006《钙镁磷肥》测定产物中有效五氧化二磷含量,分析其作钙镁磷肥的可能性。
重金属吸附性能:准确称取0.05 g 陈化48 h 的产物投加至50 mL Cu2+质量浓度为100 mg/L 的模拟含铜废水中[Cu(NO3)2配制],于 25 ℃恒温振荡箱中以 200 r/min 的转速振荡 3 h。 分别在 5、10、15、30、60、180 min 时取样,测定溶液中剩余 Cu2+浓度,计算去除率。
1.3 分析方法
DOC 和总有机碳含量由总有机碳分析仪测定;磷浓度采用钼酸铵分光光度法(GB 11893—1989《水质总磷的测定钼酸铵分光光度法》)测定;钙、铜浓度由电感耦合等离子体光谱仪(ICP)测定;产物晶相由X 射线衍射仪(XRD)测定。
2 实验结果与讨论
2.1 磷储备液制备
PW 的DOC 值随热处理温度升高的变化见图 2;PW 的热重分析曲线见图 3。 由图 2 可知,DOC值随温度的升高而降低, 由原始的2.21 mg/g 降至500 ℃的0.35 mg/g, 有机物去除率达到84.16%,温度再升高但DOC 值基本不再变化,且热处理产物由原始的黄棕色变为500 ℃的白色,说明500 ℃处理2 h 后PW 中有机物被有效去除,该温度为最佳热处理温度。 同时,由图 3 可知,500 ℃后 PW 质量基本不再变化,进一步说明500 ℃为最佳热处理温度。
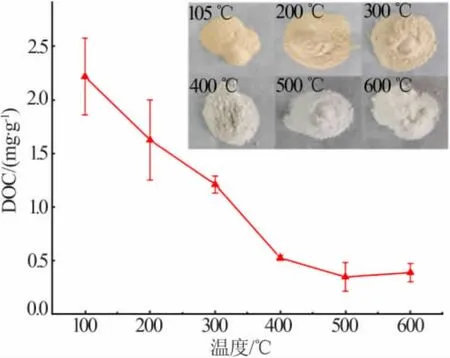
图2 PW 在不同温度下热处理产物的DOC 值Fig.2 DOC value of PW heat treated products at different temperature
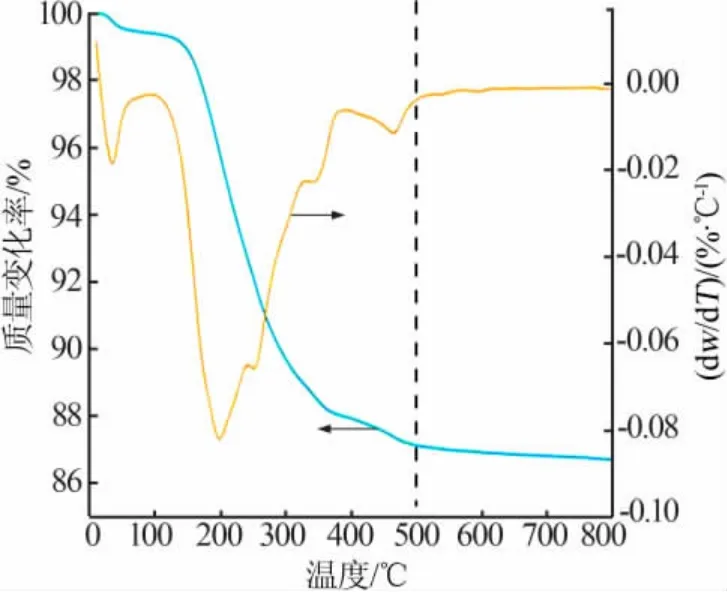
图3 PW 的热重分析曲线Fig.3 Thermogravimetric analysis curve of PW
利用PW 经过热处理、溶解、过滤、煮沸等预处理流程后, 制备得到磷含量为10.73 g/L、pH 为12.4的磷储备液用于共处理。
2.2 n(Ca)/n(P)及加药顺序对回收率的影响
n(Ca)/n(P)及加药顺序对反应体系的影响见图 4。 由图 4a 可得,不同 n(Ca)/n(P)、两种加药顺序的Ca、P 回收率有相同的变化趋势, 以 Ca→P 为例:当n(Ca)/n(P)≤1.67 时,随物质的量比的增加,磷回收率由77.10%迅速升至超过99.99%; 钙回收率皆超过 99.99%。当 n(Ca)/n(P)>1.67 时,磷回收率皆超过99.99%,而钙回收率由超过99.99%降至67.96%。 结果可得,n(Ca)/n(P)=1.67 为最佳的物质的量比。
同一物质的量比的条件下,Ca→P 和P→Ca 两种加药顺序的回收率存在一定的差异。当 n(Ca)/n(P)≤1.5时,两种加药顺序下钙回收率均超过99.99%,磷回收率加药顺序Ca→P 的方式优于P→Ca 的加药顺序;当n(Ca)/n(P)≥1.67 时,两种方式的磷回收率均超过99.99%,钙回收率加药顺序Ca→P 的方式优于P→Ca的加药顺序。 结果可得,Ca→P 为较优加药顺序。
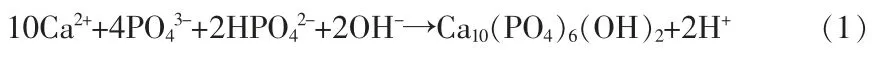
不同加药顺序对Ca、P 的回收率有影响, 这是由于Ca2+和 PO43-能够形成多种矿物形式,如Ca(H2PO4)2、Ca3(PO4)2、Ca4H(PO4)3、Ca5(PO4)3OH、CaHPO4·2H2O, 溶液中的 pH 和离子浓度水平都会影响物相的形成[12]。 不同的加入方式形成的离子相对过饱和度不同, 在沉淀过程中形成的初始物相及物相转化途径不同, 如加药顺序不同可能引起局部溶液 pH 改变、PO43-发生解离,HPO42-和H2PO-可替代PO43-形成 Ca10-x(HPO4)x(PO4)6-x(OH)2-x,进 而影 响Ca、P 的回收率[23]。 由式(1)可以看出,沉淀反应会消耗OH-并释放H+, 因此反应后体系pH 的降低情况可以作为反应进行程度的指示[24]。 图4 b 是各条件下反应后体系pH 的变化情况。 两种加药顺序反应后体系pH 不同,进一步说明了Ca-P 的沉淀经历了不同的过程,因而回收率有差异。
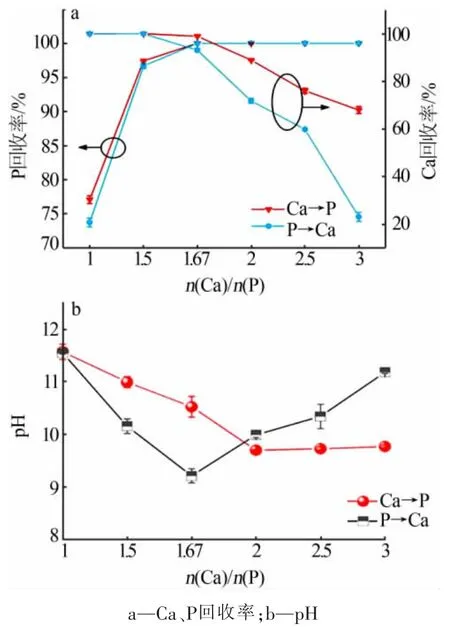
图4 n(Ca)/n(P)和加药顺序对反应体系的影响Fig.4 Effect of n(Ca)/n(P) and dosing sequence on reaction system
2.3 DW 的浓度和pH 对回收率的影响
DW 的浓度和pH 对反应体系的影响见图5。 由图 5a 可得,DW 浓度的变化对 Ca、P 的回收率影响较小。 随着DW 初始浓度的降低,磷回收率略减小,由超过99.99%降至99.91%; 钙回收率略增大,由98.93%增至99.63%。 反应后体系pH 基本无变化。
由图 5b 可得,DW 的 pH 变化对 Ca、P 回收率影响较小,Ca、P 回收率随 DW 的pH 增大略增大。DW 的 pH 从 8.0 增至 11.2 时, 磷回收率由 99.81%增至超过99.99%,钙回收率由97.89%增至98.93%。从反应平衡的角度来说,体系中 Ca2+、PO43-、OH-发生沉淀反应,pH 的升高增大了饱和指数, 因而Ca、P回收率随之增大[25]。
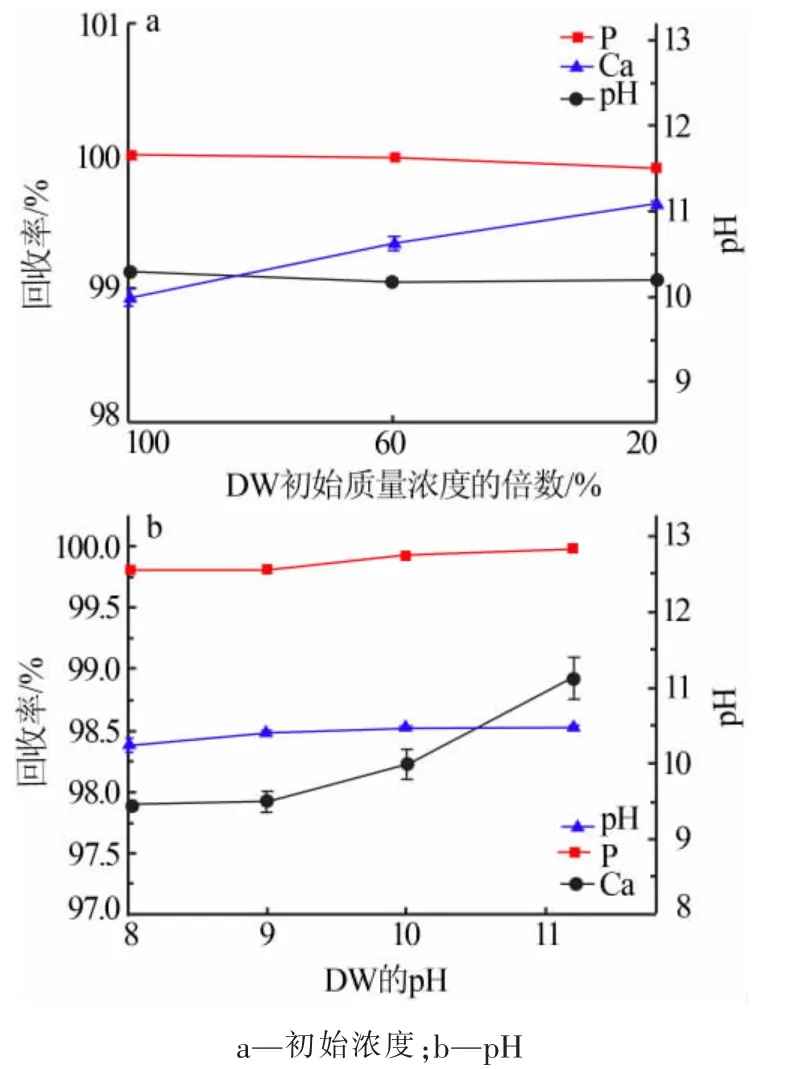
图5 DW 性质变化对反应体系的影响Fig.5 Effect of the change of DW properties on the reaction system
2.4 陈化时间对回收率和产物的影响
已有研究表明设置一定的陈化时间能够促进生成的絮状产物沉淀,有利于固液分离,还可以使产物向更稳定的晶型转化[26]。 故实验探讨了 0、6、12、24、48 h 这 5 个陈化时间对 Ca、P 回收率、 固相产物晶相及其 n(Ca)/n(P)的影响,结果见表 3 和图 6。
由表 3 可得,同一 n(Ca)/n(P)条件下,Ca、P 回收率随陈化时间的延长呈现相反的变化趋势,钙回收率不断增大而磷回收率不断减小。 以n(Ca)/n(P)=1.67 为例,磷回收率略减小,由超过 99.99%降至99.62%;钙的回收率由98.93%增至99.96%。

表3 回收率随陈化时间的变化Table 3 Change of recovery rate with aging time %
由图6a 可得,随陈化时间的延长,固相产物晶相由无定形态磷酸钙(ACP)逐渐转变为结晶态羟基磷灰石(HAP)。 当陈化 48 h 时,(022)、(210)、(211)、(130)、(222)、(213)、(004)等 HAP 的特征晶面处峰变得更加明显,说明此时产物为HAP。
由图 6b 可得,固相产物的 n(Ca)/n(P)随陈化时间的延长而增大,由0 h 的1.67 增至24 h 的1.81。产物的 n(Ca)/n(P)高于化学计量比,这是由于碱性条件下,溶液吸收了空气中的CO2,产生的CO32-不仅能够和Ca2+直接反应生成CaCO3,在碱性溶液中还能够进入磷酸根的位置生成B 型碳酸化羟基磷灰石,使得固相产物的 n(Ca)/n(P)大于计量比[27]。

图6 陈化时间对固相产物的影响Fig.6 Effect of aging time on solid phase product
2.5 产物应用可能性分析
反应结束后固相产物的陈化时间可根据具体需要选择:陈化 0 h 时,产物为 ACP;陈化 48 h 时,产物为HAP。将陈化0 h 的产物经900 ℃煅烧2 h 后作XRD 测试,XRD 谱图如图 7 所示。 由图 7 可见,产物由 ACP 转化为 Ca3(PO4)2,再次证明陈化 0 h 的产物为 ACP。 其中 CaO 是 CaCO3分解产生的。 利用 GB 20412—2006《钙镁磷肥》中相关标准对陈化0 h 的产物的分析结果如表4 所示。由表4 可知,产物中有效五氧化二磷满足优等品标准。

表4 GB 20412—2006《钙镁磷肥》和产物指标对比Table 4 Standard and product properties of GB 20412—2006 calcium magnesium phosphate fertilizer %
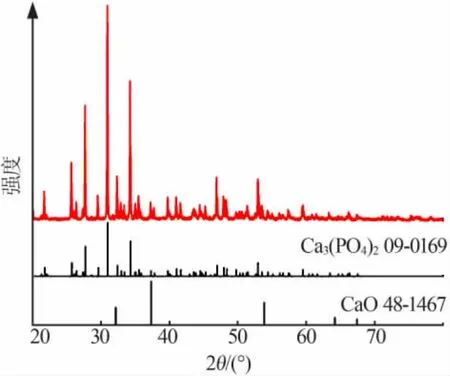
图7 陈化0 h 的产物经900 ℃煅烧2 h 后的XRD 谱图Fig.7 XRD patterns of the product aged for 0 h calcined at 900 ℃for 2 h
在碱性溶液中,HAP 是各种Ca-P 矿物中最稳定的矿物[28]。 HAP 因具备良好的生物相容性和晶格结构“柔软”的特性,被广泛用于环境污染修复领域[29]。0.05 g 产物 HAP 对铜离子(50 mL,100 mg/L)去除率见图8。 由图8 看出,其对铜离子的吸附速率较快,30 min 基本达到平衡,180 min 后铜离子的去除率达到96.80%,吸附容量达到96.80 mg/g,进一步说明实验所得HAP 具备环境修复潜能且吸附性能较好。
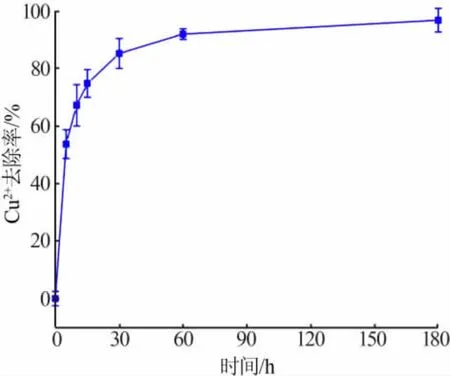
图8 HAP 的铜离子去除率Fig.8 Cu2+removal rate of HAP
3 结论与展望
研究巧妙地利用PW 高磷和DW 高钙、高pH 的特点,提出一种共处理工艺。 研究结果表明,PW 经过热处理、溶解、过滤、煮沸等预处理流程后,制备得到的磷储备液可用于DW 共处理同步高效回收磷和钙资源。 n(Ca)/n(P)=1.67、Ca→P 为最佳共处理条件,该条件下,Ca、P 回收率均大于 98.90%。 各影响因素中,DW 的 pH 和浓度变化对 Ca、P 回收率的影响较小。 陈化时间对Ca、P 回收率、产物形貌及其n(Ca)/n(P)有影响,随陈化时间延长,钙回收率增大而磷回收率减小; 产物由ACP 逐步转化为HAP;且产物的 n(Ca)/n(P)增加。 不同陈化时间的产物具有不同的应用可能性,ACP 中有效五氧化二磷满足GB 20412—2006《 钙 镁 磷 肥 》 优 等 品 标 准 ;HAP 具有吸附重金属离子的能力,铜离子吸附容量达到96.80 mg/g。研究提出的共处理工艺为PW、DW 的资源化利用提供了新思路。

