太子参水煎液对脾虚型大鼠肠道菌群的影响
朱妍锦,肖庆,黄雅婷,赵立,张继州,胡娟,,3*
(1.福建中医药大学药学院,福州350122;2.福建省中医药科学院,福州350003;3.福建中医药大学附属第二人民医院,福州350003)
太子参为石竹科植物孩儿参Pseudostellaria heterophylla(Miq.)Pax ex Pax et Hoffim.的干燥块根,具有健脾益气、生津润肺之功效,临床常用于脾虚体倦、食欲不振、气阴不足等症状[1]。太子参提取物可降低小鼠脾虚发生率,提升脾虚小鼠体能,对免疫器官指数也有明显的改善作用[2]。付杨等[3]证实了太子参须散及其多糖对于脾虚大鼠免疫功能的改善作用,发挥了太子参健脾益气的功效。
脾主运化水谷,统摄血液,运行水湿,并主四肢、肌肉的营养。脾气虚则四肢不用,五脏不安;实则腹胀,经溲不利[4]。脾虚,意为脾气虚弱或脾阴不足;脾虚与肠道菌群的失衡密切相关。当肠道微生态遭到破坏时,机体的脾胃功能受到影响;而随着脾胃功能的失调,同样会造成机体肠道菌群的紊乱[5]。Peng Y等[6]对脾虚患者的粪便微生物群变化进行了研究,证实脾虚患者与健康群体相比,其肠道菌群组成发生了较大的改变。
肠道菌群通过与机体相互作用,与机体维持着互利共生的状态;二者之间的动态平衡一旦被打破,肠道菌群就会从机体生命活动的各个途径影响人体健康[7]。目前研究发现,预防或控制肠道菌群的组成变化可能成为治疗肠道疾病的潜在途径[8]。中药可通过影响或改变肠道微生态的组成从而对肠道健康、疾病发展等产生影响,而高通量测序可精准确定肠道微生物群的变化,进而可探究其作用机制[9]。中药的部分有效成分不能被机体直接吸收,但可被肠道菌群代谢转化,从而发挥药效作用;其代谢产物又会对肠道微生物群产生影响[10,11]。
目前,太子参的相关研究大多聚焦于降血糖、心脏保护、免疫调节等领域,其通过调节肠道菌群进而治疗脾虚方面还未被深入探索。本研究旨在探索太子参水煎液对于脾虚型大鼠肠道微生态的影响,为太子参治疗脾虚的临床应用提供理论基础和实验依据。
1 仪器与试剂
1.1 仪器
Illumina NovaSeq6000基因测序系统;PhusionHigh-Fidelity PCR Master Mix with GC Buffer型PCR(New England Biolabs公司);酶标仪;NanoDrop分光光度计;R-100型全自动旋转蒸发仪(瑞士步琦有限公司);AE240型十万分之一电子分析天平(梅特勒-托利多仪器(上海)有限公司)等。
1.2 试剂
双歧杆菌乳杆菌三联活菌片(金双歧)(批号:202009226,内蒙古双奇药业股份有限公司);三氯乙醛(批号:E1725052,阿拉丁试剂(上海)有限公司);多聚甲醛(批号:20200609,国药集团化学试剂有限公司);氯化钠注射液(0.9%)(批号:C20042301A,江西科伦药业有限公司)等。实验用水为超纯水。
1.3 药材
太子参药材购自福建柘荣太子参种植基地,天人太子参药材(批号:TR-202001,柘参2号,福建天人药业股份有限公司)。
2 方法与结果
2.1 太子参水煎液的制备
准确称取太子参500 g,剪成0.3~0.8 cm小段,加入2.5 L超纯水,室温下浸泡0.5 h后煎药2次,1 h/次。合并药液蒸发浓缩至生药量为0.5 g/mL的太子参水煎液。
2.2 脾虚模型的建立、给药
SPF级雄性SD大鼠20只(200±20)g,随机分为空白组(n=5)和造模组(n=15)。造模组大鼠以苦寒泻下法建立脾虚泄泻模型。大黄加入5倍体积的超纯水,浸泡30 min后,微沸煎煮1 h,冷却后过滤残渣,得上层药液;将药液浓缩至生药量为1 g/mL大黄水提液。大黄水提液以10 g/kg灌胃,每天2次(间隔8 h),连续7天;空白(Blank)组以等量生理盐水灌胃。当造模组大鼠出现便溏、萎靡不振、毛发黯淡无光、畏寒倦怠等现象后,即显示造模成功[3],可开始给药。
将造模组大鼠随机分为模型(Model)组、阳性对照(positive control,PC)组、PHD组,每组5只。PHD组以3 g/kg PHD灌胃给药,PC组按0.2 g/kg灌胃给予金双歧溶液,Model组和Blank组等体积给予生理盐水。各组每天1次,连续7天给药。
2.3 取材及分析测定
末次给药24 h(自由饮水、进食)后,称量大鼠体重,以0.3 mL/100 g腹腔注射10%水合氯醛麻醉大鼠[12],常规消毒后正中切开腹腔,采集盲肠内容物。
2.3.1 盲肠内容物采集
在距回盲部末端10 cm以内,取盲肠内容物0.2 g,置于2 mL无菌离心管中密封,置于-80°C冰箱中冷冻保存。
2.3.2 肠道菌群宏基因组DNA提取、测序;生物信息学分析
2.3.2.1 对样本的基因组DNA进行提取,利用2%琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。
2.3.2.2 以稀释后的基因组DNA为模板,使用带Barcode的特异引物,对16S rDNA基因中的可变区V4区进行PCR扩增,引物序列如下:
515F:(CCTAYGGGRBGCASCAG),806R:(GGA CTACNNGGGTATCTAAT)。
2.3.2.3 PCR产物使用2%琼脂糖凝胶进行电泳检测;对PCR产物进行磁珠纯化,采用酶标定量,根据产物浓度进行等量混样,检测PCR产物后对目的条带回收产物。
2.4 数据处理与统计
2.4.1 组间差异性分析
使用SPSS 26.0软件对各组数据分析,通过单因素ANOVA分析及独立样本Kruskal-Wallis检验确定各组之间的差异性,P<0.05有统计学意义。
2.4.2 OTU聚类分析
对样本进行测序,质控后根据97%一致性将序列进行OTUs(Operational Taxonomic Units)聚类,然后与SSUrRNA数据库进行对比、物种注释,以获得样品中物种的多样性信息。
2.4.3 物种相对丰度
根据物种注释结果,选取每个样本或分组在科分类水平上相对丰度排名前10的物种,生成物种相对丰度柱形累加图,详见图1;分析结果见表1。
表1 科水平物种相对丰度 (n=5,±s)
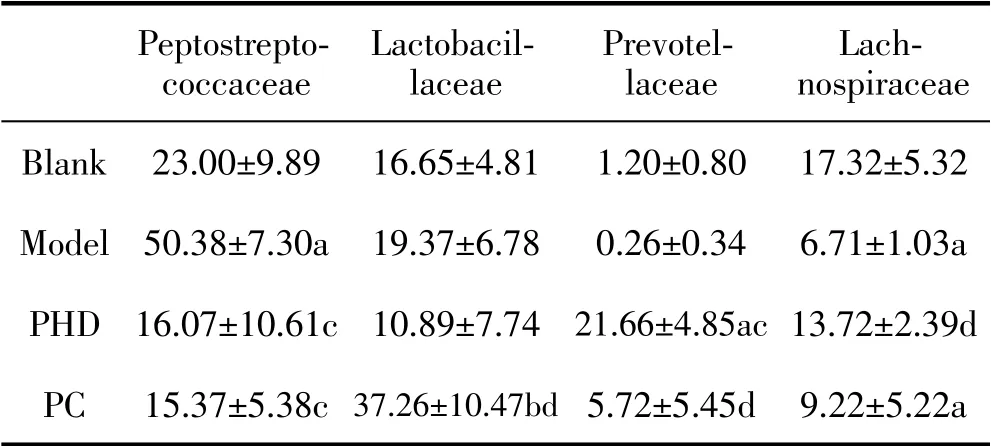
表1 科水平物种相对丰度 (n=5,±s)
注:与Blank组比较,aP<0.01,bP<0.05;与Model组比较,cP<0.01,dP<0.05。
Peptostreptococcaceae Lactobacillaceae Prevotellaceae Lachnospiraceae Blank 23.00±9.89 16.65±4.81 1.20±0.80 17.32±5.32 Model 50.38±7.30a 19.37±6.78 0.26±0.34 6.71±1.03a PHD 16.07±10.61c 10.89±7.74 21.66±4.85ac 13.72±2.39d PC 15.37±5.38c 37.26±10.47bd 5.72±5.45d 9.22±5.22a
由表1及图1可知,在科水平上,Peptostreptococcaceae(消化链球菌科)、Lactobacillaceae(乳酸杆菌科)、Prevotellaceae(普雷沃氏菌科)和Lachnospiraceae(毛螺菌科)有较高的物种相对丰度。与Blank组相比,Model组中Peptostreptococcaceae的相对丰度显著提升(P<0.01),Lachnospiraceae则显著降低(P<0.01);给药后,这种趋势显著逆转(P<0.05)。与Blank和Model相较,PHD组Prevotellaceae的相对丰度显著提升(P<0.01)。
研究表明,Peptostreptococcaceae与肠道菌群组成失衡、肠道炎症、结肠癌等疾病发生呈现正相关[13,14],在脾虚及其相关病症中含量有所上升[15],对肠道微生态产生负面影响;而PHD可显著降低其含量(P<0.01)。Lactobacillaceae是机体内知名的益生元,与肠道健康息息相关,对于免疫系统也具有一定的调节作用[16];与Model相比,PC组中金双歧的使用可显著提高其含量(P<0.01),而PHD对其含量没有明显影响。Prevotellaceae是肠道中生产短链脂肪酸的主要菌种之一[17],PHD可显著提升其相对丰度(P<0.01)。Lachnospiraceae是机体肠道中主要的丁酸生产菌种,而丁酸是结肠上皮细胞的首选能源,对维持肠屏障的正常功能非常重要[18,19];与模型组比较,PHD可显著提升Lachnospiraceae的相对丰度(P<0.05)。
2.4.4 MetaStat分析
使用MetaStat分析,得到Blank组、Model组以及PHD组间的属水平菌种差异,并绘制箱型图,详见图2。
由图2A可知,与Blank组相比,Model组在属水平上Rombutsia的菌种丰度具有显著提高(P<0.05),Lachnospiraceae_NK4A136_group、Fournierella、Christensenellaceae_R-7_group的含量显著降低(P<0.05)。由图2B可知,与Blank组相比,PHD组中Alloprevotella(拟普雷沃菌属)的丰度显著提升(P<0.05)。由图2C可知,与Model组比较,PHD组中Rombutsia的含量显著降低(P<0.05),而Prevotella(普雷沃菌属)、Agathobacter、Fusicatenibacter的丰度显著提高(P<0.05)。
Rombutsia属于Peptostreptococcaceae,Model组的Rombutsia丰度显著高于Blank组与PHD组(P<0.05),这可能是Model组Peptostreptococcaceae相对丰度显著降低的原因(P<0.05),而Rombutsia与肠道中的蛋白质代谢有关[20]。
Lachnospiraceae_NK4A136_group、Agathobacter和Fusicatenibacter属于Lachnospiraceae。其中Lachnospiraceae_NK4A136_group与肠道内碳水化合物的消化分解以及胆汁酸代谢有关,与肥胖症等多种疾病呈现负相关[21–23];与Blank组比较,Model组Lachnospiraceae_NK4A136_group含量的显著降低(P<0.05)可能是Lachnospiraceae相对丰度显著降低的原因(P<0.05)。Agathobacter与结直肠癌等疾病呈现负相关[24];Fusicatenibacter可阻止某些细菌感染进程[25];与Model组相比,PHD组Lachnospiraceae相对丰度的显著提升(P<0.05)可能是由于Agathobacter和Fusicatenibacter的丰度显著提高(P<0.05)。
Alloprevotella和Prevotella属于Prevotellaceae,Alloprevotella可在肠道中代谢、产生丁酸,影响肠道健康,Prevotella则是人体肠道的典型菌种[26–28];与Blank组、Model组相比,Alloprevotella和Prevotella在PHD组中菌群丰度的显著提升(P<0.05),可能是Prevotellaceae相对丰度显著提高的主要原因(P<0.05)。
Fournierella属于Ruminococcaceae(瘤胃球菌科),Ruminococcaceae是短链脂肪酸的主要生产菌科,参与肠道中某些多糖、纤维的降解及胆汁酸代谢,是人体肠道内知名的有益菌[29,30]。Christensenellaceae_R-7_group属于Christensenellaceae(克里斯滕森菌科),Christensenellaceae与炎性肠病、肠易激综合征呈现负相关,同时参与机体代谢、遗传变异等健康过程[31],Christensenellaceae_R-7_group则会对肠道内葡萄糖代谢产生影响[32]。
3 讨论
肠道菌群与人体健康息息相关,中医传统的脾虚病症和肠道菌群组成之间存在相互作用。肠道微生物对于脾虚影响的相关研究正被不断展开[33],而有关于健脾、补气类中药及其有效成分通过改变肠道微生态环境进而治疗脾虚的研究亦有相当的进展[34]。太子参是经典的健脾益气类中药,本课题研究太子参水煎液对于脾虚型大鼠肠道菌群的影响,旨在探索其作用机制,为太子参治疗脾虚的临床应用提供理论基础和实验依据。
实验结果表明,PHD对于脾虚型大鼠肠道菌群组成具有一定的影响。在科水平上,PHD可显著提高Prevotellaceae和Lachnospiraceae等有益菌的相对丰度(P<0.05),显著降低Peptostreptococcaceae等有害菌的相对丰度(P<0.01)。在属水平上,太子参水煎液组中Prevotella、Agathobacter、Fusicatenibacter等菌的丰度有显著提高(P<0.05),Rombutsia等菌的丰度显著降低(P<0.05)。
本实验明确太子参水煎液可通过影响肠道菌群组成,进而对脾虚型大鼠发挥一定的治疗效果。

