基于网络药理学的叶下珠作用机制分析
潘新波,萨日娜,赵丽娟,张 伟,李彩东*
(1.兰州市第二人民医院,甘肃 兰州 730046;2.北京中医药大学,北京 100029;3.甘肃省人民医院,甘肃 兰州 730000)
叶下珠(PhyllanthusurinariaL.)为大戟科叶下珠属植物, 药用全草,是我国传统中草药。有平肝清热、利水解毒之功效,民间多用来治疗小儿疳积、肠炎、尿路感染和黄疸肝炎等病症[1]。近年来,国内外学者对叶下珠的基础研究主要集中在化学成分、药理作用及机制,临床研究主要集中在抗乙肝病毒、抗肝细胞纤维化、改善肝功能及抗肿瘤等方面[2,3],有关其抗肿瘤、抗血栓及抗氧化等作用的研究发现,叶下珠化学成分丰富,药理作用显著[4,5],是一种值得深入开发的天然药物[6]。本研究采用网络药理学的方法,借助化合物、蛋白、疾病以及生物信息注释等多个数据库,构建叶下珠化合物-靶点-信号通路-疾病的网络预测模型,从分子水平预测并探讨叶下珠的药理作用机制,为更有针对性地深入开展叶下珠的实验研究及临床合理应用提供参考。
1 资料与方法
1.1 化合物的收集
以“叶下珠”“PhyllanthusurinariaL.”“Phyllanthusurinaria”或“PhyllanthusurinariaLinn.”为关键词检索中国知网(https://www.cnki.net/)、万方数据库(www.wanfangdata.com.cn)、PubMed(https://www.ncbi.nlm.nih.gov/)、Springer(https://link.springer.com/)、Elsevier(https://www.elsevier.com/en-xs)、Wiley Online Library(https://onlinelibrary.wiley.com/)和Taylor & Francis Online(https://www.tandfonline.com/)等中英文引文数据库,并对中国天然产物化学成分数据库(http://www.pharmdata.ac.cn/cnpconline/)、台湾中医药资料库(http://tcm.cmu.edu.tw/)、TCMSP(http://tcmspw.com/)、TCMID(http://www.megabionet.org/tcmid/)和BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm/)数据库进行查询,检索日期截止至2020年9月30日,收集叶下珠中所含化合物。
1.2 化合物筛选
根据药物的吸收、分布、代谢、排泄(ADME)相关特性,以Lipinski五规则作为评估类药性的重要指标[7-8],另结合文献对未纳入筛选标准但已有报道叶下珠中具有生物活性和药理作用的化合物进行收集。将化合物信息在PubChem(https://pubchem.ncbi.nlm.nih.gov/)中检索,获得相应的SMILES结构式。
1.3 化学物靶点预测及化合物-靶点通络网络构建
将收集的叶下珠中化合物SMILES结构式,分别采用TCMSP、TCMID、CHEMBL(https://www.ebi.ac.uk/chembl/)、SWISS(http://www.swisstargetprediction.ch/)(probability≥0.7)、STICH(http://stitch.embl.de/)(score≥0.7)在线靶标预测平台进行检索[9],预测靶标蛋白,在NCBI和Uniprot数据库中标准化基因名,采用Cytoscape 3.7.2软件构建叶下珠化合物-靶点网络图。
1.4 网络构建与靶标分析
通过STRING(https://string-db.org/)构建蛋白-蛋白相互作用(PPI)网络,蛋白种属设置为“Homosapiens”,最低相互作用阈值设为中等“medium confidence”(0.4),其他参数采用默认设置。采用Cytoscape 3.7.2中CytoNCA插件进行拓扑属性分析,以度中心性(DC)、介度中心性(BC)、接近中心性(CC)、特征向量中心性(EC)、网络中心性(NC)和局部边连通性(LAC)为指标,在PPI网络中,筛选DC≥2倍中位数,BC、CC、EC、NC、LAC分别≥1倍中位数的靶点,作为叶下珠发挥治疗作用的候选靶点,并构建候选靶点与对应化学成分网络图,利用Cytohubba插件获取degree值分别前10的Hub靶点和叶下珠发挥作用的关键成分[10]。
1.5 预测候选靶点与疾病分析及网络构建
在TCMSP、DisGenet(http://www.disgenet.org/web/DisGeNET/menu/search)、DrugBan(https://www.drugbank.ca/)、OMIM(https://omim.org/)、TTD(http://db.idrblab.net/ttd/)、CTD(http://ctdbase.org/)和PubMed中收集叶下珠候选靶点对应的疾病,将候选靶标蛋白和对应疾病构建候选靶点-疾病网络,选取degree值≥2倍中位数的对应疾病并进行分析。
1.6 靶标通路富集分析
利用DAVID数据库(https://david.ncifcrf.gov/)输入所筛选的叶下珠10个Hub靶点,设定阈值P<0.01,进行基因本体(GO)富集分析和基因功能(KEGG)通路富集分析,通过Omicshare Tools 3.0在线绘图网站(http://www.omicshare.com/)对结果进行可视化处理。
1.7 化合物-靶点-信号通路-疾病网络构建
将所筛选叶下珠degree值前10的关键成分及Hub蛋白、“1.6”项下富集筛选后的KEGG信号通路及“1.5”项下筛选后的疾病,采用Cytoscape 3.7.2软件中Merge功能构建叶下珠关键成分-关键靶点-信号通路-疾病网络,进一步分析探讨叶下珠化合物、靶点和信号通路在治疗相关疾病的作用机制。
2 结果
2.1 化合物收集及筛选
截止2020年9月30日,共检索出相关文献502篇,结合数据库查询,收集叶下珠中356个化合物。以Lipinski五规则作为筛选标准,结合文献共纳入205个化合物,在PubChem数据库获得相应的SMILES结构式。
2.2 靶点获取、化合物-靶点网络及PPI网络构建
将收集的205个化合物采用TCMSP、TCMID、CHEMBL、SWISS、STICH在线靶标预测平台检索,共有154个化合物匹配到651个靶标蛋白,在Uniprot中标准化基因名,构建化合物-靶点网络,见图1-A,另将651个靶点通过STRING构建PPI网络,见图1-B。采用Cytoscape 3.7.2中CytoNCA插件分析所得PPI网络,按照“1.4”项下指标筛选,共得到36个候选靶点,对应叶下珠中82个化合物,具体信息见表1,图2为36个候选靶点PPI网络图。以候选靶点与对应化学成分构建网络图,见图3-A。以degree值筛选度值前10的Hub蛋白,依次为PTGS2,HSP90AA1,CASP3,ESR1,TNF,AKT1,MMP9,JUN,MTOR,PPARG,叶下珠发挥作用的关键成分按度值大小依次为Pu31、Pu1、Pu40、Pu39、Pu6、Pu139、Pu30、Pu10、Pu8和Pu11,即(-)-Epigallocatechin gallate(表没食子儿茶素没食子酸酯)、quercetin(槲皮素)、Luteolin(木犀草素)、Fisetin(非瑟酮)、ellagic acid(鞣花酸)、Eupatilin(异泽兰黄素)、(-)-Epicatechin(表儿茶素)、rutin(芸香苷)、kaempferol(山柰酚)、Corilagin(柯里拉京)。

注:A.154个化合物-651个靶点网络图;B.651个靶点PPI网络。

图2 叶下珠中36个候选靶点PPI网络

注:A.36个候选靶点-82个化合物网络图;B.degree值筛选前10的关键靶点与关键成分网络图。

表1 叶下珠中候选化合物信息
2.3 预测候选靶点与疾病、疾病靶点的筛选
将36个候选靶点分别在TCMSP、DisGenet、DrugBank、OMIM、TTD、CTD和PubMed数据库中检索,获得叶下珠36个候选靶点匹配的疾病299种,构建靶点-疾病网络Ⅰ,见图4。为更为直观探讨分析叶下珠治疗疾病的机制,本研究对其10个关键Hub靶标蛋白对应的227种疾病构建关键靶点-对应疾病网络Ⅱ,见图5,以degree值≥2倍中位数(n=1),即degree≥2为筛选条件,收集叶下珠发挥治疗作用的候选疾病97种,与相应的靶点蛋白重新构建靶点-疾病网络Ⅲ,见图6。

注:节点的大小与节点的度值呈正比例关系。

注:节点的大小与节点的度值呈正比例关系。
2.4 靶标通路富集分析
DAVID数据库中GO功能富集分析结果见图7,以P<0.01为筛选条件,得到GO条目37个,其中BP(生物过程)条目29个、CC(细胞组分)条目2个、MF(分子功能)条目6个,分别占78.4%、5.4%、16.2%,其纳入条目主要分为基因表达、转录翻译、增殖凋亡、糖皮质激素、雌激素、含氮物质代谢及代谢调控等方面。

图7 叶下珠10个关键靶点的GO分析
KEGG Pathways分析筛选得到24条通路(P<0.01),以疾病相关程度和P值进行筛选,其中基因数目≥4的通路有9条,见图8,主要涉及癌症信号通路(Pathways in cancer)、肿瘤坏死因子信号通路(TNF signaling pathway)、癌症蛋白聚糖(Proteoglycans in cancer)、雌激素(Estrogen signaling pathway)、乙肝(Hepatitis B)等信号通路。

注:Rich factor值越大,表明通路富集程度越高;点的大小表示富集到的靶点数量。
2.5 关键成分-关键靶点-信号通路-疾病网络构建
所构建的叶下珠关键成分-靶点-信号通路-疾病网络,见图9。叶下珠以(-)-Epigallocatechin gallate、quercetin、Luteolin、Fisetin、ellagic acid、Eupatilin、(-)-Epicatechin、rutin、kaempferol和Corilagin为关键成分,作用于PTGS2、TNF等10个关键靶标蛋白,主要通过调控Pathways in cancer、TNF signaling pathway、Proteoglycans in cancer和Estrogen signaling pathway等信号通路,发挥治疗Colonic Neoplasms、Inflammation、Adenocarcinoma、Liver Neoplasms等17种不同疾病的作用。结合相关文献,通过图9分析结果,本文预测了叶下珠中特征性成分发挥治疗疾病的作用机制,结果见表2。结果显示,Corilagin、(-)-Epicatechin和(-)-Epigallocatechin gallate主要通过PTGS2、TNF和HSP90AA1靶点,调控Pathways in cancer、TNF signaling pathway及T cell receptor signaling pathway和Toll-like receptor signaling pathway信号通路,治疗结肠肿瘤、腺癌、前列腺肿瘤、膀胱肿瘤、肝肿瘤和乳腺癌及炎症的作用,ellagic acid通过AKT1、MMP9靶点,调控Prostate cancer、Toll-like receptor signaling pathway、T cell receptor signaling pathway及Pathways in cancer信号通路,发挥治疗前列腺肿瘤、膀胱癌、结肠肿瘤及炎症的作用;此外,Corilagin、(-)-Epigallocatechin gallate可能通过TNF靶点,调控MAPK signaling pathway信号通路,治疗心肌梗死、动脉粥样硬化和脑缺血,且上述三种化合物还可通过TNF靶点,调控TNF signaling pathway信号通路,治疗再灌注损伤。其他非特征性成分Fisetin、Luteolin、quercetin、rutin和kaempferol可通过作用于TNF、PTGS2、AKT1及MMP9,发挥抗炎、抗癌作用。Fisetin、quercetin、Luteolin、kaempferol、rutin及Eupatilin可作用于TNF、CASP3和JUN,发挥抗氧化、抗血栓的作用,可治疗心肌梗死、动脉粥样硬化、脑损伤和阿尔兹海默病等。Quercetin、kaempferol、Luteolin和Eupatilin可作用于PPARG,治疗结肠肿瘤、Ⅱ型糖尿病、腺癌、肝肿瘤、动脉粥样硬化和阿尔兹海默病等。
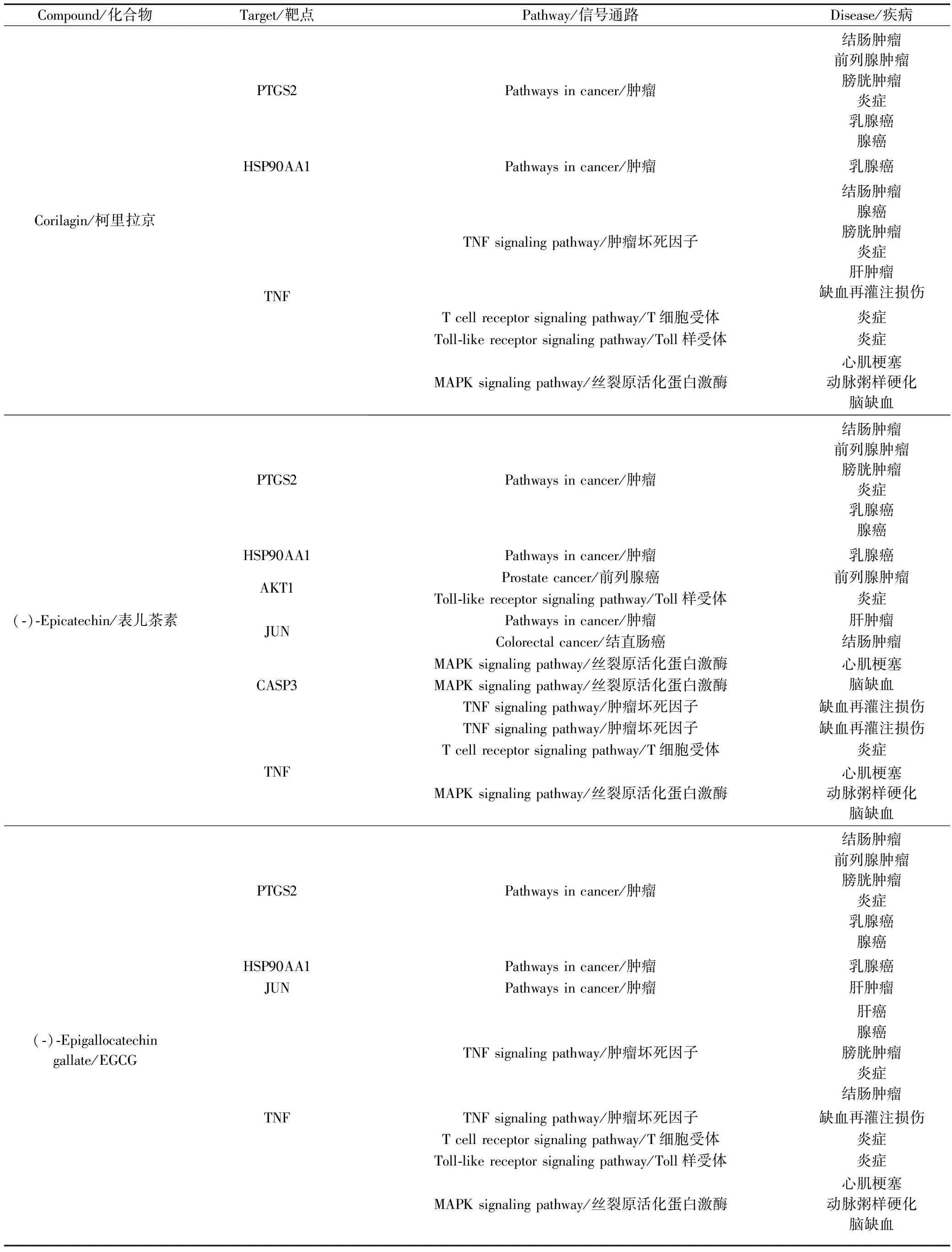
表2 叶下珠主要药理作用机制分析

注:波浪线箭头代表近几年叶下珠特征性成分新的药理作用机制预测;虚线箭头代表叶下珠特征性成分主要药理作用机制预测;三角形代表特征性化合物;菱形代表degree值前5的信号通路;倒三角箭头代表所主要治疗疾病;节点的大小与节点的度值呈正比例关系。
3 讨论
叶下珠具有利水解毒、平肝清热功效,作为利尿剂和解毒剂在全球亚热带区域国家均有使用。近年来,国内外学者对叶下珠在抗乙型肝炎病毒、保肝护肝、抗肿瘤、抗病原微生物、抗氧化、抗血栓等药理作用研究方面均取得一定进展[11-12]。由于该药物资源丰富,提取物低毒性[13],未见不良反应报道,故应用开发前景广阔。
本研究通过数据库检索,运用网络药理学构建了叶下珠活性成分-靶点-信号通路-疾病网络,系统预测了叶下珠发挥药理作用的关键物质基础,即10种化合物,10个潜在关键作用靶点,24条信号通路和17种疾病。既往研究表明,表没食子儿茶素没食子酸酯通过影响多条信号转导通路中的多个靶分子,抑制肿瘤血管新生和肿瘤转移,具有细胞周期抑制和促凋亡作用[14]。槲皮素具有抗自由基、抗氧化、抗炎、抗癌防癌、抗菌、抗病毒及预防和治疗心血管疾病等多种生物活性及药理作用[15-17]。木犀草素具有抗氧化、抗炎、抗肿瘤、抗菌、抗过敏、抗纤维化、抗糖尿病、神经保护和心脏保护等多种药理作用[18-20]。非瑟酮具有对抗不同病理过程的作用,如抗氧化、抗炎、抗肿瘤、降糖、神经保护、抗动脉粥样硬化等[21-22]。鞣花酸作为一种天然多酚类生物活性物质,具有清除自由基、抗肿瘤、抗炎、抗病毒效能等多种药理作用[23-24]。异泽兰黄素具有抗炎、抗氧化、抗肿瘤等多种显著的药理活性[25],其抗炎和细胞保护活性较强,现已开发出保护消化道黏膜的胃肠道用药,对多种癌细胞有抑制作用,并对化疗药物有减毒效果[26]。国外研究显示表儿茶素能明显减缓氧化,预防癌症,减轻炎症,延迟或治疗人和动物中由衰老和神经引起等相关病症[27-28]。芸香苷具有抗氧化、抗炎、抗糖尿病、抗肥胖、抗癌、神经保护、血管保护及心脏保护等多种药理学活性,在消化系统疾病的炎症过程中具有明显的调节作用[29-30]。现代药理研究发现,山柰酚具有抗氧化、抗炎、抗癌、保护神经、肝脏和心肌、防治糖尿病和骨质疏松等药理活性[31-33],已在临床上用于治疗胃癌及心脑血管疾病[34]。柯里拉京具有抗肿瘤、抗氧化、抗动脉粥样硬化、抗纤溶、降血压、抑制病毒、抗菌、抗炎等广泛的药理活性[35-36]。因此推测叶下珠治疗结肠肿瘤、腺癌、前列腺肿瘤、膀胱肿瘤、肝肿瘤和乳腺癌及炎症的机制可能与TNF、AKT1、PTGS2和MMP9靶点有关,治疗心肌梗死、动脉粥样硬化和脑缺血的机制可能与靶点TNF、CASP3有关。
本研究运用网络药理学技术,对叶下珠中的多组分、多靶点及疾病之间的关系和作用机制进行了较为系统的预测分析,通过对所筛选出的以表没食子儿茶素没食子酸酯(EGCG)、鞣花酸、柯里拉京为代表的10个关键化合物进行了靶点、疾病及信号通路分析,与所检索文献[11-14, 37]针对叶下珠近年来药理学研究分析结果所显示叶下珠具有抗肿瘤、抗炎、抗氧化和抗血栓等主要药理作用较为一致,且表没食子儿茶素没食子酸酯(EGCG)、鞣花酸、表儿茶素和柯里拉京均为多酚类成分,也是近年来对叶下珠化学成分分析研究的特征性成分。除此之外,本研究具有的一些特色体现在构建了其关键核心靶点所对应核心化合物及信号通路和疾病的多层次网络模型图,并结合当前相关文献研究结果进行印证,为进一步明确叶下珠的药理作用机制提供了研究参考。
本研究结论尚存在一定的局限性,由于各数据库检索数据和文本挖掘获取化合物及靶点数量有限,且槲皮素、芸香苷及山柰酚在自然界植物中大量存在,靶点、信号通路及疾病数据存在对这几种物质筛选有一定的倾向性,采用相应分析软件的分析算法仅评价节点相互关系,未考虑各候选成分含量、化合物间相互作用及药物体内代谢过程等因素,预测结果可能存在偏差,还需进一步体内体外的药理和临床试验验证。

