重组猪源罗伊氏乳酸杆菌分泌表达牛乳铁蛋白肽对新生仔猪生长性能的影响以及抗腹泻病毒感染的保护作用研究
汪昭睿 王雪莹 解伟纯 宋丽影 王晓娜,2 崔 文,2 姜艳平,2 周 晗,2 王 丽,2 乔薪瑗,2 徐义刚,2 李一经,2 唐丽杰,2*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.农业部动物疫病病原生物学重点实验室东北科学观测实验站,哈尔滨 150030)
仔猪病毒性腹泻是哺乳期和断乳期仔猪的主要肠道疾病,发病率高、防治困难是造成仔猪生长迟缓和死亡的主要原因[1],不但给养殖业带来直接的经济损失,还为动物食品安全和人类健康埋下隐患[2]。因此,开发一种安全有效的微生态制剂,如增强黏膜免疫的益生菌和抗菌肽等,可提高仔猪自身免疫机能、促进营养物质吸收及调节肠道菌群,对于预防和控制腹泻病毒的感染提供新的研究方向。乳酸菌在分子生物学和基因工程研究中是比较理想的载体[3]。以罗伊氏乳杆菌为材料的微生态制剂能调节肠道菌群平衡[4]、促进营养物质吸收[5]、抑制胃肠道内病原微生物的增殖[6],不会产生损害机体的毒素,能刺激身体产生非特异性免疫,尤其是黏膜免疫。研究表明,罗伊氏乳酸杆菌对胆汁和胃酸具有良好的耐受性,且细胞外存在黏附素,因此可以顺利到达小肠的上部并对宿主的肠黏膜上皮细胞具有较强的黏附能力[7-8]。Yi等[9]研究发现,在仔猪饲养中添加罗伊氏乳酸杆菌,可促进仔猪小肠的生长并显著增加其绒毛高度,从而促进小肠对营养的吸收能力。此外,罗伊氏乳酸杆菌可以促进仔猪肠道紧密连接蛋白的表达并调节紧密连接蛋白磷酸化,与黏液补充剂共同作用还可以保护肠道屏障不被抗生素破坏[10]。另外,作为向宿主胃肠道呈递蛋白质的载体,本动物源乳酸菌能够在肠道中定植,因此可以防止抗菌肽没有达到靶位点就被降解。也避免为了达到治疗效果而提高抗菌肽浓度,从而引起严重的毒性和副作用。牛乳铁蛋白肽(LFCA)是经水解作用后由其N端释放的一种纯天然的活性肽,能够刺激肠道黏膜上皮细胞及淋巴细胞的相互作用增强黏膜免疫,同时促进免疫球蛋白和抗炎因子的产生,具有抗菌、抗病毒和增强机体免疫力等多种生物学功能[11-13]。Volzing等[14]将异源抗菌肽表达盒基因插入乳酸菌表达载体中,证明其抑菌活性可以不影响宿主,并能打破抗菌肽半衰期以及成本高的限制。本实验室曾构建无需诱导且持续表达的干酪乳杆菌组成型表达猪抗菌肽[15],既可以促进小鼠生长,又能改善其机体的免疫功能;构建的表达LFCA的重组鸡源乳酸杆菌pPG-XLFEC/M11[16],可以增强机体的免疫应答水平,对雏鸡抵抗传染性法氏囊病病毒(IBDV)具有一定的作用。由于LFCA对铁离子需求低的乳酸菌基本不抑制,同时罗伊氏乳酸杆菌本身对胃肠道环境有较好的耐受性,能产生有机酸和罗伊氏菌素抑制病原菌的生长,保护肠道的微生态平衡。因此将罗伊氏乳酸杆菌作为表达LFCA的载体,结合了宿主菌的天然益生作用和口服制剂的载体优势[17]。本研究将构建能够稳定表达LFCA的重组猪源罗伊氏乳酸杆菌菌株pPG-LFCA/LR-CO21,将能够引起新生仔猪病毒性腹泻的重要病原猪传染性胃肠炎病毒(TGEV)作为感染模型,初步评价该重组菌对仔猪生长性能的影响以及口服保护效果,为该重组菌作为微生态制剂的应用奠定理论和实践基础。
1 材料与方法
1.1 试验材料
1.1.1 病毒、细胞和菌株
ST细胞、猪源罗伊氏乳杆菌菌株CO-21及TGEV TH98毒株由本实验室保存;转染过空载体质粒的猪源罗伊氏乳酸杆菌菌株pPG/LR-CO21、表达LFCA基因的菌株pPG-LFCA/TG1由本实验室构建并保存。
1.1.2 主要试剂
MRS肉汤培养基购自青岛海博生物技术有限公司;DMEM购自上海源培生物科技股份有限公司;特级新生牛血清购自呼和浩特市草原绿野生物材料有限公司;小量质粒DNA提取试剂盒购自爱思进生物技术(杭州)有限公司;粪便基因组提取试剂盒购自天根生化科技有限公司;FastStart Universal SYBR Green Master购自Roche公司;荧光探针CFDA-SE购于Sigma公司。CCK-8试剂盒购自生工生物工程(上海)股份有限公司;辣根过氧化物酶(HRP)标记的山羊抗鼠免疫球蛋白G(IgG)抗体购自Sigma生物公司;猪IgG酶联免疫吸附试验检测试剂盒、猪白细胞介素-10(IL-10)酶联免疫吸附试验检测试剂盒、猪肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验检测试剂盒和猪分泌型免疫球蛋白A(sIgA)酶联免疫吸附试验检测试剂盒购自武汉酶免生物科技有限公司。LFCA单克隆抗体4E10、TGEV N蛋白单克隆抗体由本实验室保存。新生仔猪的基础饲粮为北京中国农科院试验基地生产的代乳粉。
1.1.3 试验动物
1日龄、体重约为1.5 kg的新生杜长大仔猪共98只,购于东北农业大学阿城实验实习基地。
1.2 试验设计
1.2.1 试验1
试验1研究重组猪源罗伊氏乳杆菌pPG-LFCA/LR-CO21在仔猪体内定植情况以及对生长性能的影响。选取1日龄、体重约为1.5 kg的新生杜长大仔猪36头,随机分为3组,每组12头,群体饲养,仔猪饲养于东北农业大学阿城实验实习基地,采用母猪哺乳喂养的方式。重组菌组口服二乙酰羧基荧光素-琥珀酰亚胺酯(CFDA-SE)标记的pPG-LFCA/LR-CO21(5×109CFU/mL)4 mL,空载菌组口服含有空载体质粒的重组猪源罗伊氏乳杆菌pPG/LR-CO21(5×109CFU/mL) 4 mL,对照组口服4 mL磷酸盐缓冲液(PBS),连续口服3 d,口服后观测时间为14 d,每天观察并记录各组仔猪体重变化和腹泻情况,流式细胞术检测重组菌在仔猪体内不同肠段的定植率。
1.2.2 试验2
试验2研究新生仔猪感染TGEV后半数致死量的条件。选取1日龄、体重约为1.5 kg的新生杜长大仔猪30头,仔猪饲养于本实验室隔离屏障系统,采用人工饲养的方式喂养仔猪配方奶粉,奶粉参照GB 10765—2010营养需要配制,保持仔猪生活环境温度为35 ℃,不同试验组之间仔猪隔离喂养。仔猪每隔4 h饲喂1次,每头按照7 g奶粉添加42 mL温水的比例冲泡,奶粉的饲喂温度为40 ℃。预先用ST细胞测定TGEV的半数组织培养感染剂量(TCID50)为10-7.50/mL,设计5组感染剂量,分别为口服1、3、6、9、12 mL TCID50为10-7.50/mL的TGEV,设置7 d时间为观察期。
1.2.3 试验3
试验3研究重组菌对仔猪抵抗TGEV感染的效果分析以及仔猪肠道微生态平衡的影响。选取1日龄、体重约为1.5 kg的新生杜长大仔猪32头,随机分为4组,每组8头仔猪。仔猪饲养于本实验室隔离屏障系统,采用人工饲养的方式喂养仔猪配方奶粉,7日龄前每头仔猪每隔4 h饲喂1次,7日龄后每头仔猪每隔6 h饲喂1次(10 g奶粉加60 mL温开水比例冲泡)。重组菌组每头每天口服pPG-LFCA/LR-CO21(5×109CFU/mL)4 mL,空载菌组每头每天口服pPG/LR-CO21(5×109CFU/mL)4 mL,对照组及TGEV感染组每头每天饲喂4 mL的PBS,连续口服饲喂7 d,在8日龄感染组口服6 mL TCID50为 10-7.50/mL的病毒液,感染7 d后进行样品采集。
1.3 测定方法
1.3.1 重组猪源罗伊氏乳酸杆菌pPG-LFCA/LR-CO21的构建与蛋白表达
将实验室保存的LR-CO21于MRS培养基扩大培养至吸光度(OD)600 nm为0.4~0.8。冰浴后4 ℃离心,沉淀用预冷的溶液重复洗涤,制备LR-CO21感受态细胞。对pPG-LFCA/TG1菌株提取质粒pPG-LFCA,电转化至罗伊氏乳酸杆菌LR-CO21感受态细胞中,涂布于5 μg/mL氯霉素抗性的MRS琼脂培养基上,37 ℃静置培养36 h。随机挑取单菌落,扩大培养后提取质粒进行PCR鉴定,将鉴定正确的重组猪源罗伊氏乳酸杆菌兼性厌氧培养16~18 h后取样,通过超声处理菌液沉淀,经聚丙烯酰胺凝胶电泳(SDS-PAGE)鉴定后,将凝胶中的蛋白转印至聚偏氟乙烯(PVDF)膜上,以实验室制备的LFCA单克隆抗体4E10作为一抗,以HRP标记的山羊抗鼠IgG作为二抗进行Western blot鉴定。用人工合成的标准蛋白以不同浓度包被孔板,设置3个平行孔,进行3次重复试验。按照1∶400比例稀释制备的LFCA单克隆抗体4E10,绘制LFCA定量曲线。将培养时间为8、10、12、14、16、18、20、22、24 h的pPG-LFCA/LR-CO21上清和菌体进行酶联免疫吸附试验,根据标准曲线计算重组菌表达LFCA的含量,最终得到重组菌表达LFCA的最佳条件。
1.3.2 重组猪源罗伊氏乳酸杆菌pPG-LFCA/LR-CO21对新生仔猪生长性能的影响
将36头1日龄、体重约为1.5 kg的新生杜长大仔猪随机分成3组,每组12头,群体饲养,3个组分别为重组菌组、空载菌组、对照组,试验期间3个组于1~3日龄每天每头按照2×1010CFU的剂量口服,重组菌组口服CFDA-SE标记的pPG-LFCA/LR-CO21(5×109CFU/ml)4 mL,空载菌组口服含有空载体质粒的pPG/LR-CO21(5×109CFU/mL)4 mL,均通过PBS进行稀释,对照组口服等体积的PBS,连续口服3 d,口服后观测时间为14 d。试验期间仔猪奶粉主要组成为:全脂奶粉、浓缩乳清蛋白、乳清粉、乳糖、乳脂肪、维生素、有机微量元素、活性酵母、果寡糖、甘露寡糖等,奶粉营养成分见表1。试验第1~17天,每天对个体进行称重并记录,计算平均日增重(ADG),腹泻评分标准如表2所示。相关计算公式如下:

表1 奶粉营养成分Table 1 Nutrition of milk powder %

表2 仔猪腹泻评分标准Table 2 Score criterion for diarrhea of piglets
ADG(kg/d)=总增重/试验天数;腹泻率(%)=[总腹泻头数/(仔猪头数×试验天数)]×100。
1.3.3 重组猪源罗伊氏乳酸杆菌pPG-LFCA/LR-CO21在新生仔猪体内的定植效果分析
CFDA-SE是一种可对活细胞进行非特异性荧光标记的细胞染色试剂。将10 mmol/L CFDA-SE储存液用PBS按1∶800稀释成工作液,调整菌液浓度约为5×108CFU/mL后与等量CFDA-SE工作液混合均匀,37 ℃水浴30 min,离心并用PBS清洗2次,0.75%的甲醛溶液固定后,通过流式细胞术检测重组猪源罗伊氏乳酸杆菌的阳性标记率。在连续口服重组菌后4、7、14 d,对重组菌组仔猪刮取十二指肠、空肠、回肠、盲肠、结肠肠段黏液样本,流式细胞术分析重组菌在仔猪各肠段的定植率。
1.3.4 重组猪源罗伊氏乳酸杆菌pPG-LFCA/LR-CO21对新生仔猪感染TGEV的效果分析
用ST细胞预先测定TGEV TCID50为10-7.50/mL,选取1日龄、体重约为1.5 kg的新生杜长大仔猪30头,按照感染剂量分为5组,分别口服1、3、6、9、12 mL TCID50为10-7.50/mL的TGEV。设置7 d时间为观察期,分析半数致死量的条件。另外重新选取36头1日龄、体重约为1.5 kg的新生杜长大仔猪,随机分为4组,分别为重组菌组、空载菌组、对照组及TGEV感染组,每天每头按照2×1010CFU的剂量分别口服CFDA-SE标记的pPG-LFCA/LR-CO21、含有空载体质粒的pPG/LR-CO21、等体积的PBS,口服7 d后按照半数致死剂量口服6 mL TCID50为10-7.50/mL的TGEV,感染7 d后(有死亡仔猪及时剖检),对4组试验仔猪进行样品采集。饲喂期间记录仔猪的ADG、腹泻率,设置7 d的观察期,计算重组菌对仔猪感染TGEV后的存活率的影响。对仔猪进行剖杀,肠道组织用4%多聚甲醛固定,制备石蜡切片及苏木精-伊红(HE)染色,观察小肠病理学变化;酶联免疫吸附试验试剂盒检测仔猪血清中总IgG和肠黏液总sIgA抗体含量;液氮研磨后,Trizol法提取肠组织总RNA并反转录为cDNA,实时荧光定量PCR测定仔猪肠黏膜组织中紧密连接蛋白相关基因封闭蛋白-1(Claudin-1)、闭合蛋白(Occludin)和紧密连接蛋白-1(ZO-1)以及炎性因子白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、干扰素-γ(IFN-γ)、TNF-α及Toll样受体2(TLR2)mRNA相对表达量。
为检测重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪的肠道微生物生态平衡的影响,利用天根粪便基因组提取试剂盒提取粪便中的DNA。设计16S rDNA引物进行细菌标准V3~V4区扩增。反应程序如下:第1轮扩增,预变性94 ℃,2 min;变性98 ℃,10 s;退火62℃,30 s;延伸68 ℃,30 s;设置30个循环;终延伸68 ℃,5 min。经PCR产物纯化定量后进行第2轮扩增:预变性94 ℃,2 min;变性98 ℃,10 s;退火65 ℃,30 s;延伸68 ℃,30 s;设置12个循环;终延伸68 ℃,5 min。经第2轮扩增产物纯化定量完成后上机测序。根据操作分类单元(OTU)种类数量分析菌群多样性、物种菌群组成及肠道菌群功能,本研究后续的测序和生物信息服务在广州基迪奥生物科技有限公司完成。
1.3.5 生物学分析
α多样性常使用物种丰富度与均匀度来计算,一般用来评估特定生态系统内的多样性情况。Good’s Coverage主要关心样本的低丰度OTU覆盖情况;observed_species反映样本的OTU种类;Chao1、ACE指数表示能检测到的物种丰富度;Simpson、Shannon指数可以综合表现物种的丰富度和均匀度。优势物种很大程度上决定着微生物群落的生态结构以及功能结构,本试验用堆叠图的形式,直观展示肠道菌群在属的水平上的相对丰度。PICRUSt软件首先根据已知物种基因组搭建一个“物种-基因”的关系网,然后利用OTU序列信息找到“最近物种”,并根据已知物种的基因种类和丰度信息,来对未知物种的遗传信息进行预测,从而结合基因的KEGG通路信息来预测整个群落的通路情况,最后达到功能分析的目的。使用PICRUSt软件进行KEGG Pathway的功能注释,统计Pathway和KO的丰度信息,并绘制KEGG 数据库的预测结果统计图。
1.4 统计学分析
试验数据主要采用GraphPad Prism7统计软件进行数据统计分析,所得数据以平均值±标准差的形式表示,并进行组间多重比较,其中*代表差异显著(P<0.05),**代表差异极显著(P<0.01)。
2 结 果
2.1 重组猪源罗伊氏乳酸杆菌pPG-LFCA/LR-CO21的鉴定
提取质粒,经PCR鉴定目的片段大小为341 bp,与预期结果相符(图1)。对重组菌pPG-LFCA/LR-CO21和空载菌pPG/LR-CO21进行Western blot鉴定,结果显示(图2),化学发光显色液(ECL)显色后重组菌pPG-LFCA/LR-CO21在约4.6 ku处出现特异性的反应带,而空载菌未见条带。LFCA含量与OD450 nm值的关系为y=0.932 4x+0.005 4(图3)。根据标准曲线计算重组菌表达LFCA的含量,可见培养18 h后LFCA的表达量最大,菌体的最大表达量为1.33 μg/mL,上清的最大表达量为1.03 μg/mL(表3)。这表明LFCA在重组菌中获得表达,重组猪源罗伊氏乳酸杆菌pPG-LFCA/LR-CO21构建成功。
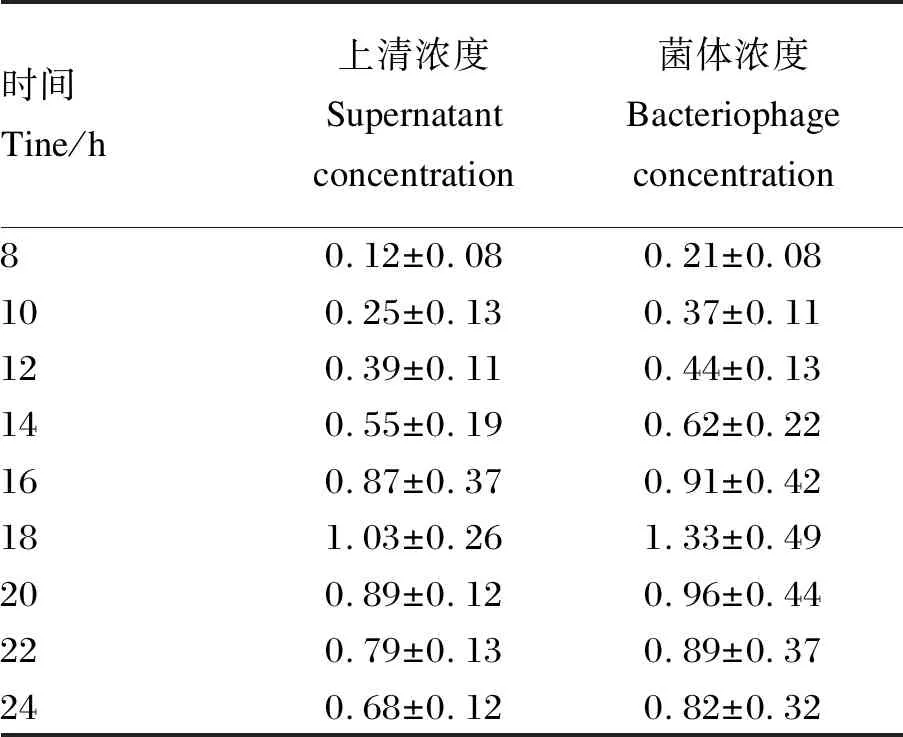
表3 重组牛乳铁蛋白肽表达条件的优化Table 3 Optimization of recombinant bovine lactoferrin peptide expression conditions μg/mL
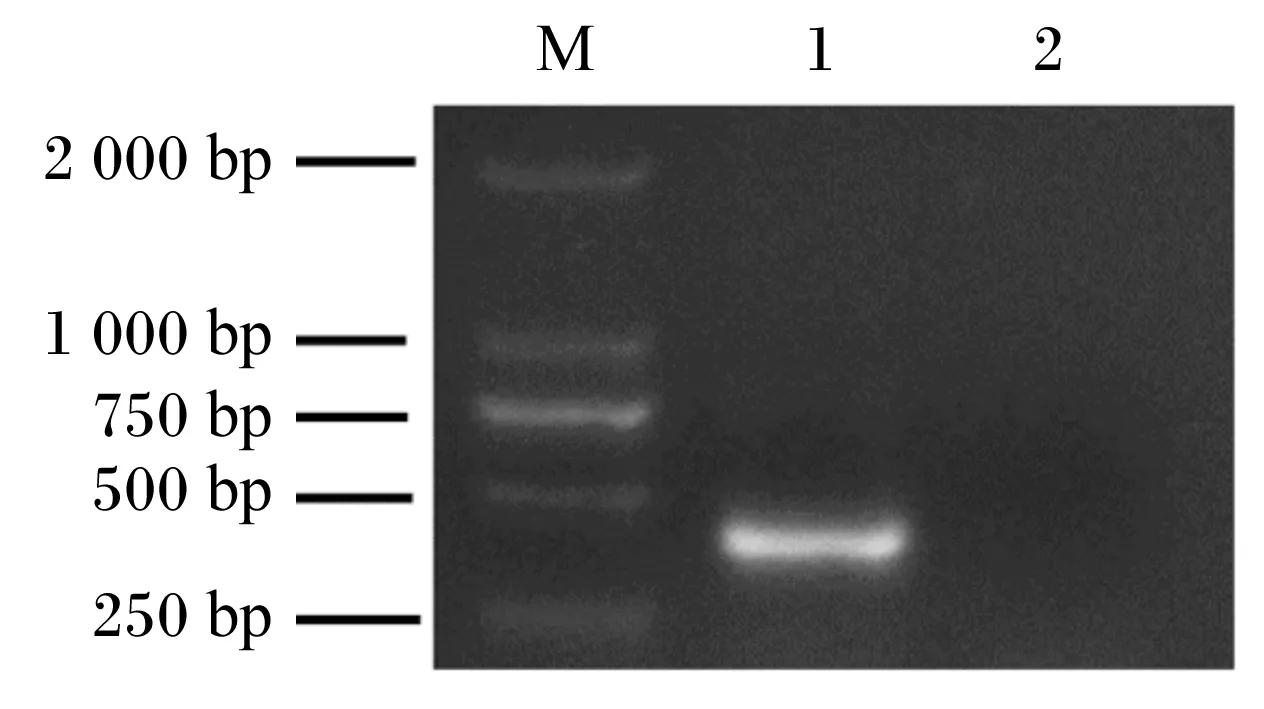
M:DNA分子量标准DL2000;1:重组质粒pPG-LFCA;2:空载质粒pPG。M: DNA Marker DL2000; 1: recombinant plasmid pPG-LFCA; 2:empty vector plasmid pPG.图1 重组质粒pPG-LFCA PCR鉴定结果Fig.1 PCR identification results of recombinant plasmid pPG-LFCA

M:小分子量蛋白标准Marker;1:重组菌pPG-LFCA /LR-CO21上清;2:重组菌pPG-LFCA /LR-CO21菌体;3:空载菌pPG /LR-CO21上清;4:空载菌pPG /LR-CO21菌体。M: low molecular weight protein Marker;1:the supernatant of recombinant bacteria pPG-LFCA LR-CO21;2:the bacteriophage of recombinant bacteria pPG-LFCA /LR-CO21;3:the supernatant of empty vector bacteria pPG/LR-CO21;4: the bacteriophage of empty vector bacteria pPG /LR-CO21.图2 重组猪源罗伊氏乳杆菌表达产物的Western blot鉴定结果Fig.2 Western blot identification results of recombinant porcine Lactobacillus reuteri expression products
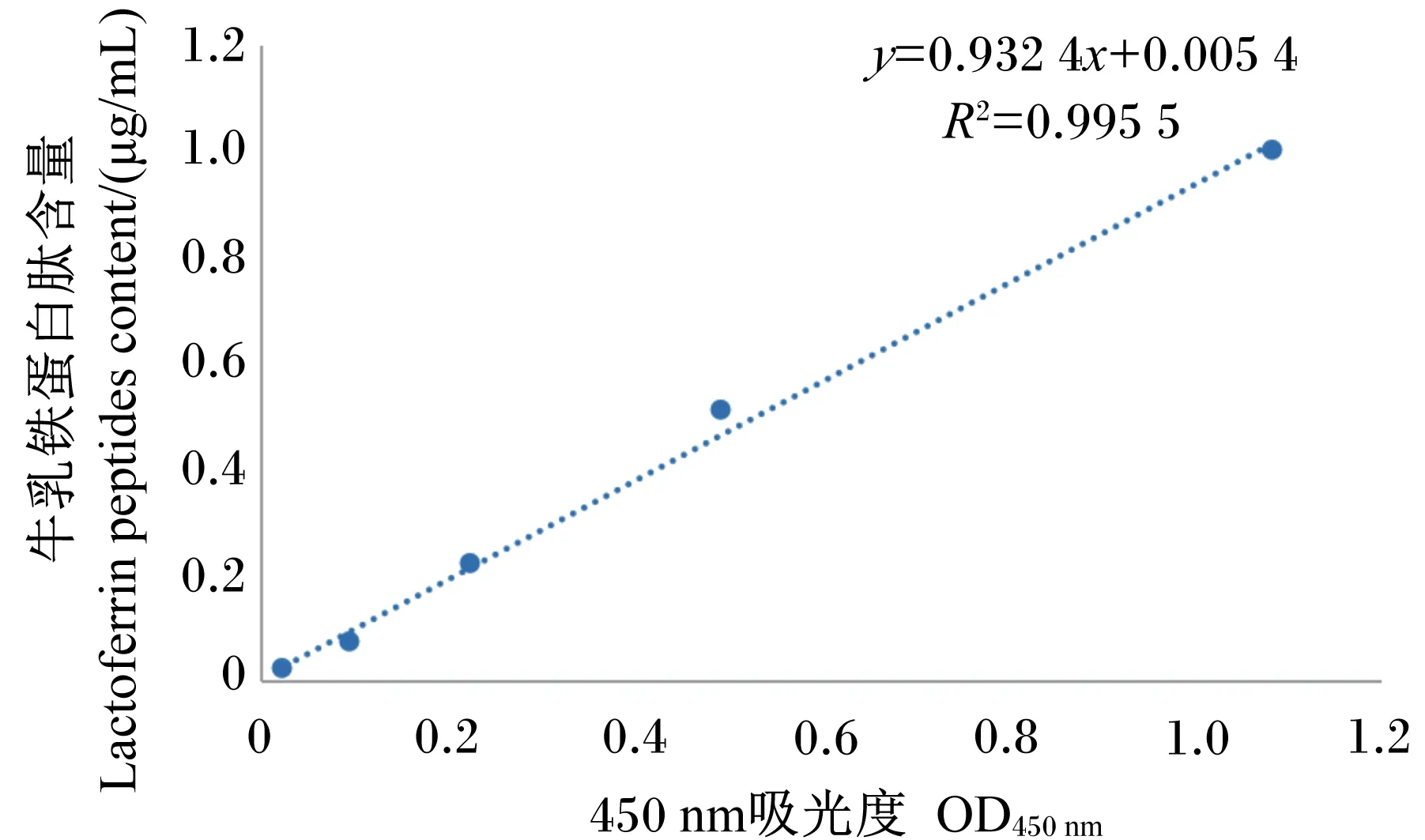
图3 牛乳铁蛋白肽的定量标准曲线Fig.3 Standard curve for quantity of bovine lactoferrin peptides
2.2 重组猪源罗伊氏乳酸杆菌对新生仔猪生长性能的影响
由图4可知,重组菌组和对照组相比提高了新生仔猪的ADG,差异极显著(P<0.01),在观测的第14天测定空载菌组与对照组相比差异极显著(P<0.01)。由此结果可见,在口服表达LFCA的pPG-LFCA/LR-CO21能够提高新生仔猪的生长性能,对新生仔猪的生长有一定的促进作用。
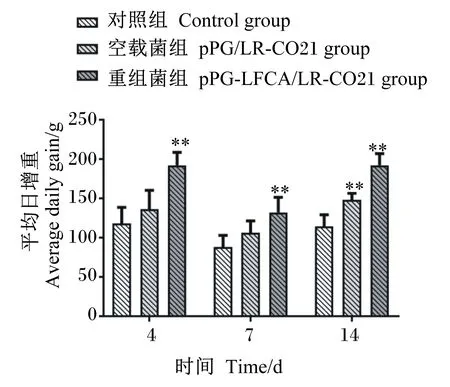
“*”表示与对照组相比差异显著(P<0.05), “**”表示与对照组相比差异极显著(P<0.01)。图5、图11同。Compared with the control group, “*”mean significant difference (P<0.05), and “**” mean extremely significant difference (P<0.01). The same as Fig.5 and Fig.11.图4 重组猪源罗伊氏乳杆菌对仔猪ADG的影响Fig.4 Effects of recombinant porcine Lactobacillus reuteri on ADG of piglets
由图5可知,重组菌组与对照组相比较,腹泻率降低且差异极显著(P<0.01),表明口服表达LFCA的重组猪罗伊氏乳杆菌,能够降低新生仔猪的腹泻率,提高新生仔猪机体的免疫力。
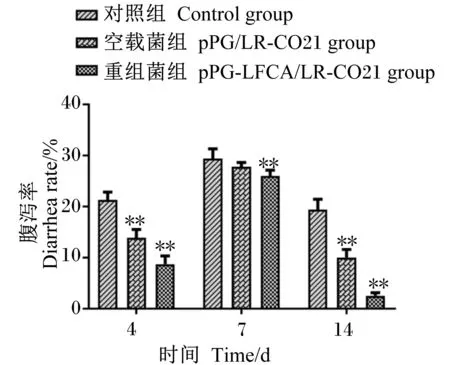
图5 重组猪源罗伊氏乳杆菌对仔猪腹泻率的影响Fig.5 Effects of recombinant porcine Lactobacillus reuteri on diarrhea rate of piglets
2.3 重组猪源罗伊氏乳酸杆菌在新生仔猪体内定植能力分析
流式细胞术检测显示,重组菌的标记阳性率为99.4%(图6),在口服后的4、7、14 d,重组猪源罗伊氏乳杆菌在仔猪各肠段均可定植,其中在空肠、回肠定植效果较好,结果见图7、表4。
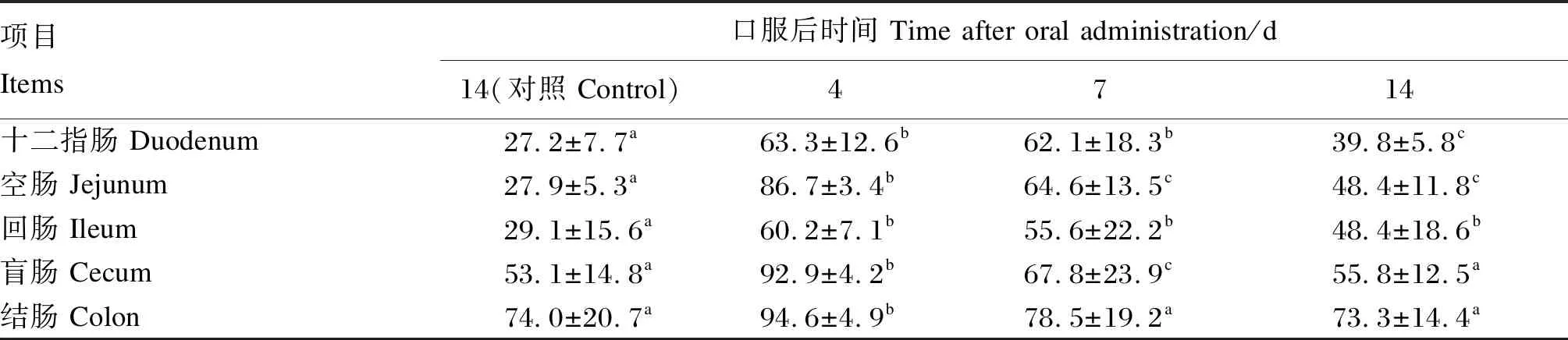
表4 重组猪源罗伊氏乳酸杆菌在仔猪肠道定植率的测定Table 4 Determination of intestinal colonization ability of recombinant porcine Lactobacillus reuteri in piglets %
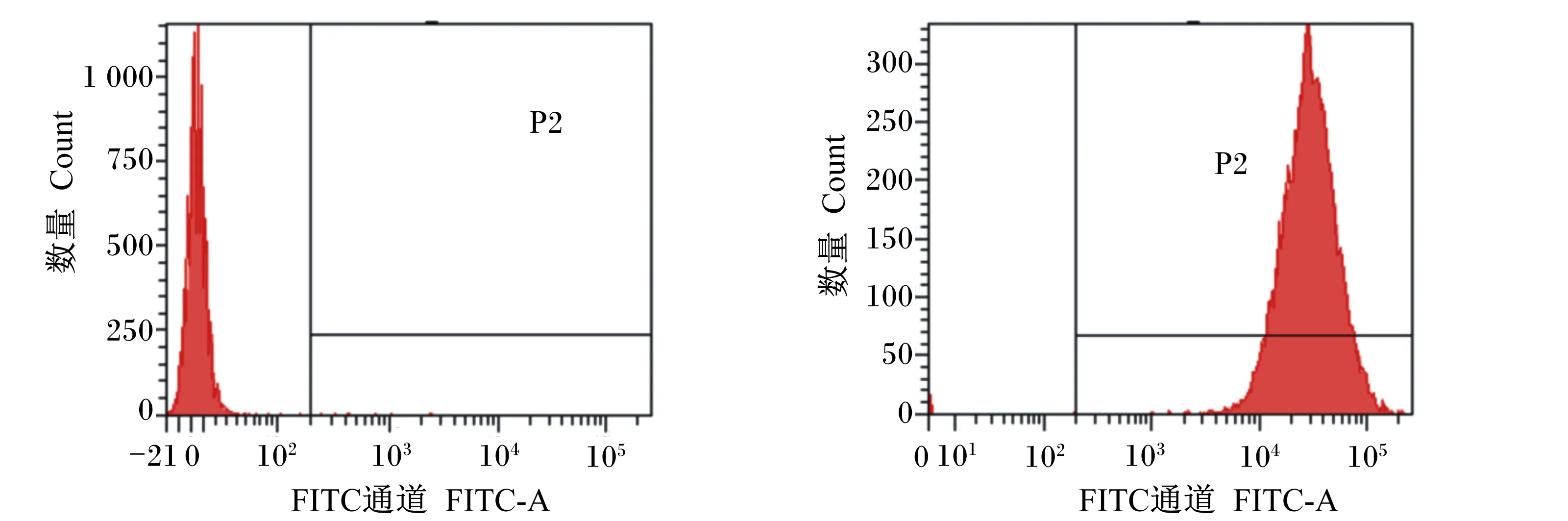
图6 重组猪源罗伊氏乳酸杆菌以CFDA-SE标记的阳性率Fig.6 Recombinant porcine Lactobacillus reuteri positive rate of CFDA-SE labeling

A:十二指肠 duodenum;B:空肠 jejunum;C:回肠 ileum;D:盲肠 cecum;E:结肠 colon。Conunt:数量;FITC-A:FITC通道 FITC passway。图7 重组猪源罗伊氏乳酸杆菌在仔猪肠道定植的检测Fig.7 Detection of intestinal colonization ability of recombinant porcine Lactobacillus reuteri in piglets
2.4 重组猪源罗伊氏乳酸杆菌对仔猪抵抗TGEV感染的效果分析
2.4.1 TGEV对于仔猪半数致死量的测定
如图8所示,结果表明达到半数致死量的条件为口服感染6 mL TCI50为10-7.50/mL的病毒液。后续试验用此感染剂量进行病毒感染试验。

图8 半数致死量感染条件Fig.8 Median lethal dose infect conditions
2.4.2 口服重组菌对感染TGEV的仔猪ADG、腹泻率的影响
TGEV感染后1~7 d,重组菌组和空载菌组较TGEV感染组ADG增加,出现体重负增长的时间点延后(图9-A);腹泻率降低,出现腹泻率最高峰的时间点延后(图9-B)。由此可见,口服表达LFCA的重组菌组较TGEV感染组可以减缓TGEV对仔猪生长性能造成的不良影响。
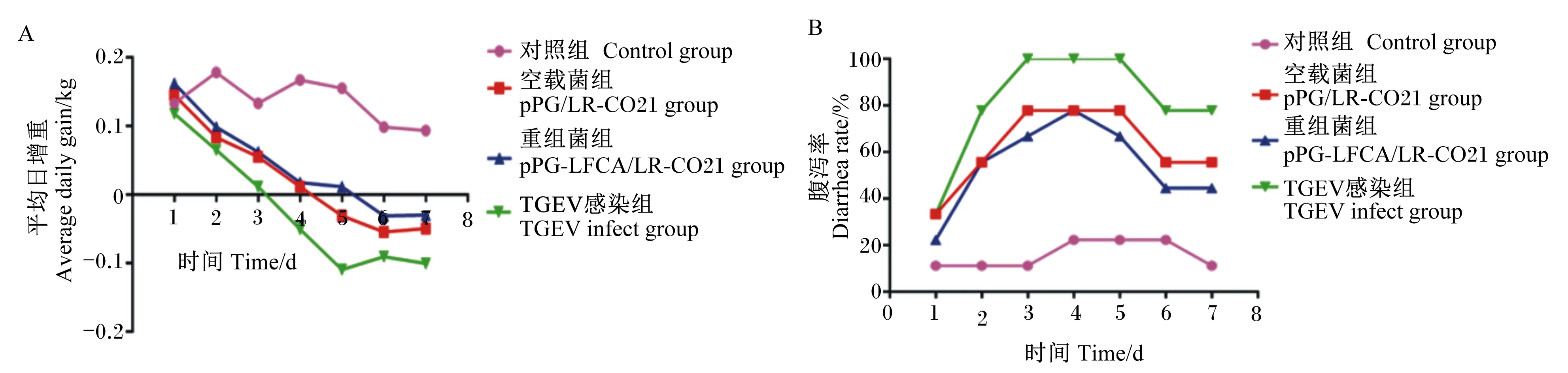
A:重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪ADG的影响;B:重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪腹泻率的影响。A: effects of recombinant porcine Lactobacillus reuteri on ADG of piglets infected with TGEV;B: effects of recombinant porcine Lactobacillus reuteri on diarrhea rate in piglets infected with TGEV.图9 口服重组菌对感染TGEV的仔猪ADG、腹泻率的影响Fig.9 Effects of oral recombinant bacteria on ADG and diarrhea rate in piglets infected with TGEV
2.4.4 重组猪源罗伊氏乳酸杆菌对感染TGEV的仔猪小肠组织形态的影响
由表5可知,重组菌组与感染TGEV组仔猪相比,显著增加了仔猪空肠和回肠绒毛高度(P<0.05),显著增加了十二指肠、空肠和回肠的绒毛高度/隐窝深度的比值(P<0.05)。TGEV感染组仔猪十二指肠黏膜绒毛高度变短,固有层可见少量嗜酸性粒细胞及嗜中性粒细胞,重组菌组炎性细胞减少;TGEV感染组空肠黏膜固有层可见大量炎性细胞浸润,膜绒毛断裂,上皮大量脱落,重组菌组相比TGEV感染组仔猪症状明显减轻;TGEV感染组回肠黏膜绒毛高度变短,固有层可见少量嗜酸性粒细胞浸润,隐窝数量较多损坏,此病变在重组菌组有所恢复。结果见图10。

图10 仔猪小肠组织病理变化Fig.10 Pathology change of piglet small intestine (100×)

表5 重组猪源罗伊氏乳酸杆菌对仔猪小肠组织形态的影响Table 5 Effects of recombinant porcine Lactobacillus reuteri on tissue morphology of small intestine in piglets
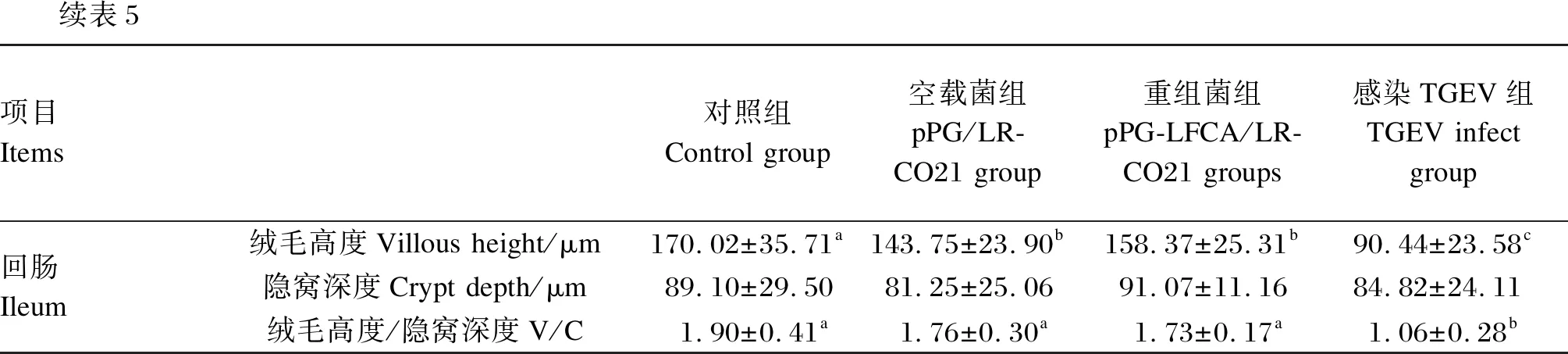
续表5项目 Items对照组Control group空载菌组pPG/LR-CO21 group重组菌组pPG-LFCA/LR-CO21 groups感染TGEV组TGEV infect group回肠 Ileum绒毛高度Villous height/μm170.02±35.71a143.75±23.90b158.37±25.31b90.44±23.58c隐窝深度Crypt depth/μm89.10±29.5081.25±25.0691.07±11.1684.82±24.11绒毛高度/隐窝深度V/C1.90±0.41a1.76±0.30a1.73±0.17a1.06±0.28b
2.4.3 重组猪源罗伊氏乳酸杆菌对感染TGEV的仔猪免疫球蛋白及炎性细胞因子、紧密连接蛋白的影响
由图11可知,在仔猪口服重组菌7 d后进行感染,从结果中可以看出,重组菌可以有效提高血清免疫球蛋白的含量,其中血清总IgG抗体含量较对照组差异显著(P<0.05),肠黏液中总sIgA抗体含量较对照组差异显著(P<0.05)。
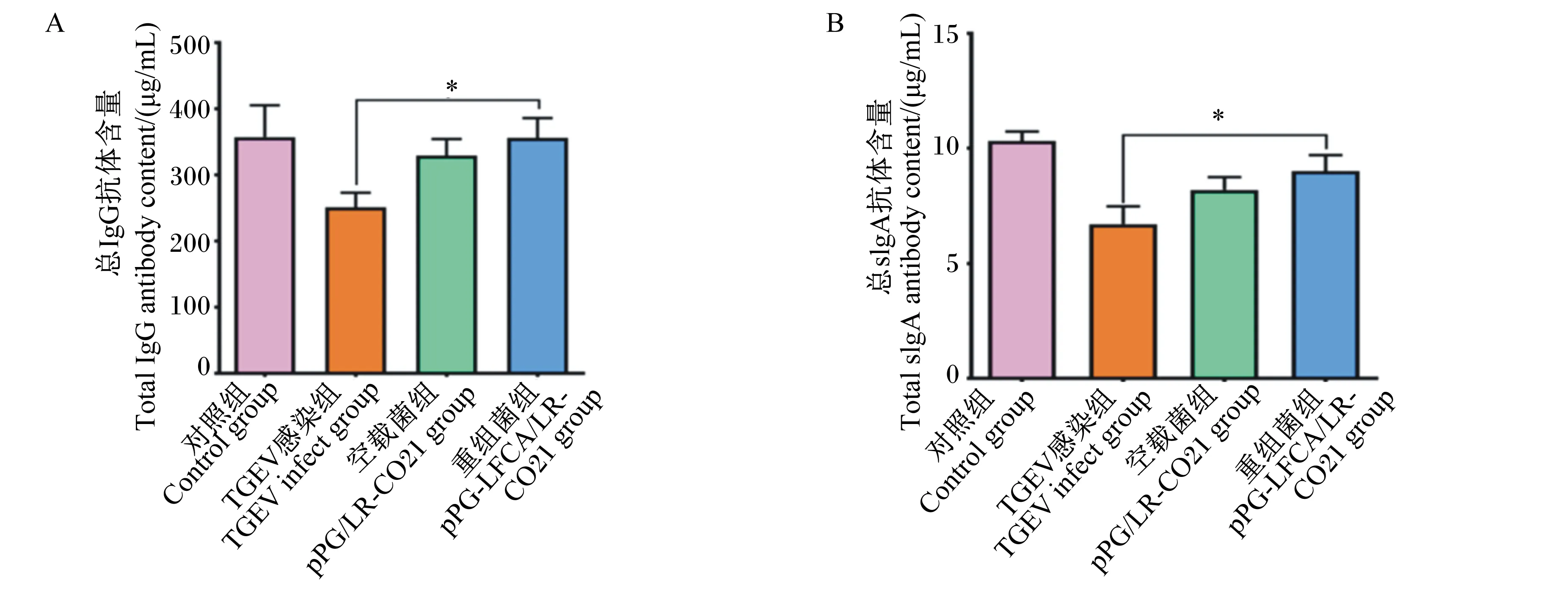
图11 重组猪源罗伊氏乳酸杆菌对感染TGEV的仔猪血清免疫球蛋白含量Fig.11 Effects of recombinant porcine Lactobacillus reuteri on serum immunoglobulin contents of piglets infected with TGEV
由图12可知,细胞紧密连接蛋白Occludin、Claudin-1、ZO-1 mRNA相对表达量与TGEV感染组比较均有增加,且差异极显著(P<0.01)。具有广谱抗病毒活性的细胞因子IFN-γ以及相关细胞因子IL-6、IL-8、TLR-2、TNF-α的mRNA相对表达量与TGEV感染组比较均有增加,且差异极显著(P<0.01)。

图12 重组猪源罗伊氏乳酸杆菌对感染TGEV的仔猪肠黏膜组织炎性细胞因子、紧密连接蛋白mRNA相对表达量的影响Fig.12 Effects of recombinant porcine Lactobacillus reuteri on mRNA relative expression levels of inflammatory cytokines and tight junction proteins in intestinal mucosa of piglets infected with TGEV
2.4.5 重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪的保护效果
在感染后的7 d,TGEV感染组的8只仔猪死亡率达62.5%,重组菌组的死亡率为37.5%,空载菌组为50%,表明pPG-LFCA/LR-CO21对感染TGEV的新生仔猪具有一定的保护作用,结果见图13。

图13 重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪的保护效果Fig.13 Protective effects of recombinant porcine Lactobacillus reuteri on piglets infected with TGEV
2.4.6 重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪的肠道微生物生态平衡的影响
使用物种丰富度与均匀度计算α多样性,结果见图14-A。TGEV感染后的3个组仔猪肠道菌群物种菌群总量及多样性较对照组均有上升,重组菌组菌群总量与TGEV感染组相差较小,而菌群多样性较TGEV感染组相比有所下降,更接近对照组,表明TGEV感染后对口服重组菌的仔猪肠道菌群平衡的破坏程度较TGEV感染组更小。
采用堆叠图的形式,从属水平上分析不同样品物种丰度的情况,结果见图14-B。仔猪肠道菌群在属水平上占比较高的为真杆菌属、拟普雷沃菌属、大肠埃希氏菌属、梭菌属。相较于对照组,在TGEV感染后,大肠埃希氏菌属、梭菌属占比下降,拟杆菌属占比上升,而重组菌组较TGEV感染组条件致病菌拟杆菌属占比下降。
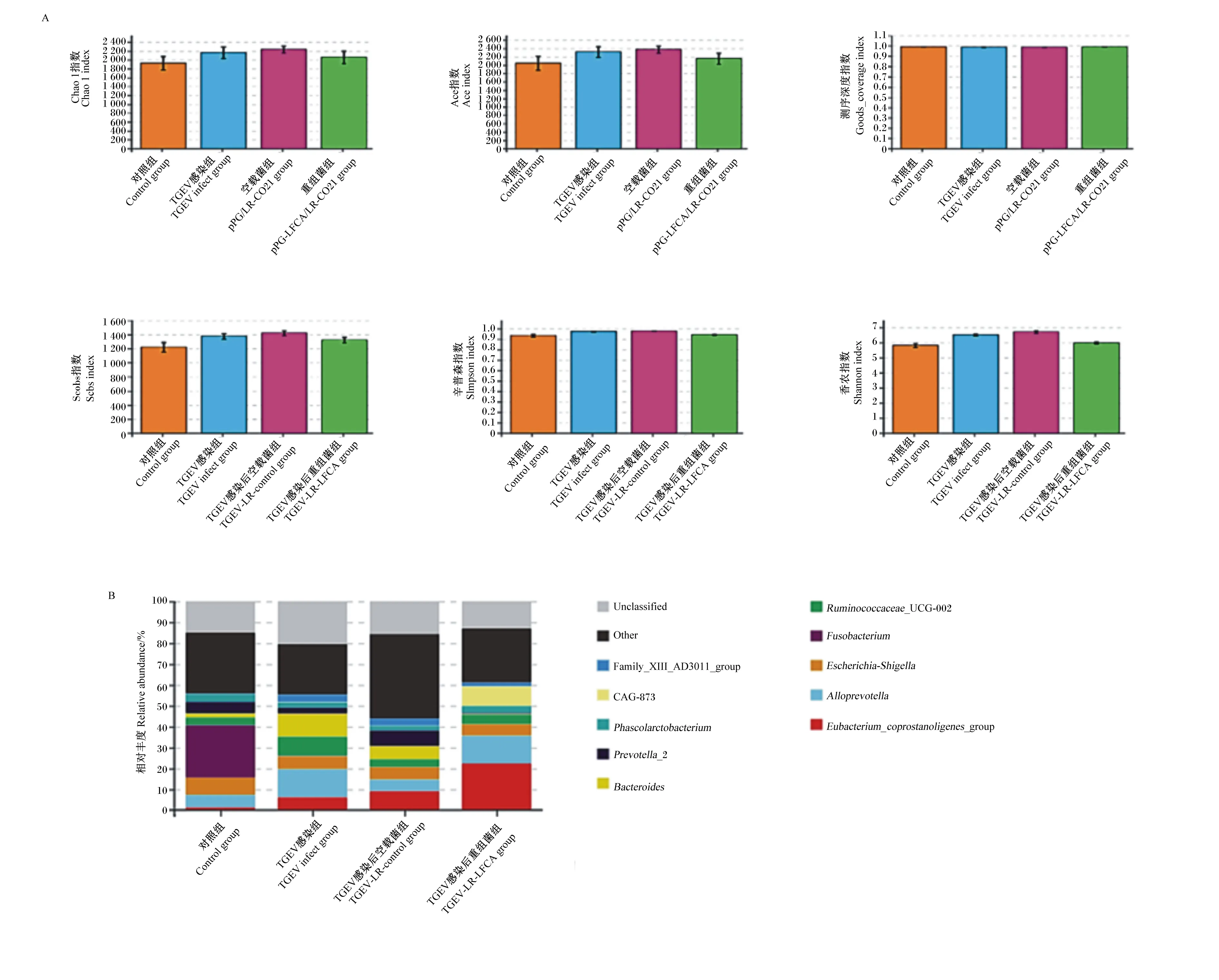
A:以各组为单位的α多样性指数图;B:肠道菌群在属水平上的相对丰度。A: Alpha diversity index figure of each group;B: the intestinal flora of relative abundance at the genus level.Unclassified:未分类菌属;Other:其他菌属;Phascolarctobacterium:考拉杆菌属;Prevotella_2:普雷沃菌属_2;Bacteroides:拟杆菌属;Ruminococcaceae_UCG-002:疣微菌科UCG-002;Fusobacterium:梭菌属;Escherichia-Shigella:大肠埃希氏菌属;Alloprevotella:拟普雷沃菌属;Eubacterium_coprostanoligenes_group:产粪甾醇真杆菌属群。图14 重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪的肠道微生物α多样性及在属的水平上的相对丰度Fig.14 Effects of recombinant porcine Lactobacillus reuteri on alpha diversity and relative abundance at the genus level of intestinal microorganisms in piglets infected with TGEV
绘制KEGG数据库的预测结果统计图(图15)。结果表明,在糖的生物合成代谢、生物降解代谢、信号分子相互作用功能上,对照组较其他3组更强。而在其他绝大多数功能上,如膜运输、碳水化合物代谢、氨基酸代谢等能力上,重组菌组相较于其他3组更强。

图15 重组猪源罗伊氏乳酸杆菌对感染TGEV仔猪的肠道菌群功能预测结果统计图Fig.15 Effects of recombinant porcine Lactobacillus reuteri on statistical diagram of intestinal flora function prediction results in piglets infected with TGEV
3 讨 论
罗伊氏乳酸杆菌在动物肠道内分布广泛,在调节肠道菌群稳态和黏膜免疫方面具有重要作用,近年来已逐步成为研究的热点[18]。已有研究表明,理想的益生菌种最好是在本动物肠道的定植菌株中分离出来的[19],因此本试验猪源罗伊氏乳酸杆菌LR-CO21从仔猪体内分离筛选,具有较强耐酸、耐胆盐以及良好定植能力[20],可以在体内长期存留。乳酸菌质粒表达系统操作简单,表达量高,相对于大肠杆菌具有更好的安全性和益生特性,因此应用乳酸杆菌作为表达不同生物学功能外源蛋白的载体[21-22]。目前,乳铁蛋白肽研究较多的2段序列为LFCA Lfcin、LFampin 2个片段[23],与其他哺乳动物所产生的乳铁蛋白肽相比活性更高[24],其所具有的螺旋结构、疏水性、两亲性和强阳离子特性是它们抗病原微生物的关键[25]。本研究利用本实验室构建的含有组成型强启动子HCE、增强子T7g10、肽聚糖水解酶信号肽以及用linker连接的依据乳酸杆菌密码子偏嗜性优化的2段LFCA (LFcinB和LFampin)与大肠杆菌强终止子rrnB T1T2串联的表达盒重组质粒pPG-LFCA,将其电转化到猪源乳酸杆菌LR-CO21中,构建表达LFCA的重组猪源罗伊氏乳杆菌pPG-LFCA/LR-CO21,研究其抗菌、抗病毒活性及其对仔猪生长的影响。由于本试验使用的表达载体是组成型表达载体,因此目的蛋白的表达无需额外添加诱导剂[26],能够解决规模化生产的难题。
试验期间仔猪于饲养室隔离饲养,重组菌构建以及饲喂过程均严格按照实验室规范进行操作,仔猪产生的粪尿及剖杀后仔猪均用3%消毒液喷洒后装入塑料袋,送到指定焚烧地点焚烧处理。通过流式细胞术对重组猪源罗伊氏乳酸杆菌在新生仔猪体内定植能力分析,结果表明,在口服后第3天定植效果足够好,14 d后检测重组菌仍能在各肠段定植,另外,用TGEV病毒对早期重组菌定植后仔猪感染时试验效果会更加明显。将饲喂重组猪源罗伊氏乳酸杆菌的仔猪感染TGEV TH98毒株,由于肠道黏膜组织结构的完整性是营养物质消化吸收和机体健康生长的保证,并且小肠在防御病原体入侵方面也起着关键作用[27],因此通过检测肠道形态、绒毛高度、隐窝深度以及绒毛高度/隐窝深度的比值等指标来评价肠道的生长发育状况[28],绒毛高度/隐窝深度的比值越高,表明肠道发育情况越好。重组菌组与TGEV感染组相比,显著增加了仔猪十二指肠、空肠和回肠的绒毛高度/隐窝深度的比值,且重组菌组回肠的绒毛高度/隐窝深度的比值接近正常组,表明口服重组菌可减轻TGEV感染仔猪的空肠和回肠的肠绒毛断裂,能够增强小肠的吸收能力,并可对肠道环境起到一定的保护作用。肠道屏障是机体抵御病原微生物入侵的第1道防线[29],多种蛋白相互作用而形成紧密连接蛋白的复合结构[30],其组成成分包括支架蛋白(如ZO-1)和跨膜蛋白(如Occludin、Claudin-1)具有选择通透作用,可以阻止消化道内细菌、毒素等物质的胞旁转运[31]。Yi等[32]的研究结果表明,罗伊氏乳杆菌可以增加Occludin及ZO-1的表达量,对肠道上皮屏障功能具有益生作用,可以修复肠道疾病导致的上皮屏障功能受损。本试验结果发现,重组菌组较TGEV感染组极显著上调紧密连接蛋白Claudin-1、Occludin及ZO-1在小肠组织中mRNA的相对表达量,表明重组猪源罗伊氏乳酸杆菌可以促进肠道组织中紧密连接蛋白的表达,增强仔猪肠道屏障作用。细胞因子是指主要由免疫活性细胞合成和分泌的一类具有生物学活性的蛋白质多肽分子,具有介导和调节免疫应答的功能。IFN-γ因其广谱的抗病毒及抗肿瘤的作用,目前已成为免疫检测中重要指标[33]。细胞因子白细胞介素由活化的单核巨噬细胞及淋巴细胞等产生,主要调节T、B淋巴细胞的增殖与分化,并在抗病毒免疫中负责信号传递,进而机体免疫系统被激活,诱导肝细胞合成TNF-α、IL-6和IL-8[34]等细胞因子,参与炎症反应。LFCA可以一定程度上抑制炎性细胞因子,但本试验测定的是炎症早期反应引起的细胞因子转录水平变化。Xia等[35]的研究表明,TGEV感染仔猪后,多种肠道炎性因子mRNA相对表达量升高,在病毒刺激机体产生免疫的早期,炎性细胞因子水平升高可以起到相应的抗病毒效果。在本试验中重组菌组对比于TGEV感染组肠道组织中TLR2 mRNA相对表达量上调,且差异极显著;进一步激活IFN-γ,使其表达量上调,且与TGEV感染组相比差异极显著。TLR2的mRNA相对表达量上调,同样激活IL-6、IL-8、TNF-α转录水平上调;这些细胞因子有助于诱导T、B细胞的分化增殖,参与炎症反应,机体通过炎症反应能够减缓或阻止病原体经组织间隙向机体的其他部位扩散,为吞噬细胞发挥功能提供条件,从而达到抗病毒的效果。本研究通过直接口服重组菌,用酶联免疫吸附试验试剂盒检测受到病毒感染后仔猪血清中总IgG和肠黏液总sIgA抗体含量。结果表明,重组菌组2种抗体含量上调,且较TGEV感染组差异显著,说明重组菌可以增强机体体液和黏膜免疫的免疫能力。动物肠道菌群失衡会导致肠道屏障功能破坏,消化功能紊乱和免疫功能异常[36]。随着基因测序技术的发展,肠道微生物已被视为一种多基因性状[37],不仅能使机体产生对病原体的屏障,在宿主的代谢、免疫和生理等方面也具有多重功能。对TGEV感染后的仔猪肠道内菌群结构进行分析,可见TGEV感染后引起的肠道菌群失衡可能是导致重组菌组、空载菌组和TGEV感染组肠道菌群物种菌群总量及多样性比对照组高的原因。根据数据库的物种注释和OTU丰度信息,使用PICRUSt软件进行KEGG Pathway的功能注释,表明新生仔猪在口服重组菌后能促进营养物质吸收及提高免疫力,从而抵御TGEV的感染。梁秀丽等[38]的研究同样表明,抗菌肽B-13可以调节感染TGEV仔猪盲肠微生物菌群的多样性和丰富度,并在TGEV感染的情况下起到降低腹泻率、调控盲肠微生物健康区系和改善肠道形态发育的作用。重组菌对TGEV感染仔猪存活率的影响结果表明,空载菌本身也对TGEV有一定的抑制作用,但其作用效果没有重组菌明显,主要原因在于罗伊氏乳酸杆菌本身能够提升机体非特异性免疫。
4 结 论
本试验构建了表达LFCA的重组猪源罗伊氏乳酸杆菌pPG-LFCA/LR-CO21,该重组菌能够促进新生仔猪生长,增强抵抗力,在仔猪肠道内具有良好的定植能力并可以降低TGEV对仔猪肠道的损伤,对仔猪抗TGEV感染提供有效保护。TGEV感染仔猪后,仔猪肠道菌群的结构和数量都发生显著变化,仔猪肠道正常菌群占比下降;口服重组菌的仔猪肠道菌群较TGEV感染组条件致病菌拟杆菌属占比下降,菌群多样性更接近对照组,肠道菌群的代谢、遗传信息处理等功能均有所增强。

