细菌群体感应的抑制及其对肠道健康的调控
王海亮 张文举 牛俊丽 聂存喜
(石河子大学动物科技学院,石河子 832000)
现代畜禽养殖中抗生素的不合理使用,导致了病原菌耐药性、畜产品药物残留、畜禽机体免疫力低下与双重感染和环境污染等诸多问题[1]。目前,我国饲料中全面禁止添加抗生素,因而抗生素的替代越来越受到广大研究者的关注,其中通过细菌群体感应(quorum sensing,QS)实现肠道健康来替代抗生素是一种新的方法。QS是细菌用来调节集体行为的细胞间交流过程,它依赖于细菌群体密度而调控其生理行为[2]。细菌在生长过程中会分泌化学信号分子,伴随细菌的分裂生长和群体密度的增加,胞外信号分子浓度也随之增加,细菌会通过胞外信号分子的浓度而感知其群体密度。当胞外信号分子浓度达到某一阈值时,细菌会启动一系列基因的表达,从而调节细菌群体行为,致使宿主产生正面或负面应答。肠道作为宿主微生物的聚集地和营养素的主要吸收器官,它的生理状态直接影响宿主健康。QS可通过微生物的信息交流调控肠道屏障功能与营养素代谢,进而维持机体对营养素的吸收和肠道健康[3]。因此,研究QS及群体感应抑制剂(quorum sensing inhibitor,QSI)和QS介导肠道菌群促进机体健康发生机制对于动物健康养殖具有重要意义。
1 QS系统
科学家们研究费氏弧菌(Vibriofischeri)的发光机理时发现其释放信息交流信号,此信号分子调控自身发光,是一种依赖于菌群密度系统而发生的生理行为,即QS系统。QS不仅能够调节细菌生物发光,还可以调节细菌色素合成、生物膜形成、致病性、抗生素的分泌[4-5]。同时,QS在调节细菌共生、细菌素的产生、遗传能力、细胞的程序性死亡等方面也具有重要作用[6-8]。多种信号分子介导细菌之间的信息交流,根据信号分子的种类和感应信号分子的作用机制将细菌QS系统分为以下几类:1)由N-酰基高丝氨酸内酯(N-acyl-L-homoserine lactones,AHLs)介导的自体诱导物分子1型(auto-inducer-1,AI-1)QS系统,是革兰氏阴性菌中常见的QS系统;2)由寡肽(autoinducing peptides,AIPs)介导的QS系统,是革兰氏阳性菌中常见的QS系统;3)由呋喃硼酸二酯类介导的自体诱导物分子2型(autoinducer-2,AI-2)QS系统,是细菌种间(内)信息交流的QS系统;4)除了以上3种主要的细菌QS系统外,还有自动诱导型信号分子,扩散信号因子等介导的QS系统。
1.1 以AHLs为代表的革兰氏阴性细菌QS系统
研究表明,革兰氏阴性细菌QS系统的信号分子主要为酰基高丝氨酸内酯类[9]。AHLs常作为自体诱导物介导革兰氏阴性细菌AI-1型QS的发生,此系统的发生过程为LuxI酶合成AHL,后者可以通过细胞膜自由扩散;在达到阈值浓度时,AHLs与其受体LuxR结合;该受体的二聚作用使LuxR能够在Lux盒上作为一个转录因子,进而触发参与细菌毒力的靶基因和AHLs系统LuxI/LuxR的表达(图1)。
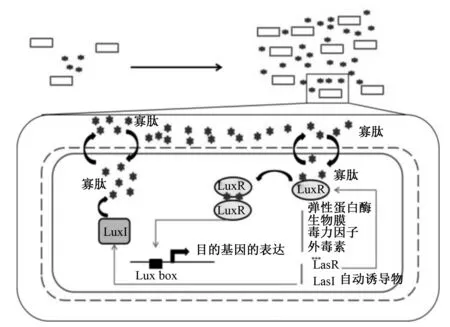
图1 革兰氏阴性细菌中群体感应发生机制Fig.1 Mechanism of quorum sensing in Gram negative bacteria[10]
1.2 以AIPs为代表的革兰氏阳性细菌QS系统
AIPs是革兰氏阳性细菌QS系统信息交流的主要信号分子,这些寡肽类分子不能自由透过细菌的细胞壁,需要一种通道蛋白或者一种名为ABC(ATP-binding-cassette)的转运系统帮助,此系统可以把AIPs转运出细胞从而发挥作用[11]。革兰氏阳性细菌QS发生信号转导系统感应AIPs信号由自动诱导肽由AIPs合成酶产生,其中单组分信号转导系统通过转运体释放到细胞外基质中进行AIPs修饰,被修饰后的AIPs转运回细胞质与受体结合发挥QS调控作用。然而,双组分信号转导系统转运体对产生的自动诱导肽进行翻译和修饰后将其释放到细胞外基质中,通过跨膜受体对其识别后,触发QS相关应答调节子基因的转录,从而发挥调控功能(图2)。
1.3 以AI-2为代表的细菌种间(内)QS系统
AI-2是革兰氏阳性细菌和阴性细菌共用的QS信号分子,AI-2型QS系统是由呋喃硼酸二酯类信号分子介导,几百种细菌都存在此系统[13]。由于AI-2型QS系统可以介导细菌在种间进行信息交流,因此,可以把它称为细菌之间的“共用语言系统”。在AI-2型QS系统中,进行调控的关键基因是LuxS,它参与了AI-2信号分子的合成。AI-2的合成取决于LuxS编码的合成酶,是一种将核糖基高半胱氨酸转化为高半胱氨酸和4,5-二羟基-2,3-戊二酮的代谢酶,对于没有AI-2合成蛋白或受体蛋白的细菌,AI-2用于种内/种间通讯,包括参与信号转导和调控其他微生物的下游基因表达(图3)。
2 QS淬灭机制以及抑制剂
有害菌QS活动可给宿主动物带来不利影响,目前主要利用QSI进行淬灭以阻断QS发生来消除其带来的不利影响。QSI主要包括植物来源和微生物来源。
2.1 QSI淬灭机制
QSI主要通过以下4个方面来阻断QS发生:1)抑制有害菌QS系统中信号分子的合成;2)降解已合成的QS信号分子,使信号分子的浓度达不到调控阈值;3)干扰QS信号分子与对应受体蛋白结合;4)抑制参与信号转导的小分子,阻断QS的完整性。
2.2 QSI的种类及其作用效果
目前,对QS有抑制作用的分子有如下几类,详情请见表1。

表1 QSI的种类、作用途径及效果Table 1 Types, action pathways and effects of quorum sensing inhibitors
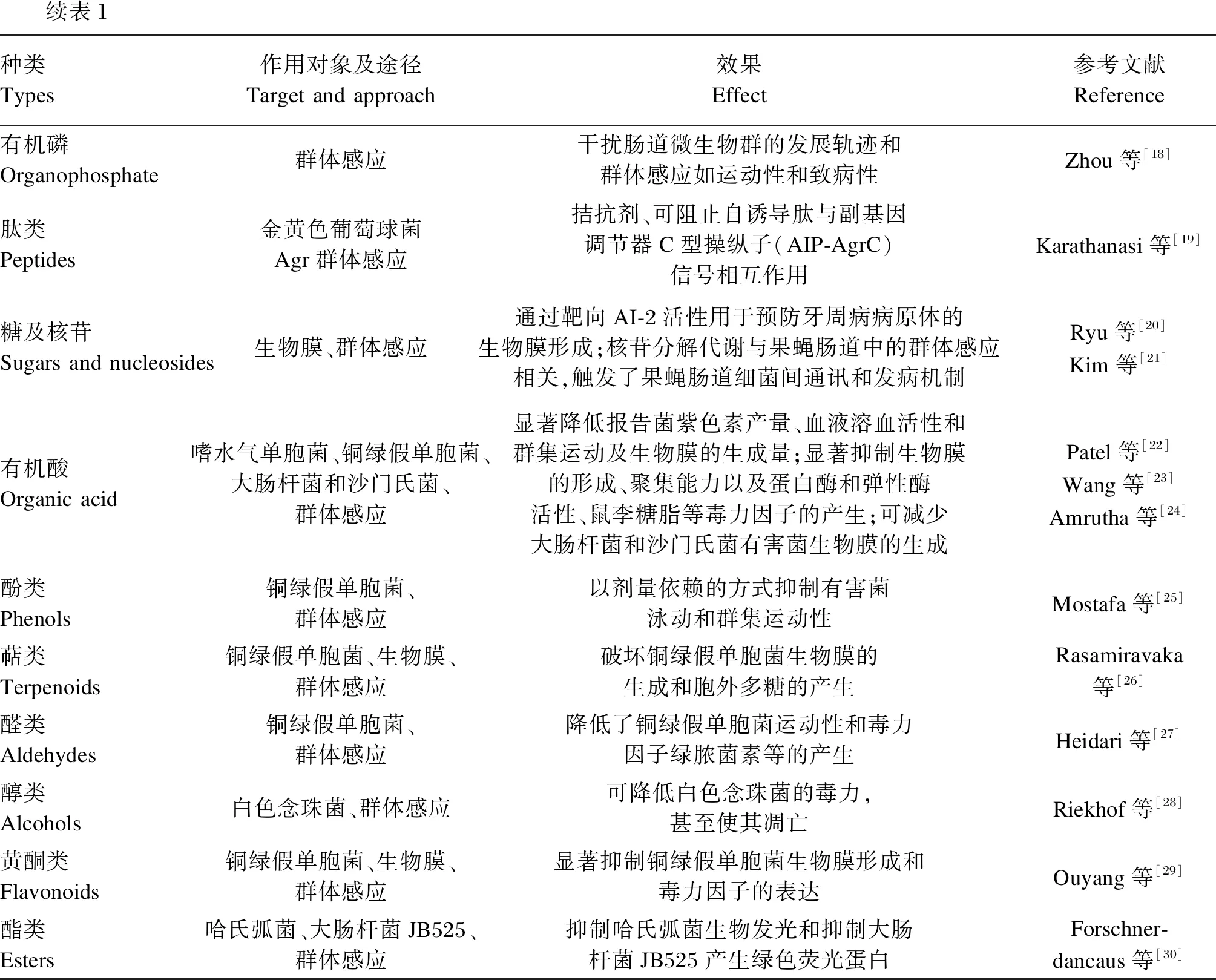
续表1种类Types作用对象及途径Target and approach效果Effect参考文献Reference有机磷Organophosphate群体感应干扰肠道微生物群的发展轨迹和群体感应如运动性和致病性Zhou等[18]肽类Peptides金黄色葡萄球菌Agr群体感应拮抗剂、可阻止自诱导肽与副基因调节器C型操纵子(AIP-AgrC)信号相互作用Karathanasi等[19]糖及核苷Sugars and nucleosides生物膜、群体感应通过靶向AI-2活性用于预防牙周病病原体的生物膜形成;核苷分解代谢与果蝇肠道中的群体感应相关,触发了果蝇肠道细菌间通讯和发病机制Ryu等[20]Kim等[21]有机酸Organic acid嗜水气单胞菌、铜绿假单胞菌、大肠杆菌和沙门氏菌、群体感应显著降低报告菌紫色素产量、血液溶血活性和群集运动及生物膜的生成量;显著抑制生物膜的形成、聚集能力以及蛋白酶和弹性酶活性、鼠李糖脂等毒力因子的产生;可减少大肠杆菌和沙门氏菌有害菌生物膜的生成Patel等[22]Wang等[23]Amrutha等[24]酚类Phenols铜绿假单胞菌、群体感应以剂量依赖的方式抑制有害菌泳动和群集运动性Mostafa等[25]萜类Terpenoids铜绿假单胞菌、生物膜、群体感应破坏铜绿假单胞菌生物膜的生成和胞外多糖的产生Rasamiravaka等[26]醛类Aldehydes铜绿假单胞菌、群体感应降低了铜绿假单胞菌运动性和毒力因子绿脓菌素等的产生Heidari等[27]醇类Alcohols白色念珠菌、群体感应可降低白色念珠菌的毒力,甚至使其凋亡Riekhof等[28]黄酮类Flavonoids铜绿假单胞菌、生物膜、群体感应显著抑制铜绿假单胞菌生物膜形成和毒力因子的表达Ouyang等[29]酯类Esters哈氏弧菌、大肠杆菌JB525、群体感应抑制哈氏弧菌生物发光和抑制大肠杆菌JB525产生绿色荧光蛋白Forschner-dancaus等[30]
2.2.1 植物来源QSI
有研究报道,从17种中草药中筛选得到了蒲公英、连翘、独活、杜仲、板蓝根、白癣皮、白芷、马齿苋8种有效QSI,13种中草药粗提取物明显抑制铜绿假单胞菌的浮游迁移活动[31]。赵弘毅[32]研究表明,丁香、赤芍等中草药粗提取物具有良好的抑菌效果,部分中草药如何首乌、八角茴香、菊花等可通过干预信号分子与受体蛋白的结合来实现对细菌QS调控。冬凌草片中冬凌草甲素对铜绿假单胞菌毒力因子的产生有类似效果[33],决明子提取产物对铜绿假单胞菌PAO1的毒力因子和生物膜也有显著的抑制作用[34]。
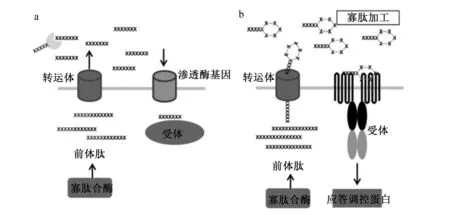
a:单组分QS系统one-component QS system;b: 2组分QS系统 two-component QS system; SAH: Pfs:DPD:AI-2:自体诱导物分子2型autoinducer-2。图2 革兰氏阳性细菌中群体感应发生机制Fig.2 Mechanism of quorum sensing in Gram positive bacteria[12]

a:有无LuxS的AI-2合成路线 AI-2 synthetic routes with or without LuxS;b:AI-2的种内/种间通讯 AI-2 intraspecific/interspecific communication; IM: 内膜intima; OM:外膜 outer membrane;SAH:S-腺苷高半胱氨酸 S-adeno-sylhomocysteine;Pfs:S-腺苷同型半胱氨酸核苷酶 S-adenosylhomocysteine nucleosidase;SRH:S-核糖高半胱氨酸 S-ribosylhomocysteine;DPD:4,5-二羟基2,3-戊二酮 4,5-di-hydroxy 2,3-pentanedione;AI-2:自体诱导物分子2型 autoinducer-2。图3 细菌中的AI-2合成和感知Fig.3 AI-2 synthesis and perception in bacteria[14]
除中草药外,植物精油和植物提取物也具有抑制QS的作用。植物精油中的化合物香芹酚能显著抑制荧光假单胞菌的生物膜形成[35],绿薄荷精油和阿魏精油可作为与食品有关微生物和QSI[36-37]。在植物提取物方面,牡丹花中的酚类成分对金黄色葡萄球菌和大肠杆菌的生物膜抑制率达到87.03%和77.93%[38];大蒜提取物对紫色杆菌CVO26(ChromobacteriumviolaceumCVO26)QS有一定的抑制作用[39];芒果提取物和番石榴中的黄酮可抑制铜绿假单胞菌PAO1的毒力因子表达和生物膜形成[40-41];连翘提取物和花椒提取物分别抑制铜绿假单胞菌和嗜水气单胞菌QS发生[42-43]。此外,花椒提取物可通过降低嗜水气单胞菌AHLs的分泌,有效抑制其生物膜的形成和胞外蛋白酶活性。Lee等[44]研究发现,西兰花提取物对大肠杆菌O157∶H7 QS和体内毒力有抑制作用。金银花中的重要成分之一绿原酸可在不影响荧光假单胞菌正常生长的情况下,明显抑制胞外蛋白酶、胞外脂肪酶活性、群集与泳动等相关腐败特性[45]。洋葱皮中的乙酸乙酯馏分(ONE),能显著抑制由QS介导毒力因子的产生,如紫色杆菌素、弹性蛋白酶[46]。余甘子多糖具有抑菌活性及QSI活性,当其终浓度为20 mg/mL时对紫色杆菌素生成量的抑制作用最大[47]。郭勋[48]研究证实,穿心莲中主要的活性成分穿心莲内酯能显著降低引起鸡败血症、气囊炎、输卵管炎的致病性大肠杆菌-O78中AI-2的分泌。从牛至、百里香等植物中提取的百里香酚能介导QS来调控动物肠道菌群[49]。由上述可见,植物相关来源的物质在QS发生上有较好的作用效果和应用前景。
2.2.2 微生物来源QSI
益生菌在畜禽胃肠道中可抢占某些细菌和真菌的生存空间和资源,竞争性抑制QS活性和生物膜的形成。如林洋等[50]从发酵酸豆角中分离得到了能抑制嗜水气单胞菌群体感应和生物膜形成的植物乳杆菌AJS2-4。嗜酸菌La-5可分泌一种QS信号抑制分子,直接与细菌转录调控因子相互作用,控制参与定植的肠出血性大肠杆菌(enterohemorrhagicEscherichiacoli,EHEC)O157∶H7毒力基因的转录[51]。Kim等[52]在断奶仔猪的研究中,发现嗜酸乳杆菌30SC细胞提取物可显著抑制EHECO157∶H7中AI-2活性。此外,乳杆菌也能够通过抑制QS活性抑制有害菌生物膜的形成。Melian等[53]研究发现,乳杆菌素AL705能通过QS机制抑制李斯特菌生物膜的形成。枯草芽孢杆菌分泌的枯草杆菌素能有效抑制大肠杆菌、李斯特菌生物膜的形成[54],芽孢杆菌分泌的芽孢杆菌脂肽可以通过抑制金黄色葡萄球菌QS来消除其在人体内定植[55]。枯草芽孢杆菌作为一种畜禽常用益生菌,在与嗜水气单胞菌共培养表明,其可以显著减少嗜水气单胞菌毒力因子的分泌[56]。因此,益生素介导QS对于维持动物肠道健康具有重要作用。
3 QS介导的肠道健康
肠道中存在着大量且复杂的微生物,这些微生物菌群对宿主养分消化、吸收、能量供应和维持正常生理和免疫功能等具有重要意义。
3.1 QS与肠道交流机制
在肠道上百万个微生物中,细菌的占比超过了99%[57],肠道中的微生物被形象的称作动物体内移动的器官,也可作为一种生物屏障保护肠道健康[58]。在哺乳动物肠道中,通过抗生素处理可改变肠道微生物组成,进而引起AI-2水平变化,细菌感应AI-2产生白细胞介素-8(IL-8)、肾上腺素和去甲肾上腺素和AI-2模拟物来影响生物膜的形成(图4)。
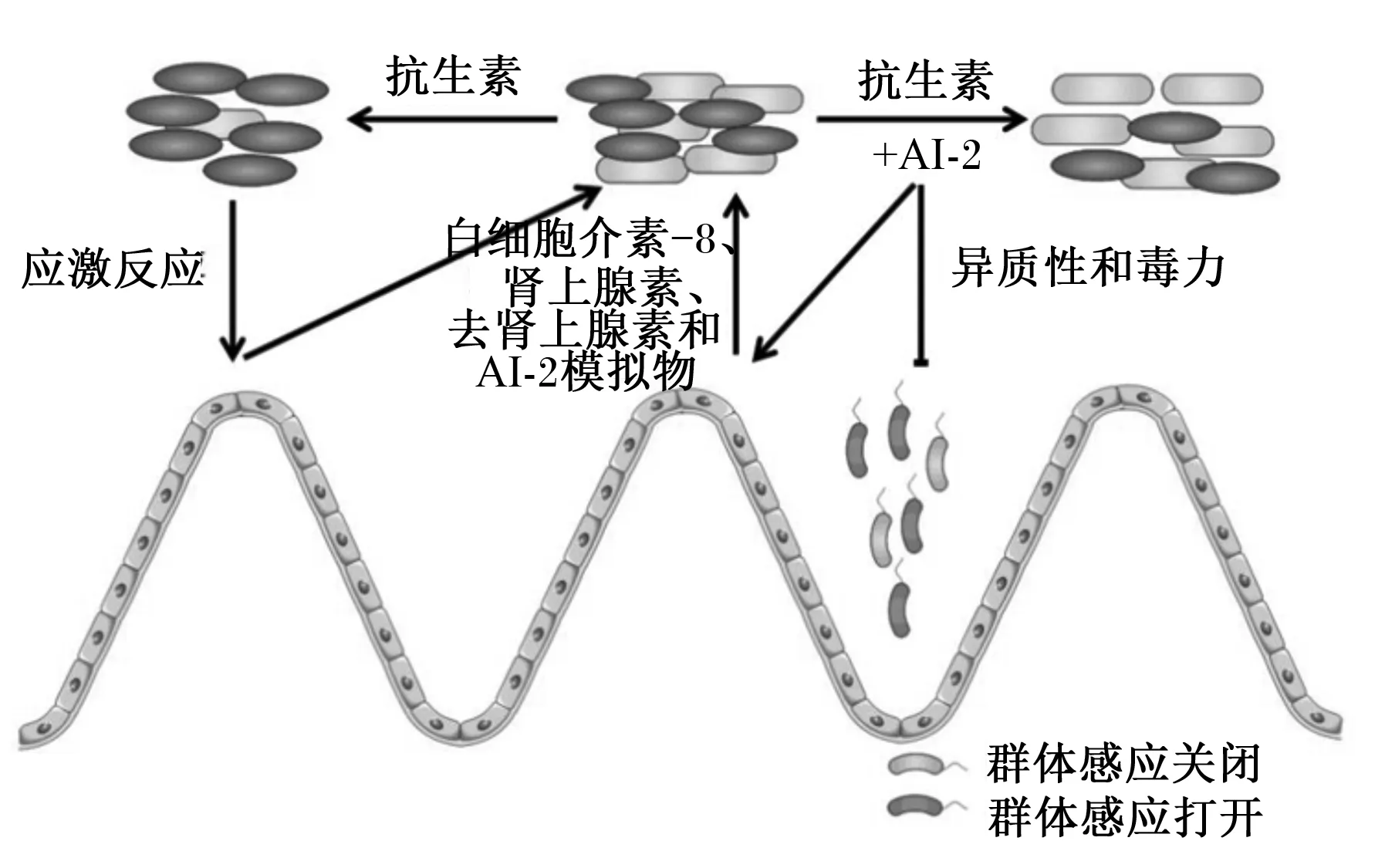
图4 哺乳动物肠道中AI-2介导的群体感应Fig.4 AI-2-mediated quorum sensing in mammalian gut[59]
3.2 QS介导的肠道健康
QS可作为桥梁来介导肠道、营养素和一些代谢物促进肠道健康,如QS介导的葡聚糖、果聚糖、甘露糖、葡萄糖、木糖、果胶、淀粉、母乳和多酚的低聚物等益生元在促进胃肠道健康方面起到了积极作用[60]。研究表明,0.1%和0.5%的葡萄糖显著下调QS中LuxS系统影响的大肠杆菌O157∶H7的毒力基因Lee的表达量[61],浓度超过0.05%的葡萄糖显著抑制嗜水气单胞菌QS活性、生物膜形成、蛋白酶产生以及群集和泳动[62]。肠道微生物在宿主屏障功能、氨基酸等养分代谢方面具有重要作用[63]。有研究表明,QS信号分子(3OC12-HSL)可通过肠道屏障功能和氨基酸代谢影响低出生体重仔猪健康[3]。在以仔猪小肠上皮细胞IPEC-J2为模型的研究中发现,不同来源QS信号分子刺激对宿主细胞相关基因表达产生显著影响[64]。有研究报道,赖氨酸、色氨酸显示出抗QS和显著的抗生物膜活性[65-66],限制碳源会抑制QS系统的激活[67]。乳酸盐和丙酮酸盐可增强小鼠机体免疫反应,对肠道沙门氏菌感染具有抵抗性[68];丁酸盐可减少沙门氏菌等有害菌的定植和引起的腹泻[69]。乳酸对铜绿假单胞菌QS信号分子、弹性蛋白酶、蛋白酶、吡氰素的产生和生物膜的形成具有抑制作用[70],醋酸盐可通过QS激活乳酸菌对细菌素的合成[71]。
一种来源于藏灵菇发酵奶的马克斯克鲁维酵母菌代谢产物乙酸色醇,可阻断革兰氏阴性菌的QS,干扰肠道霍乱弧菌的CAI-1 QS级联,进而显著改变其生物膜的形成和形态,降低细菌毒力[72]。Kim等[73]利用大肠杆菌和沙门氏菌成功证实,小鼠肠道内微生物菌群种内和种间基于QS的信号传递,表明细菌QS与肠道健康有密不可分的关系。在抗生素治疗引起的小鼠肠道微生物群失衡的情况下,大肠杆菌会增加肠道AI-2水平,进而影响微生物菌群的组成改变,改善机体肠道健康[74]。铜绿假单胞菌QS转录因子MvfR(PqsR)控制着多种毒力因子的表达和有毒产物的合成。Adiliaghdam等[75]研究表明,抑制铜绿假单胞菌QS系统可通过维持肠道屏障和免疫功能来缓解肠道通透性过高,减少细菌耐药性的发展,并保留有益的肠道微生物。肠道微生物生态系统具有多重抗感染、抗炎和免疫调节作用,对肠道内环境稳定起决定性作用,其会通过基于QS的代谢和免疫机制来抵抗肠道病原体,从而保护宿主健康[76]。产气荚膜梭菌C型可导致人和动物产生肠毒血症和出血性腹泻等严重疾病。Nava等[77]研究发现,用产气荚膜梭菌C型菌株CN3685感染人肠道细胞后,由QS调控的产气荚膜梭菌Agr样(clostridium perfringens Agr-like,CpAL)系统介导的用于评估肠道屏障功能的肠道细胞跨上皮抵抗力(trans-epithelial resistance,TEER)显著下降。对金鱼肠道细菌基因序列鉴定和产生AHL能力筛选中发现,当AHLs浓度达到一定阈值时,气单胞菌和希瓦氏菌属细菌可通过QS系统相互交流[78]。Tao等[79]研究发现,肠道中革兰氏阴性细菌产生的AHLs群体感应分子可以影响肠上皮稳态。N-3-(氧十二烷酰基)-高丝氨酸内酯(C12-HSL)会通过诱导线粒体功能障碍和激活细胞凋亡显著降低细胞活力,导致黏蛋白表达降低。QS分子酰基高丝氨酸内酯,被认为能调节肠出血性大肠杆菌的基因表达,从而帮助该病原体在动物胃肠道中存活。从猪肠道中分离的嗜水气单胞菌菌株YZ2研究发现,其能产生N-丁酰基高丝氨酸内酯(C4-HSL),用质谱分析该菌与大肠杆菌共培养的上清液显示,该菌的LuxI同系物可以使大肠杆菌具有合成AHLs的能力,并影响大肠杆菌的运动性和耐酸性[80]。此外,乳酸菌的AI-2群体信号传递可能是适应宿主生态系统和在肠道环境中相互作用的一种方式[81]。QS信号分子AI-2可通过耐药基因tetA调控禽致病大肠杆菌金霉素耐药性,对于治疗耐药型禽致病大肠杆菌提供了新的药物靶标与治疗思路[82]。
Ismail等[83]发现,哺乳动物肠道中产生的AI-2类似物可以激活其肠道中细菌的QS系统,这种类似物可以被细菌AI-2受体LuxP/LsrB检测到,从而激活系统控制相关基因的表达。肠道黏膜可以通过降解细菌自体诱导物AIs或分泌AI模拟物来干扰细菌AIs,从而实现肠道微生物群与宿主之间的域间信号传递,这为未来肠道微生物群相关疾病的治疗提供了新的靶点[84]。由此可见,群体感应与肠道健康关系密切,如果能抑制有害菌的QS活动,对于促进畜禽机体健康,提高其生产性能具有重要意义。
4 小结与展望
目前,对于细菌QS的相关研究主要关注QS与有害菌之间的关系,而QS介导的肠道与营养素及微生物代谢物之间和有益菌的作用研究较少,多是一些表征性的因果关系,缺乏QS调控畜禽肠道微生物活动相关机制的阐述。肠道是一个非常复杂的消化器官,通过蛋白组学、代谢组学、微生物组学等多组学技术解析QS介导有益菌和有害菌定植与代谢、营养素与宿主代谢将会是研究的重要方向,对于以QS为靶标的促进畜禽肠道健康替抗产品开发也具有广阔的前景。

