全腹腔镜次全胃切除术在中上部早期胃癌治疗中的应用
胡 礼,杨 力,严志龙,徐泽宽
(1.南京医科大学第一附属医院胃外科,江苏 南京,210029;2.宁波市第一医院胃肠外科)
近十几年,近端胃癌在全世界范围内的发病率显著升高[1]。手术切除仍是治疗胃癌最主要的方法。多年来,对于近端胃癌,传统手术方式是行全胃切除术,但患者术后生活质量明显降低[2]。随着胃癌D2根治术及胃癌综合治疗的发展,尤其早期胃癌,术后5年生存率大大提高,术后残胃功能的保护、提高患者术后生活质量得到胃癌领域的一致认可。近端胃癌术后消化道重建的双通道吻合、双肌瓣吻合等在术后抗贫血或抗反流、提高术后生活质量方面具有一定疗效[3-4],但这些消化道重建均不可避免地切除了贲门结构。在特殊部位中上部早期胃癌中,保留贲门的次全胃切除目前研究较少。本研究回顾性收集2018年1月至2020年12月南京医科大学第一附属医院为19例、宁波市第一医院胃肠外科为12例中上部早期胃癌患者行全腹腔镜次全胃切除术的临床资料,探讨此技术的临床疗效。
1 资料与方法
1.1 临床资料 采用回顾性横断面描述性研究方法,收集31例通过胃镜活检诊断为胃原发性腺癌的患者,同时行超声胃镜、增强CT,明确肿瘤位置及浸润深度,参照第8版美国癌症联合会《胃癌TNM分期》,术前临床分期ⅠA25例、ⅠB6例。其中男20例,女11例,平均(64.4±10.9)岁。患者及家属术前均签署手术知情同意书。
1.2 纳入与排除标准 纳入标准:(1)术前均经胃镜、病理活检确诊为胃腺癌;(2)经超声胃镜、上腹部增强CT明确肿瘤位于中上部,且为早期胃癌;(3)术后病理不超过ⅡA期。凡具备以下条件者均排除本研究:(1)术前活检病理提示分化类型为未分化癌、印戒细胞癌;(2)存在严重心、肺、肝、肾等重要脏器疾病,且不能耐受手术;(3)体力状态评分≥2分,营养评分(NRS2002)评分≥3分,经术前治疗仍不能纠正;(4)重度肥胖、腹部严重粘连不宜行腹腔镜手术;(5)年龄>80岁。
1.3 手术方法 术前均需胃镜精准定位,部分病例当天在胃镜下于肿瘤边缘分4点黏膜下注射1 mL美兰(图1A)。按照远端胃切除要求行D1+或D2淋巴结清扫,主要清扫1、3、4、5、6、7、8a、9、11p、12a组淋巴结,不预防性清扫脾门淋巴结及第2组淋巴结。离断胃左、右血管、胃网膜左、右血管、部分胃短血管及胃后血管,胃网膜血管弓内游离,切除大网膜、小网膜。保留2支胃短血管(图1B)。根据术中美兰在胃浆膜面头侧显示情况拟切除线(图1C),但需满足大弯侧切除线距肿瘤上缘最少2 cm,小弯侧切除线距贲门齿状线最少1 cm,远端切缘在幽门下血管2 cm处。必要时术中胃镜检查确保食管胃结合部通畅。切除后胃标本(图1D)常规送上切缘行快速冰冻病理检查,如切缘阳性,改为全胃切除。重建方式有毕-Ⅱ式吻合、Roux-en-Y吻合及uncut Roux-en-Y吻合[5-6]。

图1 全腹腔镜下次全胃切除相关操作(A:术前胃镜下肿瘤上下切缘精准定位;B:术中保留2支胃短血管;C:术中根据美兰在胃浆膜面头侧显示情况离断胃体;D:术后标本情况)
1.4 观察指标 观察并记录术中及术后情况:手术时间、术后首次排气时间、术后首次进食时间(饮水、半流质)、术后淋巴结清扫数量及阳性数量、术后病理上切缘距离、术后近期并发症(吻合口漏、吻合口出血、吻合口狭窄)、术后住院时间、住院总费用、术后1年胃镜观察情况(吻合口炎、反流性食管炎)。
1.5 随访 术后患者均予以门诊随访,术后1年行胃镜检查,了解残胃及吻合口情况,行肿瘤标记物与上腹部增强CT、胸部CT检查,了解肿瘤复发情况。平均随访(20.3±12.0)个月,随访截至2021年11月。
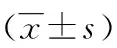
2 结 果
2.1 术中情况 31例中上部早期胃癌患者均成功实行D1+(9例)、D2(22例)淋巴结清扫,14例完成全腔镜下毕-Ⅱ式吻合,10例完成全腹腔镜下Roux-en-Y吻合,7例完成腹腔镜下uncut Roux-en-Y吻合,无一例中转开腹及腹腔镜辅助手术,手术时间平均(167.5±33.4)min。
2.2 术后近期指标及病理情况 术后首次肛门排气时间(56.9±18.3)h,饮水时间(2.90±0.79)d,进食半流质时间(4.32±0.79)d,术后平均住院(7.58±1.36)d,总费用(5.81±0.79)万元。围手术期无死亡病例,无一例发生吻合口漏、出血、狭窄等并发症。平均清扫淋巴结数量(33.6±14.4)枚,2例出现第三组淋巴结阳性。上切缘平均(24.6±5.8)mm。参照第8版美国癌症联合会《胃癌TNM分期》,术后病理分期ⅠA24例、ⅠB5例、ⅡA2例。
2.3 术后随访结果 随访采取门诊面对面交流,随访过程顺利,结果可靠。2例患者进食后上腹部不适,6例偶有反酸,2例偶有腹痛,21例显示生活质量良好。术后1年胃镜检查示患者均出现不同程度吻合口炎(图2A),均未出现反流性食管炎(图2B)。根据肿瘤标记物、上腹部增强CT及胸部CT检查情况,至随访结束,无一例出现局部复发及远处转移迹象。

图2 术后1年左右胃镜复查情况(A:吻合口炎;B:食管情况)
3 讨 论
3.1 次全胃切除术治疗特殊部位中上部早期胃癌的优势 当今胃癌外科不仅要在根治的基础上提高手术安全性,还应注重提高患者术后生活质量[2]。随着胃癌D2根治术及综合治疗的发展,术后5年生存率有所改善,尤其早期胃癌,患者可长期生存,因此为提高患者术后生活质量,对术后残胃功能的保护显得尤为重要。基于对胃器官的精准划分(图3),不同分区的肿瘤有不同保护残胃功能的术式,位于近端的胃癌(1~4区),早期以全胃切除后的Roux-en-Y吻合为主,因全胃切除术后营养指标如血红蛋白、体重、白蛋白等均有明显下降[7],逐渐发展到以各种保护残胃功能为主的术式,其中具有代表性的有近端胃切除后的双通道吻合、双肌瓣吻合等。双通道吻合相较全胃切除Roux-en-Y吻合,在铁离子、维生素B12的吸收方面存在优势[8]。原因在于保留远端大部分残胃,也就保留大部分的胃壁细胞,对于胃酸的分泌影响较小,从而对铁离子、维生素B12的吸收影响较小,也就不至于导致小细胞低色素贫血[9];同时又因存在远端胃通道,食物储留功能也得到相应的保证。然而实际临床应用中仍有部分患者出现小细胞低色素贫血及胃通道闭合的情况,食物通道、胃酸通道在远端的小肠内并不能均匀地同时相混合,Fe3+不能很好地转化成Fe2+,远端小肠对铁离子的吸收受到影响,从而也会影响术后的血红蛋白水平[10-11]。这个过程可能需要较长的时间才能发现,因为肝脏内储存铁一般需要在胃切除术后2~3年才消耗完[12]。此外,双通道手术操作也较复杂,有3个吻合口,理论上术后吻合口并发症发生率也有所增加。相较全胃切除Roux-en-Y吻合,双肌瓣吻合具有较好的抗反流、抗贫血、营养状态较好的优势。原因在于保留大部分远端胃,且人工制造一个类似贲门的结构,起到一定的抗反流作用[13]。但双肌瓣吻合切除胃底组织,造成饥饿激素分泌减少,进一步导致术后食欲的减少,同时需要复杂的手术技术及较长的手术时间,不易于推广[14]。

图3 肿瘤病灶位于3、4区可行次全胃切除
本研究中全腹腔镜次全胃切除术与传统的肿瘤位于远端行扩大的远端胃切除术的次全胃切除术概念不同。位于1~4区的早期胃癌,全胃切除或近端胃切除均可行。随着对保护患者术后残胃功能的重视,国内一些大的中心开展保护残胃功能的近端胃切除术。然而在3、4区的这部分早期胃癌,因与贲门齿状线仍有一定距离,使保留贲门的次全胃切除成为可能。相较近端胃切除术,其主要优势在于保留贲门结构与胃底组织。因保留贲门结构也就保留了抗反流作用,文献指出[12-13],中上部早期胃癌行次全胃切除术后抗反流作用优于近端胃切除术后的双通道吻合与双肌瓣吻合。本研究中术后1年胃镜检查未发现反流性食管炎。因保留胃底组织,也就保留了胃底组织释放的饥饿激素,术后对食欲影响较小[15],术后体重的丢失不劣于近端胃切除的双通道吻合[12]。文献指出,次全胃切除术在术后1年、2年、3年的血红蛋白低于近端胃切除术,差异有统计学意义。但次全胃切除术后1年、2年、3年每年的平均血红蛋白为12.7 g/dL[12];笔者团队认为该血红蛋白水平对术后生活质量无明显影响。全腹腔镜次全胃切除术术后残胃行空肠毕-Ⅱ式吻合、Roux-en-Y吻合或uncut Roux-en-Y吻合,技术要求不高,相较近端胃切除术后的双通道与双肌瓣而言,易于推广。
3.2 次全胃切除在中上部早期胃癌中的关注点 关注点在于手术安全性与肿瘤安全性。在手术安全性方面,因肿瘤位置偏高,胃切除后有导致小弯侧胃食管结合部狭窄的可能,必要时通过术中胃镜检查的形式,确保胃食管结合部的通畅性。文献指出,只要保留一根胃短血管就可维持残胃血供[16]。本团队认为,保留一根胃短血管有残胃缺血的可能,本研究均至少保留2根清晰可见的胃短血管。术中需确保胃食管结合部通畅及残胃血供,避免术后出现狭窄、漏等潜在并发症的可能。在肿瘤安全性方面,对于分化类型良好的早期胃癌,切缘要求不高,但也须保证切缘达到阴性,因此术前或术中的精准定位尤为重要。有学者提出,术前胃镜检查在肿瘤上缘使用烧灼的方法定位,术中使用胃镜在经过大弯侧低位翻转直视烧灼部位,使用切割闭合器由小弯侧沿烧灼虚拟线离断胃[17],虽然可靠,但操作繁琐。本研究中南京医科大学第一附属医院团队是根据术前胃镜精准定位来确定拟切除线离断胃体;宁波市第一医院团队术前当天在胃镜下于肿瘤周边黏膜下注射1 mL美兰,根据术中美兰在胃浆膜面头侧显示情况拟切除线离断胃体。两中心均在标本离体后判断肿瘤切缘,如切缘判断不可靠,术中送快速冰冻切片检查,如为阳性,需转为全胃切除。Kamiya等报道[17],上切缘距离平均11.5 mm,其中1例术中快速冰冻切片提示切缘阳性,遂改为全胃切除。本研究中,术后病理上切缘为24.6 mm,无一例阳性。这与我们开展初期为保证技术安全性,在病例的选择上以肿瘤位置偏4区为主有关,为以后开展肿瘤位于3区者行全腹腔镜次全胃切除术作好前期经验积累。有研究显示,215例患者中159例检出第2组淋巴,其中仅1例出现第2组淋巴结阳性,阳性转移率为0.6%[18]。结合文献,本团队认为第二组淋巴结可不做预防性清扫,当然术中发现肿大的第二组淋巴结,建议改为近端胃切除或全胃切除术。文献进一步指出,次全胃切除、全胃切除、近端胃切除的5年总生存率、无肿瘤复发生存率差异无统计学意义,次全胃切除组肿瘤安全性并不劣于其他两组[18]。本研究至随访结束,未发现肿瘤局部复发及远处转移。
总之,全腹腔镜次全胃切除术不仅具有全腔镜下手术创伤小、康复快的特点,同时也是安全、可行的,因保留贲门结构,术后抗反流作用良好,遵循对位于3、4区的早期胃癌需保护贲门结构及胃底组织的理念,可作为中上部早期胃癌手术方式的合理选择。此外,本研究属于回顾性描述性研究,病例数较少,随访时间较短,有待相关的前瞻性多中心较大样本的随机对照研究与长期随访进一步证实中上部早期胃癌行次全胃切除术的安全性,以提高患者术后生活质量,指导临床及推广应用。

