消化道肿瘤单细胞转录组测序研究中生物样本前处理改良的探索
杨蕊馨,杜宇童,燕然林,朱正纲,李琛,于颖彦
(上海交通大学医学院附属瑞金医院普外科,上海消化外科研究所,上海 200025)
消化道上皮源性肿瘤是公认的异质性较高的肿瘤,不同的肿瘤基因型及组织学表型决定了不同个体对放化疗反应的差异。以胃癌为例,美国癌症基因组图谱组织(The Cancer Genome Atlas,TCGA)在多组学分析的基础上将胃癌分成EB 病毒阳性型、微卫星不稳定型、基因组稳定型和染色体不稳定型4 个亚型[1]。该分子分型方案的提出,促进了胃癌从传统的治疗模式向基因靶向治疗和免疫治疗发展。然而,TCGA 分子分型的提出年代尚以传统组学检测技术为依据,检测的是肿瘤批量组织块(bulk sequencing)的平均基因谱特征,此种检测方式极有可能掩盖了某些细胞群体的细微分子特征,分辨率尚有待提高。
单细胞转录组测序(以下简称单细胞测序)技术则可以实现同时对组织中数以千计的单个细胞进行转录组分析,并将具有相似转录谱的细胞进行分群归类,可区分具有微细分子特征的细胞群,明显提高转录组研究的分辨率[2]。近年来,针对消化道肿瘤的单细胞测序研究的报道逐年增加。如Fu 等[3]报道了胃癌组织单细胞转录组研究中T 淋巴细胞的组成特征,提出胃癌的免疫细胞亚型差异。Zhang等[4]利用单细胞测序技术分析结肠直肠癌肝转移灶的分子特征,明确了肿瘤浸润免疫细胞的分群及分子调控机制。Elyada 等[5]同时比较分析了人类与小鼠胰腺癌中癌症相关成纤维细胞(carcinoma-associated fibroblast,CAF)的单细胞转录组特征,提出了肌CAF 和炎性CAF 的细分特征,还发现了一个新的CAF 亚群。迄今发表的消化道肿瘤单细胞转录组相关研究大多聚焦于肿瘤微环境中免疫细胞和纤维母细胞等领域,究其原因,推测是与间充质细胞缺乏紧密连接而在样本前处理时较易获得游离单细胞悬液有关。就消化道上皮源性肿瘤而言,阐明肿瘤上皮细胞组份的异质性与免疫微环境的异质性同等重要。Zhang 等[6]最近报道了胃癌活检样本组织单细胞转录组的特征,发现了肿瘤上皮细胞之间存在较大异质性。
当前,单细胞测序的组织样本前处理操作尚缺乏统一标准,一般是利用胶原酶[7]或组织消化试剂盒先将组织块消化成细胞悬液[8]。由于上皮细胞之间的连接较为紧密,相互粘附容易结团,结团的细胞在上机测序前的细胞悬液过滤操作时会被过滤掉,导致实际上机检测的单细胞悬液中肿瘤微环境细胞成份较多。因此,如何提高消化道肿瘤单细胞测序时上皮细胞组分是亟需解决的现实问题。为此,本团队分析了公共数据库内消化道上皮性肿瘤单细胞测序数据中上皮细胞成分与间充质细胞成分的比例,并探索了在保留细胞活性前提下能够提高单细胞测序组织细胞悬液中上皮成分占比的方法。
材料与方法
一、公共数据库单细胞测序样本数据分析
本研究使用的单细胞转录组测序数据集均取自于GEO 数据库,包括胃上皮及胃癌数据集(GSE150290)[9]、结肠直肠癌数据集(GSE188711)[10]和胰腺癌数据集(GSE156405)[11]。采用Seurat R 软件包对获取的单细胞测序数据(10x Genomics 测序平台)进行处理(Version 3.1.3),通过标准化数据预处理,剔除线粒体基因占比>5%的低质量细胞,保留单个细胞表达基因数量在100~4 000 的细胞用于后续分析。在KNN 算法自动聚类分析时将分辨率设置为0.1,使用tSNE 方法将细胞分类可视化展示。细胞分群标志设定为,EPCAM、KRT18 及KRT8阳性为上皮细胞;其余的非上皮细胞簇又进一步分成CD2、CD3D 及CD3E 阳性的T 细胞淋巴细胞,MS4A1 及CD79A 阳性的B淋巴细胞,ACTA2 及COL1A2 阳性的纤维母细胞以及其他细胞[6]。
二、胃癌样本采集及用2 种不同前处理方法制备单细胞悬液并比较细胞活力
收集2 例在本院外科因胃癌行根治性手术治疗切除的胃癌组织标本,用2 种不同前处理方法处理。
1.传统酶消化法组织样本前处理(传统法):新鲜样本离体后先采用磷酸缓冲液充分洗涤,然后采用眼科剪将样本剪碎,加入含有胶原酶Ⅳ(1 mg/mL,07426,Stemcell,Canada)的消化液消化30~60 min,再用35~40 μm 的细胞过滤器过滤,以去除细胞悬液中的细胞团,随后用磷酸缓冲液重悬,获得细胞悬液。
2.改良的组织样本前处理(改良法):先在本部门实验室对组织样本采用传统的胶原酶消化制备细胞悬液,然后移交单细胞测序中心。由于样本运送过程中部分上皮细胞可相互之间再次黏附成团,故样本在上机检测前采用0.33 mm 胰岛素注射器进行反复吹打30 s,以机械性解离力使细胞充分解离,然后经35~40 μm 的细胞过滤器过滤,再用磷酸缓冲液重悬,获得细胞悬液。
将2 种前处理方法处理后制备的单细胞悬液,分别以1∶1比例与AO/PI双染试剂(CS2-0106,Nexcelom Bioscience,中国)均匀,混合孵育5 min,随后使用荧光细胞分析仪(RY071A2007,Shanghai Ruiyu Biotech,中国)分析2 种方法处理后单细胞悬液的结团率及细胞活力。一般的上机检测样本要求细胞结团率在25%以下。2 个或2 个以上细胞粘附在一起时判定为结团。细胞活力计算时,将被碘化丙啶(propidium iodide,PI)染料染成红色荧光的细胞记录为死细胞,将被AO 染料染成绿色荧光的记录为活细胞,从而可计算出活细胞总数量。一般的上机检测样本要求活细胞达到75%以上。
三、统计学处理
采用Graphpad Prism(Inc.,La Jolla,CA,United States)软件进行统计分析及绘图。采用双侧t 检验比较2 种方法处理制备单细胞悬液间的结团率及细胞活力。P<0.05 为差异有统计学意义。
结果
一、公共数据库中消化道肿瘤数据集上皮细胞成分比例分析
本研究分析了公共数据库中胃上皮与胃癌数据集(GSE150290)中上皮的成分含量,其中胃黏膜样本1(见图1A)、胃黏膜样本2(见图1B)、胃癌样本1(见图1C)和胃癌样本2(见图1D)测序数据中上皮细胞簇的占比分别为17.05%、6.11%、8.93%和14.66%,均未达到20%(见图2E),该比例显然不符合其来源组织上皮细胞成分应有的比例。

图1 胃上皮及胃癌数据集中细胞成分占比分析
同时,本研究对公共数据库中结肠直肠癌单细胞转录组数据集(GSE188711)及胰腺癌单细胞转录组数据集(GSE156405)中的上皮细胞含量进行了分析。结果显示,结肠直肠癌样本1(见图2A)的上皮细胞占比为3.86 %,结肠直肠癌样本2(见图2B)的上皮细胞占比为16.60 %,2 份样本的上皮细胞成分占比均小于20%(见图2C),该比例不符合其组织中来源的上皮成分应占比例。胰腺癌样本1(见图3A)的上皮细胞占比为3.22 %,胰腺癌样本2(见图3B)的上皮成分占比为21.37%(见图3C),虽略高于前述几份样本,但也不符合其来源组织的上皮成分应占比例。

图2 结肠直肠癌数据集中细胞成分占比分析
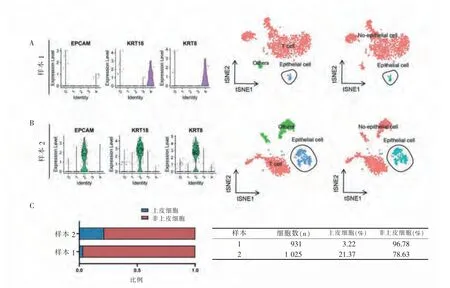
图3 胰腺癌数据集中细胞成分占比分析
二、不同样本前处理方法对上皮细胞结团率的影响
采用传统的胶原酶消化组织样本制成的单细胞悬液,上皮组织由于细胞间黏附分子的作用而难以完全形成游离的单细胞悬液,多见2~5 个聚在一起的结团细胞(见图4),此种结团细胞后续在经过35~40 μm 孔径的细胞过滤器过滤时无法通过,致使实际上机检测的单细胞悬液中非上皮细胞成分远超过上皮细胞。

图4 胃癌组织胶原酶消化制备的单细胞悬液细胞结团情况
采用改良的组织标本前处理方法(酶消化+机械性解离)后,可使单细胞悬液细胞结团率从传统操作的56.26%±1.98%(胃癌样本1)和38.34%±1.26%(胃癌样本2)下降到22.78%±1.38%(P<0.000 1)和14.46%±0.92%(P<0.000 1)(见图5A、5B),可明显增加上机检测单细胞悬液中的上皮细胞组分。
三、不同样本前处理方法对上皮细胞活力的影响
2 种不同操作对单细胞悬液细胞活力的影响检测显示,改良法增加了机械解离力操作,虽然会轻度降低细胞活力,但活细胞含量均在75%以上,符合上机检测要求(见图5C、5D)。胃癌样本1中,采用传统的前处理方法处理后,活细胞占98.43%±0.56 %;而采用增加机械解离力操作的改良前处理方法处理后,样本的活细胞含量为95.16%±0.42%,两者间差异有统计学意义(P=0.003)。在胃癌样本2中,采用传统的前处理方法处理后,活细胞占97.24%±0.48%;而采用增加机械解离力操作的改良前处理方法处理后,活细胞含量为93.52%±0.82%,两者间差异有统计学意义(P=0.005)。该结果提示,消化道肿瘤的单细胞测序研究中,样本前处理时在常规胶原酶消化后,样本上机前再辅以0.33 mm 胰岛素注射器进行机械性解离操作,能够保持足够活细胞占比(见图6)。

图5 传统样本前处理法与改良前处理法的胃癌单细胞悬液结团率比较

图6 胃黏膜与胃癌组织单细胞悬液制备流程图
讨论
单细胞测序技术的快速发展为解析肿瘤异质性提供了前所未有的机遇。然而,从迄今发表的肿瘤单细胞测序相关报道不难发现,多项研究聚焦于对肿瘤微环境细胞异质性的剖析[3,12-14],相比之下,利用单细胞测序技术分析肿瘤上皮组份异质性的研究报道[6-7]并不多。
由于目前对于单细胞测序中组织样本的前处理尚无统一的方法,而笔者所在的研究团队在实际工作中注意到,常规的以胶原酶为基础的组织消化及细胞过滤操作,不仅存在消化不彻底导致结团率较高问题,未被完全消化的结团上皮细胞成份在细胞悬液过滤时被阻隔在过滤器之外,其结果是微环境中的免疫细胞或者CAF 成为单细胞悬液的主要成分。笔者推测,肿瘤上皮细胞异质性研究报道较少的原因可能与单细胞测序样本前处理操作有一定关系。
为此,本研究从GEO 公共数据库中提取到胃癌、结肠直肠癌和胰腺癌的单细胞测序数据集,分析了其中的上皮细胞成分占比发现,几种主要消化道肿瘤组织的单细胞测序数据集中上皮细胞占比均较低,占测序细胞总数的25 %以下。显然,该上皮细胞占比不符合其起源于上皮组织器官的细胞构成特征。上述公共数据库数据集的分析结果支持笔者的推断,即现行的上皮源性肿瘤组织单细胞测序样本制备环节存在组织消化不够充分,多量结团上皮细胞被过滤掉的情况。
为了改善消化道肿瘤单细胞测序质量,本课题组探索了改良的样本前处理流程。目前,常规的胶原酶消化组织前处理是在研究者各自实验室完成,然后交由测序中心进行单细胞测序。在样本运送过程中,部分上皮细胞之间可再次黏附成团。若样本在上机检测前采用0.33 mm 胰岛素注射器进行反复吹打操作,可明显降低上皮细胞的结团率,但对细胞活力的影响较小,仍处于符合上机测序的范围内(见图6)。
本研究也存在以下不足之处。本研究仅限于在胃肿瘤组织中进行不同前处理方法对单细胞悬液中上皮细胞组分的影响分析,后续拟增加在结肠直肠肿瘤及胰腺肿瘤组织的相关研究。此外,获得单细胞悬液的单细胞测序效果尚有待进一步研究。
综上,本研究通过对公共数据库中的主要消化道肿瘤组织单细胞测序数据集的细致分析,发现上皮细胞成分偏低这一普遍问题,可部分解释为何迄今单细胞测序相关报道中针对上皮成分异质性的研究较少。结合本团队实际工作体会提出,样本前处理操作是导致单细胞悬液中上皮细胞组分丢失的主要原因。本团队通过改良现有的样本前处理操作,明显改善了胶原酶消化上皮细胞存在结团率偏高这一问题。本研究成果将会促进上皮源性肿瘤单细胞测序研究的深化。

