21-羟化酶缺陷先天性肾上腺皮质增生患者睾丸肾上腺残基瘤超声特征分析
王之倩,李敏,于一飞,周建桥
(上海交通大学医学院附属瑞金医院超声诊断科,上海 200025)
先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)是一种常染色体隐性遗传疾病,是由参与肾上腺类固醇形成的酶缺陷引起,最常见的是21-羟化酶缺陷,经典型CAH 的发病率为1∶10 000 至1∶20 000[1];非经典型CAH 的发病率则更高,估计为1∶1 000[2]。性腺功能障碍是CAH 患者最重要的长期并发症,在男性CAH 患者中,睾丸肾上腺残基瘤(testicular adrenal rest tumor,TART)是引起性腺功能障碍的重要因素,尽早发现TART 并及时用激素干预,是避免性腺功能受损的重要治疗方式。超声作为经济、快捷、无辐射的检查方式,在睾丸检查中被广泛应用。但由于TART 相对罕见,且其超声表现多样,如病灶伴有钙化、高血供等,与睾丸其他恶性肿瘤的超声特征间有所重叠,对其认识不足容易导致超声误诊,使患者接受不必要的睾丸手术,从而影响性腺功能。本研究旨在总结TART 的超声特征性表现,提高超声医师对TART 的认识。
资料与方法
一、资料
回顾性分析2014 年11 月至2021 年10 月来我院内分泌科就诊的CAH 且伴有TART 的男性患者24例,所有患者均确诊为21-羟化酶缺乏。患者有不同程度的肾上腺皮质功能减退相关临床表现,实验室检查17-羟孕酮、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)升高,CT 或MRI 检查发现双侧肾上腺增大,经阴囊高频超声发现睾丸内异常回声病灶。在排除了图像资料不全的3 例患者后,共有21 例患者被纳入研究。其中2 例患者经睾丸活检病理确诊为TART,且对激素治疗不敏感。其余19 例为临床确诊,17 例经激素治疗后病灶不同程度缩小或消失;1 例在初诊时睾丸未见明显异常,随病程推移逐渐出现TART 征象,后调整激素治疗后病灶缩小;1 例在初诊时发现TART 累及单侧睾丸,后病程推移累及双侧睾丸,调整激素后病灶消失。
患者年龄为17~57岁,平均年龄为(29.2±12.3)岁,发现CAH 病程1 周至19 年。5 例因出生后拒奶、呕吐、发育迟缓确诊CAH,9 例因皮肤色素沉着、性早熟确诊CAH,3 例因男性不育无精子症就诊时发现CAH,5 例因体检发现肾上腺肿物,入院评估肾上腺功能后确诊为CAH。
二、方法
应用意大利百胜公司Mylab 65 彩色多普勒超声诊断仪,经阴囊使用浅表线阵探头LA523,探头频率为4~13 MHz。检查时,患者取仰卧位,暴露阴囊,上提阴茎,依次探查睾丸及附睾,观察病灶累及睾丸的个数、是否累及附睾,以及病灶的生长方式、形态、边界、回声和血供情况,总结超声图像特征。
结果
21 例TART 患者中,TART 病灶超声表现各异(见图1),累及双侧睾丸者14 例(66.7%),同时累及附睾者2 例(见图2),累及单侧睾丸者7 例(33.3%)。在发现病灶的35 个睾丸中,TART 主要表现为沿睾丸纵隔生长(82.9%)的不规则分叶状(85.7%)低回声(51.4%),并伴有丰富血流信号(61.8%)(见表1)。

图1 TART 的超声表现
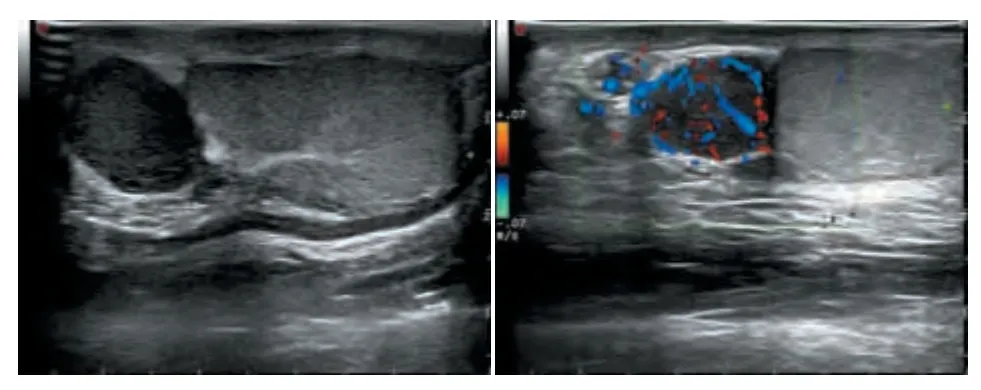
图2 TART 病灶累及附睾头

表1 睾丸TART 病灶超声表现(n=35)
讨论
一、CAH
CAH 是由于皮质醇合成过程中所需的酶先天性缺陷所致,常见的酶缺陷有21-羟化酶、11β-羟化酶、17α-羟化酶等,其中以21-羟化酶缺乏最为多见[3],多数由CYP21A2 基因突变引起[4],该酶的缺乏导致皮质醇产生受损,对垂体负反馈使ACTH 和雄激素的分泌增多,过度分泌的ACTH 又刺激睾丸内肾上腺皮质残留细胞增生,导致TART 的发生[5]。缺陷程度不同导致患者的TART 表现轻重不一。目前发现3 种主要临床表现,即经典失盐型、经典非失盐型(单纯男性化)以及非典型(迟发型)。新生儿筛查中,未识别的失盐型症状通常在出生后7~14 d出现,患儿表现为生长迟滞、脱水、低钠血症及高钾血症,严重者可危及生命。经典非失盐型患儿则表现为,在2~4 岁时提前出现男性性征发育,如出现阴毛及生长突增等;非经典型或迟发型则可表现为学龄期儿童性早熟,成人偶尔发现的睾丸或肾上腺肿物,亦可没有症状。
二、TART 及鉴别诊断
1.TART 超声表现:TART 在睾丸肿瘤中相对罕见,常见于先天性皮质增生症患者,超声表现多样。本研究发现,大多TART 病灶表现为沿睾丸纵膈生长的不规则分叶状富血供结节,以低回声及不均匀的高回声为主,有时高回声内亦可见团状强回声,后方伴有声影。文献报道,大多数TART 患者为双侧发病[6],且双侧病灶具有完全相同的超声特征[7]。与文献报道稍有不同的是,本研究尚发现2 例患者双侧睾丸TART 病灶超声表现不同,即一侧为分叶状富血供的低回声,另一侧为不均匀的低血供高回声,其中1 例在初诊时即发现双侧病灶超声表现不同,另1 例则从双侧特征相同的低回声演变为不同超声表现,这2 例患者在经激素治疗后睾丸内病灶均消失。
2.鉴别诊断:一部分单侧睾丸发病的TART 病灶尚需与其他睾丸肿瘤相鉴别,如精原细胞瘤、淋巴瘤、睾丸畸胎瘤等。精原细胞瘤多见于青壮年男性,与TART 的相同之处是均表现为高血供病灶,但其占位性效应与TART 相比更强,病灶内部常有细小纤维状高回声分隔[8],有时可见肿大的后腹膜淋巴结。睾丸淋巴瘤患者中老年人多见,临床表现为睾丸无痛性肿大,超声可见高血供的局灶性或弥漫性低回声肿块,并伴有从纵隔向周围放射的低回声和高回声相间的条纹带,文献报道鞘膜积液约占40%[9-10],且更容易累及附睾及精索。睾丸畸胎瘤内常有不成熟的骨组织,故超声表现为病灶内的粗大钙化,与小部分TART 的超声表现有相似之处,但睾丸畸胎瘤往往为囊实性,青春期后发病患者为畸胎瘤恶性的可能性很大[11]。需注意的是,在鉴别诊断过程中询问患者病史尤其重要,例如有无发育迟滞、电解质紊乱,有无性早熟,有无皮肤色素沉着,有无肥胖、高血压及多毛症等[12],并且参考实验室检查结果(如激素水平等),检查时可同时探查双侧肾上腺明确增生情况,以增加诊断信心。
三、治疗
随着CAH 病程的发展,TART 可能在婴幼儿时期发病确诊时即被发现,也可在CAH 治疗过程中一过性出现,经过治疗后病灶逐渐消失,或在某些非典型病例中作为首发症状而被发现。TART 是一种良性的睾丸间质病变,早期发现时适当应用激素干预可缩小或消失,但若对其认识不足,容易将其当做富血供的恶性肿瘤,导致患者接受不必要的睾丸活检或切除手术,影响其生育力[13]。而在医师未知患者有CAH 病史时,对于TART 睾丸组织学检查,有时仅能做出睾丸间质细胞肿瘤的判断,可能使患者得不到更准确的诊断,而失去早期干预机会,若过晚干预,生精功能或因原发性性腺功能衰竭而受损。这主要由于TART 病灶位于睾丸纵隔附近的中心位置,很可能会导致生精小管的机械性阻塞,长期压迫使生精小管中血流受阻,致生精功能发生障碍及管周纤维化,对周围组织产生不可逆的损害[14]。由于残基细胞中有ATCH 受体,有研究表明TART 大小可能与ATCH 水平间存在潜在关系[15]。但ATCH 不是影响TART 的唯一因素,可能还涉及其他激素[16],故关于ATCH 水平与TART 病灶大小间的关系尚不明确。本研究也发现,即使ACTH 控制在较佳水平,仍然可观察到有TART 病灶,这与文献报道一致[17]。所以在男性CAH 患者的评估中,应结合肾上腺相关检查指标,在确诊早期规律进行睾丸超声检查,以便及时发现TART 病灶。
四、附睾累及
本研究尚发现2 例附睾累及的患者,推测其原因为胚胎发育过程中,肾上腺皮质和睾丸均来源于中肾,而附睾管的形成也来源于中肾近端的发育,随着睾丸和附睾的发育和迁移,肾上腺皮质细胞残留在沿途组织内。当先天性肾上腺皮质增生时,本该退化的残余肾上腺皮质细胞受到增高的ACTH影响增生发生了残基瘤[18]。本研究发现,附睾病灶的超声均表现为椭圆形边界清富血供的低回声,在发现附睾病灶的同时,也发现了同侧睾丸内相同超声表现的TART。
本研究还发现,11β-羟化酶、17α-羟化酶缺陷的CAH 患者也会有TART 病灶的存在,但由于病例数极其有限,此类患者TART 的超声特征尚无法进行系统性的总结及概括,这是本研究的局限性及不足之处,有待收集更多病例进行分析。
综上所述,TART 的诊断需结合CAH 的临床病史及特征性超声表现,超声可作为诊断TART 的首选影像学方式,在评估和随访CAH 患者中起重要作用。

