新型茶香酮-氧化吲哚类拼接物的合成
韩晓雪,黄 雄,2,刘雄利,王慧娟,彭礼军*
(1.贵州大学 西南药食两用资源开发利用技术国家地方联合工程研究中心,贵州 贵阳 550025;2.永康市第二中学,浙江 金华 321300)
茶香酮主要用作烟用香精和饮料香精的原料,也具有较强的生物活性[1-3],目前针对茶香酮的结构修饰或者合成其类似物文献报道较少。氧化吲哚在吲哚生物碱中占有重要的地位,由于其明显的生物活性以及独特的结构,引起了化学合成团队的关注[4-10]。因此,根据新药设计中的药物优势骨架拼接理念[11-13],将茶香酮骨架拼接到氧化吲哚骨架上,合成一系列具备潜在生物活性的茶香酮-氧化吲哚类拼接物,可以为生物活性筛选提供化合物基础,对制药行业具有重要的应用价值。
通过文献调研发现,以氧化吲哚1与茶香酮2为原料发生Michael加成反应未见文献报道。鉴于3-烷氧基-四取代氧化吲哚在新药研发中的重要性,本文基于新的合成方法学研究,以氧化吲哚1与茶香酮2为原料,在DABCO和哌啶组合催化体系下,在溶剂乙醇65 ℃中发生Michael加成脱氢反应,合成了10个未见文献报道的茶香酮-氧化吲哚类拼接物3a~3j(Scheme 1),产率为52%~71%,其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征,进一步通过单晶确定化合物3e的相对构型。该类化合物包含一个具有潜在生物活性的茶香酮骨架和氧化吲哚骨架,可以为生物活性筛选提供化合物源。
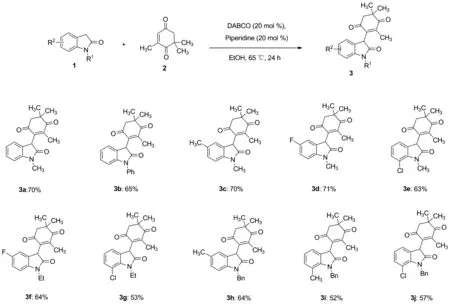
Scheme 1
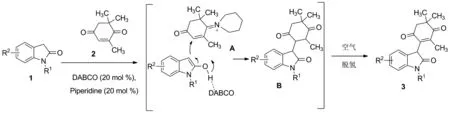
Scheme 2
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);MicroTMQ-TOF型高分辨质谱仪。
所用试剂均为分析纯。
1.2 3a~3j的合成(以3a为例)
在反应管中依次加入29.4 mgN-甲基氧化吲哚1a(0.20 mmol),45.6 mg茶香酮2(0.30 mmol),4.8 mg DABCO(20 mol/mol,0.04 mmol),3.4 mg哌啶(20 mol/mol,0.04 mmol)和2.0 mL乙醇溶液,在65 ℃中搅拌反应24 h,TLC检测至基本反应完全。旋干溶剂后,残余物经硅胶柱层析(洗脱剂:V(石油醚)/V(乙酸乙酯)=7/1)纯化得41.6 mg化合物3a。
用类似的方法合成3b~3j。
3a:淡黄色固体,m.p.119.2~120.7 ℃,产率70%;1H NMRδ:1.20(s,6H),2.21(s,3H),2.50(d,J=16.0 Hz,1H),2.62(d,J=16.0 Hz,1H),3.22(s,3H),4.41(s,1H),6.81(d,J=8.0 Hz,1H),6.87~6.90(m,1H),7.21~7.25(m,1H);13C NMRδ:13.1,25.0,25.6,44.2,45.7,50.0,107.5,121.3,121.4,125.9,127.6,143.8,146.5,194.2,201.7;HR-MS(ESI-TOF)m/z:Calcd for C18H19NNaO3{[M+Na]+}320.1257,found 320.1257。
3b:淡黄色固体,m.p.122.3~123.8 ℃;产率65%;1H NMRδ:1.22(s,6H),2.26(s,3H),2.54(d,J=16.4 Hz,1H),2.66(d,J=16.4 Hz,1H),4.60(s,1H),6.73(d,J=7.6 Hz,1H),6.91-6.93(m,1H),7.13~7.16(m,1H),7.34~7.37(m,2H),7.46~7.50(m,4H);13C NMRδ:13.2,25.0,44.3,45.8,50.0,108.8,121.7,125.7,125.9,127.2,127.5,128.7,143.6,144.1,146.4,173.8,194.2,201.7;H-RMS(ESI-TOF)m/z:Calcd for C23H21NNaO3{[M+Na]+}382.1414,found 382.1411。
3c:淡黄色固体,m.p.65.4~66.9 ℃;产率70%;1H NMRδ:1.21(s,6H),2.21(s,3H),2.50(d,J=16.0 Hz,1H),2.62(d,J=16.0 Hz,1H),3.19(s,3H),4.38(s,1H),6.66~6.70(m,2H),7.02(d,J=7.6 Hz,1H);13C NMRδ:12.6,19.6,24.6,24.8,43.8,45.3,49.6,106.8,121.8,125.6,127.4,130.4,141.0,143.0,145.9,173.8,193.8,201.3;HR-MS(ESI-TOF)m/z:Calcd for C19H21NNaO3{[M+Na]+}334.1414,found 334.1414。
3d:淡黄色固体,m.p.115.2~116.7 ℃;产率71%;1H NMRδ:1.21(s,6H),2.20(s,3H),2.51(d,J=16.0 Hz,1H),2.63(d,J=16.0 Hz,1H),3.20(s,3H),4.40(s,1H),6.61~6.63(m,1H),6.71~6.74(m,1H),6.91~6.93(m,1H);13C NMRδ:13.1,25.0,25.7,44.3,45.9,50.0,107.8(d,JCF=8.2 Hz),109.7(d,JCF=25.1 Hz),113.7(d,JCF=24.2 Hz),127.5,139.8,142.7,146.9,157.6(d,JCF=244.0 Hz),173.8,194.1,201.4;HR-MS(ESI-TOF)m/z:Calcd for C18H18FNNaO3{[M+Na]+}338.1163,found 338.1165。
3e:淡黄色固体,m.p.105.7~106.2 ℃;产率63%;1H NMRδ:1.21(s,6H),2.20(s,3H),2.50(d,J=16.4 Hz,1H),2.63(d,J=16.0 Hz,1H),3.58(s,3H),4.38(s,1H),6.71~6.73(m,1H),6.78~6.82(m,1H),7.13~7.15(m,1H);13C NMRδ:13.1,25.0,29.0,44.3,45.5,49.9,114.9,119.8,121.9,128.5,129.9,139.7,142.9,146.7,174.4,194.1,201.5;HR-MS(ESI-TOF)m/z:Calcd for C18H18ClNNaO3{[M+Na]+}354.0867,found 354.0871。
3f:淡黄色固体,m.p.92.4~93.9 ℃;产率64%;1H NMRδ:1.21(s,6H),2.20(s,3H),2.51(d,J=16.0 Hz,1H),2.63(d,J=16.0 Hz,1H),3.64~3.71(m,1H),3.78~3.85(m,1H),4.38(s,1H),6.61~6.64(m,1H),6.73~6.76(m,1H),6.89~6.94(m,1H);13C NMRδ:11.0,13.1,25.0,34.1,44.3,45.9,50.0,107.9(d,JCF=7.3 Hz),109.9(d,JCF=24.4 Hz),113.6(d,JCF=23.3 Hz),127.7,127.7,138.8,144.8,146.8,157.7(d,JCF=241.3 Hz),173.4,194.1,201.5;HR-MS(ESI-TOF)m/z:Calcd for C19H20FNNaO3{[M+Na]+}352.1319,found 352.1320。
3g:淡黄色固体,m.p.72.3~73.8 ℃;产率53%;1H NMRδ:1.21(s,6H),1.30~1.34(m,3H),2.20(s,3H),2.50(d,J=16.0 Hz,1H),2.64(d,J=16.0 Hz,1H),4.11~4.18(m,2H),4.37(s,1H),6.72(d,J=7.2 Hz,1H),6.78~6.82(m,1H),7.15(d,J=8.4 Hz,1H);13C NMRδ:13.2,13.3,25.0,35.9,44.2,45.5,49.9,114.4,119.9,121.8,128.9,130.0,139.1,143.0,146.6,174.2,194.0,201.6;HR-MS(ESI-TOF)m/z:Calcd for C19H20ClNNaO3{[M+Na]+}368.1024,found 368.1030。
3h:淡黄色固体,m.p.75.6~77.1 ℃;产率64%;1H NMRδ:1.23(s,6H),2.16(s,3H),2.23(s,3H),2.55(d,J=16.4 Hz,1H),2.68(d,J=16.0 Hz,1H),4.49(s,1H),4.82(d,J=16.0 Hz,1H),5.00(d,J=16.0 Hz,1H),6.50(d,J=8.0 Hz,1H),6.67(s,1H),6.87(d,J=8.0 Hz,1H),7.17~7.29(m,4H),7.38(d,J=7.6 Hz,1H);13C NMRδ:11.7,18.6,23.6,41.8,42.9,44.5,48.6,107.0,120.8,124.5,124.9,125.0,125.4,126.2,126.3,129.5,133.5,139.0,141.9,145.1,172.7,192.7,200.4;HR-MS(ESI-TOF)m/z:Calcd for C25H25NNaO3{[M+Na]+}410.1727,found 410.1734。
3i:淡黄色固体,m.p.109.7~11.2 ℃;产率52%;1H NMRδ:1.22(s,6H),2.19(s,3H),2.23(s,3H),2.55(d,J=16.0 Hz,1H),2.69(d,J=16.0 Hz,1H),4.52(s,1H),5.10(d,J=16.6 Hz,1H),5.25(d,J=16.6 Hz,1H),6.71~6.73(m,1H),6.86~6.89(m,1H),7.27~7.32(m,2H);13C NMRδ:13.1,17.7,25.1,44.5,45.6,50.0,119.3,121.4,124.8,126.0,126.5,127.8,131.5,137.0,140.9,143.3,146.6,175.1,194.1,201.8;HRMS(ESI-TOF)m/z:Calcd for C25H25NNaO3{[M+Na]+} 410.1727,found 410.1731。
3j:淡黄色固体,m.p.98.2~99.7 ℃;产率57%;1H NMRδ:1.18(s,6H),2.22(s,3H),2.55(d,J=16.0 Hz,1H),2.68(d,J=16.0 Hz,1H),4.51(s,1H),5.26(d,J=16.0 Hz,1H),5.39(d,J=16.0 Hz,1H),6.75(d,J=7.2 Hz,1H),6.80~6.84(m,1H),7.09(d,J=8.0 Hz,1H),7.18~7.20(m,2H),7.25~7.29(m,2H),7.35(d,J=7.6 Hz,1H);13C NMRδ:13.2,25.0,28.7,44.3,45.6,49.9,114.7,119.9,122.1,125.5,126.0,127.5,128.6,130.1,136.8,142.7,147.0,174.5,193.9,201.5;HR-MS(ESI-TOF)m/z:Calcd for C24H22ClNNaO3{[M+Na]+}430.1180,found 430.1175。
2 结果与讨论
2.1 合成
反应前期我们对催化剂进行筛选,发现只在DABCO或者哌啶催化下,该反应不能进行。在DABCO和哌啶组合催化下,65 ℃乙醇中24 h内能反应完全,产率达到70%。降低温度在室温下,该反应产率降低。最终对反应底物进行了扩展,在DABCO和哌啶组合催化体系下,反应活性较高,在溶剂乙醇65 ℃中反应24 h,产率为52%~71%。
2.2 化合物3e的单晶制备
在无水乙醇溶剂中对化合物3e进行了单晶培养,分析确证白色晶体3e(CCDC:2113676)的结构。图1为化合物3e的单晶结构图。由图1分析可知,化合物3e属monoclinic晶系,I2/a空间群,晶胞参数a=21.2913(15)Å,b=15.6806(8)Å,c=22.2924(15)Å,α=90°,β=117.781(9)°,γ=90°。

图1 化合物3e的单晶结构Figure 1Single crystal structure of compound 3e
2.3 反应机理
基于文献[14-15]报道和实验结果,推测该反应机理Scheme 2所示:茶香酮在哌啶的活化下生成亚胺正离子中间体A,氧化吲哚1在DABCO催化下发生Michael加成反应,进攻中间体A,生成中间体B。然后中间体B在空气氧化下发生脱氢反应生成产物茶香酮-氧化吲哚类拼接物3。
基于新的方法学研究,合成了10个未见文献报道的茶香酮-氧化吲哚类拼接物3a~3j,产率为52%~71%,其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征,进一步通过单晶确定化合物3e的相对构型。该类化合物包含一个具有潜在生物活性的茶香酮骨架和氧化吲哚骨架,可以为生物活性筛选提供化合物基础。相关药理活性的研究后续正在进行中。

