高血压脑出血手术前血肿形态对微创置管引流术血肿清除率的影响
张冰 田昵军
(1.扶风县中医医院神经外科,陕西 宝鸡 722200;2.渭南市第一医院神经外科,陕西 渭南 714000)
高血压脑出血(HICH)多发于老年人群,临床表现以呕吐、头痛、肢体偏瘫、意识障碍为主。临床治疗目的为快速消除血肿,并改善血肿的占位效应,避免血肿代谢产物对周边正常脑组织造成伤害。微创置管引流术能够有效清除血肿,并快速控制疾病,但其疗效与预后不一[1]。研究[2]显示,若能够在术前对患者血肿形态进行判断,可为后续治疗方式的选择提供有利依据。本文主要探讨高血压脑出血手术前血肿形态对微创置管引流术血肿清除率的影响。
1 资料与方法
1.1一般资料 选择我院2018年9月至2020年5月收治的115例HICH患者,于术前对其血肿形态进行观察,将血肿形态规则者设为A组(n=68),血肿形态不规则设为B组(n=47),A组中男39例,女29例,年龄(65.17±1.25)岁,丘脑出血20例,基底节出血27例,小脑出血21例;B组中男25例,女22例,年龄(65.36±1.20)岁,丘脑出血13例,基底节出血19例,小脑出血15例。纳入患者均符合《高血压性脑出血中国多学科诊治指南》[3]中诊断标准,经过影像学检查确诊,病历资料齐全。已剔除实验前接受抗凝或者抗血小板药物者;合并精神类疾病、肝肾疾病、恶性肿瘤、凝血功能障碍或者其他脑血管病变者;妊娠或者哺乳期女性。两组一般资料比较差异无统计学意义(P>0.05)。患者及家属均知情同意。
1.2方法 依照患者CT,在其头部进行标记,再次执行CT探查,并利用CT工作站实施血肿三维重建,对手术入路进行规划,选择最佳的进针点、穿刺方向与深度等。所有患者接受手术,常规消毒铺巾,并在其头部放置颅脑手术头架,选择定位针以及探针实施穿刺操作,打开头皮,利用电钻打开颅骨,取出电钻,通过硬脑穿刺针试探硬膜是否穿破,若穿透可依据手术计划深入放入穿刺管,无阻力抽吸血肿,直到感受到阻力,停止抽吸,妥善固定穿刺管,撤出头架,结束手术。术后选择尿激酶+生理盐水注入血肿腔,待血肿残存15 mL以下或者<10%时拔管。
1.3观察指标 分别于手术前、术后即刻、术后1、3 d时测定两组残余血肿量、血肿清除率,残余血肿量=1/2×血肿最大层面的长径×宽径×层厚×层面数,血肿清除率=(手术前血肿量-手术后血肿量)/手术前血肿量;于术前、术后3 d进行MRS(改良Rankin量表)、NIHSS(神经功能缺损)评分调查。
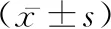
2 结 果
2.1残余血肿量 术前,两组的残余血肿量比较无差异(P>0.05),术后即刻、术后1、3 d时,A组残余血肿量低于B组(t=12.570、10.531、15.501,P均<0.05)。见表1。

表1 两组不同时间点的残余血肿量
2.2血肿清除率 A组术后即刻、术后1、3 d的血肿清除率分别为31例(45.59%)、46例(67.65%)、60例(88.24%),均高于B组的9例(19.15%)、17例(36.17%)、32例(68.09%),差异有统计学意义(χ2=8.564、11.116、7.053,P<0.05)。
2.3MRS、NIHSS评分 术前,两组的MRS、NIHSS评分比较无差异(P>0.05),术后,A组各项评分均低于B组(t=6.922、15.248,P均<0.05)。见表2。
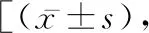
表2 两组MRS、NIHSS评分的比较分]
3 讨 论
HICH是危害人们机体健康与生存质量的常见脑血管疾病,临床应尽早清除血肿,防止对周边脑组织造成压迫,进而保障患者预后[4-5]。
本文结果显示,术后即刻、术后1、3 d时,A组残余血肿量、血肿清除率均优于B组(P<0.05)。手术前两组的MRS、NIHSS评分比较无差异(P>0.05),手术后A组评分低于B组(P<0.05),提示A组血肿清除率更高,且减少残存血肿量,快速改善神经功能缺损情况,生存质量更好,同时也证实血肿形态对手术效果的影响较大,与不规则血肿形态的患者相比,规则形态者更适用于微创置管引流术。若患者术后血肿残存量较多,其可能难以获得拔管指征,需要延长引流时长,且增加血肿腔内注药的剂量,进一步提升颅内感染的风险,应受到临床重点关注[6-7]。因此针对高血压脑出血患者,应在术前积极判断其血肿形态,若显示不规则时,可选择多靶点穿刺法,以此促进引流,集合多个中小型血肿单靶点穿刺引流,可促进尿激酶在血肿内分散均匀,并扩大溶解范围,迅速达到溶解效果[8]。同时从多角度引流,可有效缩短引流时长,并保证对口引流,使其引流更加充分,为预后提供保障。

