HBV RNA检测在慢性乙型肝炎中的临床价值
马艳婷,苏 曦,黄 斐,王梦娴,沈敏娜,张春燕,王蓓丽,潘柏申,郭 玮
(1.复旦大学附属中山医院检验科,上海 200032;2.复旦大学附属中山医院厦门医院检验科,福建 厦门 361015)
由乙型肝炎病毒(hepatitis B virus,HBV)感染导致的慢性乙型肝炎(chronic hepatitis B,CHB)会发展成肝衰竭、肝硬化及肝癌,已成为严重的公共卫生问题[1]。用于治疗CHB的药物主要为核苷类似物(nucleotide analogue,NA)[2]。然而,NA并不能完全清除肝细胞内的共价闭合环状DNA(covalently closed circular DNA,cccDNA),cccDNA持续存在是导致CHB久治不愈的根本原因。目前,最可靠的cccDNA检测样本是肝脏组织,但其获取及后续的分离纯化难度较大,无法进行动态观察。因此,临床亟需一种能够反映肝脏内病毒感染进程以及监测cccDNA活性的替代指标。其他乙型肝炎血清学标志物,如HBV DNA、乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、乙型肝炎核心相关抗原(hepatitis B core-related antigen,HBcrAg)被证实与肝细胞内cccDNA有关[3]。然而,目前临床上以HBV DNA持续低于检出下限为停药指标的患者仍有很高的疾病复发率[4]。近年来,有研究发现血清中存在HBV RNA[5],这些HBV RNA是包裹在病毒样颗粒内的未经或部分逆转录的前基因组RNA(pregenomic RNA,pgRNA),其能够直接获得病毒外膜并释放入血,可反映cccDNA活性[6-7]。有研究发现,HBV RNA与HBV DNA、乙型肝炎e抗原(hepatitis B e antigen,HBeAg)均有一定的相关性,因此或可将血清HBV RNA作为一种新的潜在的指标来监测病毒复制情况和评价药物疗效[8]。目前,国际上尚无标准化的血清HBV RNA检测方法,本研究对HBV RNA定量检测试剂盒进行了评估,并探讨HBV RNA的临床应用价值。
1 材料和方法
1.1 研究对象
选取复旦大学附属中山医院临床确诊为CHB的患者81例,其中男66例、女15例,年龄25~79岁。接受抗病毒药物[NA(替诺福韦、恩替卡韦、拉米夫定、阿德福韦酯)]治疗者49例,未接受抗病毒药物治疗者32例。所有患者血清HBsAg均为阳性。根据乙型肝炎血清标志物的不同模式将患者分为4组:第1组,HBeAg和乙型肝炎e抗体(hepatitis B e antibody,HBeAb)均为阳性,共20例;第2组,HBeAg阴性、HBeAb阳性,共18例;第3组,HBeAg阳性、HBeAb阴性,共20例;第4组,HBeAg和HBeAb均为阴性、乙型肝炎核心抗体(hepatitis B core antibody,HBcAb)为阳性,共23例。排除有肝移植及输血史的患者。
1.2 方法
1.2.1 样本采集 采集所有对象静脉血,4 h内分离血清,置于1.5 mL离心管中,-20 ℃冻存。
1.2.2 HBV RNA定量检测 取200 μL血清,使用核酸提取或纯化试剂盒(湖南圣湘公司,批号S1006)提取HBV RNA。采用HBV RNA定量检测试剂盒(湖南圣湘公司)检测HBV RNA。检测仪器为ABI 7500荧光定量PCR扩增仪(美国ABI公司)。PCR扩增体系为50 μL,反应条件:95 ℃ 1 min;60 ℃ 30 min;95 ℃ 1 min;95 ℃ 15 s,60 ℃ 31 s,共45个循环;25 ℃ 10 s。60 ℃采集荧光信号。所有检测结果必须满足以下要求:阴性质控FAM通道无循环阈值(cycle threshold,Ct)显示,VIC通道Ct≤35;阳性对照HBV RNA载量为1.0×104~1.0×106拷贝/mL;4个定量参考品检测均为阳性,且标准曲线相关性r2≥0.98。试剂盒检测线性范围为1.0×102~1.0×109拷贝/mL。以HBV RNA>1.0×102拷贝/mL为阳性。
1.3 方法学性能验证
参照中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)发布的CNAS-GL039:2019《分子诊断检验程序性能验证指南》进行性能验证。
1.3.1 精密度 将预混血清样本分装后-20 ℃保存。(1)批内精密度。分别在同一批次中对高值(105拷贝/mL)和低值(103拷贝/mL)混合血清样本重复提取20次,检测20次。(2)批间精密度。分别对高值(105拷贝/mL)和低值(103拷贝/mL)混合血清样本连续检测5 d,每天各重复提取4次、检测4次,共检测5批次,总计检测高值和低值样本各20份。计算变异系数(coefficient of variation,CV)。要求CV≤10%。
1.3.2 灵敏度 使用阴性血清将高值阳性临床混合血清样本稀释至接近试剂盒厂商声明的检测下限(1.0×102拷贝/mL),对稀释后的血清重复提取并检测20次,检测结果符合阳性判定标准,要求检出率≥95%。
1.3.3 线性范围 使用阴性血清对高值阳性样本(2.20×107拷贝/mL)进行梯度稀释(1.0×102~1.0×107拷贝/mL),在同一批次中对稀释样本进行检测,每个梯度重复检测3次,对测定值进行线性回归分析,通过计算测定值与理论值的线性相关系数得到直线回归方程Y=bX+a。如满足b在1±0.05范围内,r2>0.98,则可判定该方法在该浓度范围内成线性。
1.3.4 临床应用评估 采用NATCH-S全自动核酸提取仪(湖南圣湘公司)抽提81例CHB患者血清样本中的核酸,使用乙型肝炎病毒核酸定量检测试剂盒(湖南圣湘公司)在LightCycler 480荧光定量PCR扩增仪(瑞士Roche公司)上定量检测HBV DNA。PCR扩增体系共50 μL,反应条件:50 ℃ 2 min;95 ℃ 2 min;95 ℃15 s,58 ℃ 30 s,45个循环;37 ℃ 10 s。线性范围为5.0×101~5.0×108拷贝/mL。同时使用Elecsys 2010电化学发光全自动免疫分析仪(瑞士Roche公司)及配套试剂(电化学发光法)对HBsAg、HBsAb、HBeAg、HBeAb、HBcAb项目进行半定量检测。
1.4 统计学方法
对于HBV RNA或HBV DNA低于检出下限的数据,采用单值填补法和左删失数据来表示。采用SPSS 22.0软件进行统计分析。呈非正态分布的计量资料以中位数(M)[四分位数(P25~P75)]表示,。2个组之间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis检验,两两比较采用Bonfferoni t检验。将HBV RNA数据进行常用对数(lg)转换后再进行统计分析。相关性分析采用Spearman相关分析,线性回归采用简单线性回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 精密度验证
高值、低值样本的批内精密度(CV)分别为0.56%、2.30%,批间精密度(CV)分别为3.13%、6.03%,均符合临床要求(CV≤10%)。见表1。

表1 精密度验证结果
2.2 灵敏度验证
将高值阳性血清稀释至接近厂商声明的检出限(1.0×102拷贝/mL),重复提取并检测20次。20次均能检出,检出率为100%,HBV RNA均值为1.300 5×102拷贝/mL,CV为5.70%,与厂商声明的灵敏度一致。
2.3 线性范围验证
实测值与理论值的回归方程为Y=0.976 9X+0.129 9(r2=0.999 5),表明在HBV RNA 1.0×102~1.0×107拷贝/mL范围内成线性,符合临床要求。见表2、图1。
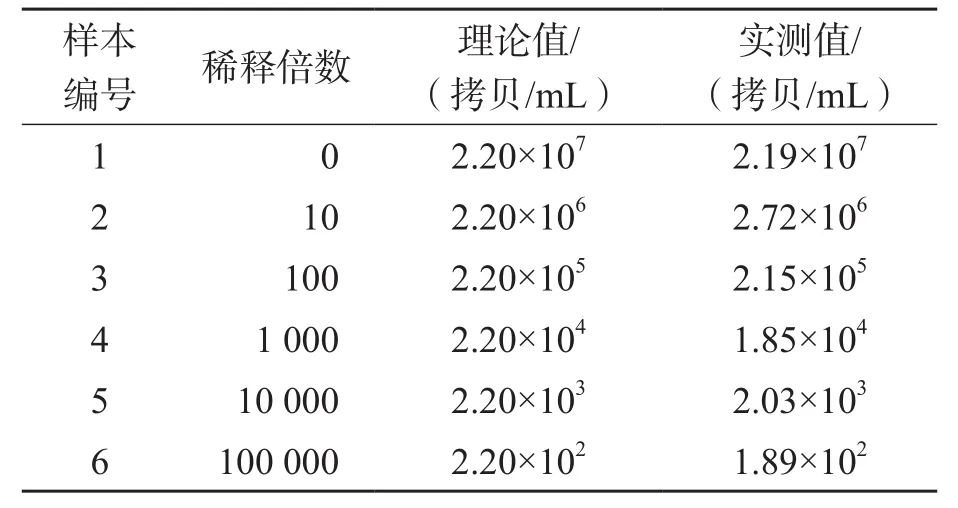
表2 线性范围验证结果
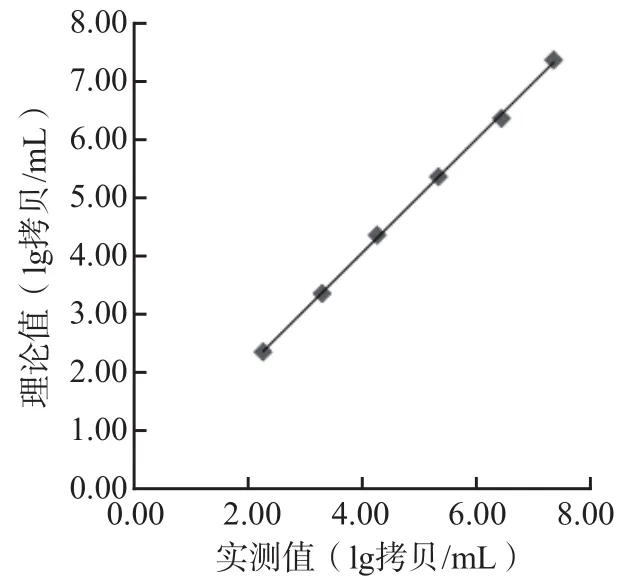
图1 实测值与理论值的线性关系
2.4 不同乙型肝炎血清标志物模式患者的HBV RNA载量比较
HBeAg阳性组血清HBV RNA和HBV DNA载量均高于HBeAg阴性组(P<0.01、P<0.05)。见表3。

表3 HBeAg阳性组与HBeAg阴性组血清HBV RNA和HBV DNA载量比较
在不同乙型肝炎血清标志物模式中,第1组血清HBV RNA阳性率为80.0%,第2组为27.8%,第3组为95.0%,第4组为37.5%。除第2组与第4组之间血清HBV RNA载量差异无统计学意义(P>0.05)外,其他各组之间血清HBV RNA载量差异均有统计学意义(P<0.01)。见图2。

图2 不同乙型肝炎血清标志物模式各组HBV RNA载量比较
2.5 治疗组与未治疗组HBV RNA结果比较
将49例经抗病毒药物治疗的患者归入治疗组,32例未经抗病毒药物治疗的患者归入未治疗组。未治疗组血清HBV DNA及HBV RNA载量均高于治疗组(P<0.01、P<0.05),见表4。治疗组血清HBV RNA阳性率(57.1%)与未治疗组(65.6%)比较,差异无统计学意义(P>0.05)。
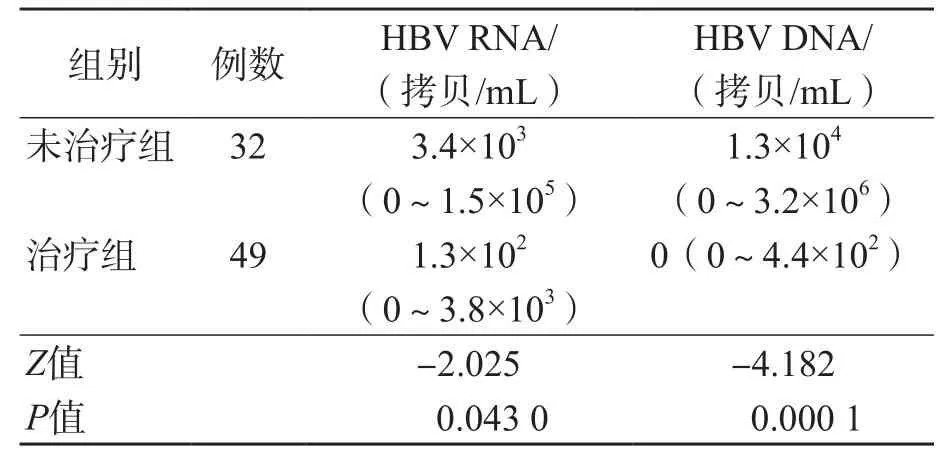
表4 治疗组与未治疗组血清HBV RNA和HBV DNA载量比较
2.6 HBV RNA与HBV DNA、HBeAg、HBsAg的相关性
在81例CHB患者中,HBV RNA水平与HBV DNA载量、HBeAg阳性滴度呈正相关(r值分别为0.348、0.544,P<0.05),与HBsAg滴度无相关性(r=0.040,P>0.05)。在HBeAg阳性的CHB患者中,血清HBV RNA载量与血清HBV DNA载量呈正相关(r=0.338,P<0.05)。在HBeAg阴性的CHB患者中,血清HBV RNA载量与血清HBV DNA载量无相关性(r=0.140,P>0.05)。
3 讨论
在HBV生存周期中,以cccDNA为模版逆转录生成RNA是HBV复制的开始,也是HBV持续感染和复发的主要原因[9-10],因此cccDNA是反映体内HBV感染和复制情况最直接的证据。从慢性HBV感染患者的肝细胞中清除cccDNA是根治CHB的关键[11]。但目前对cccDNA的分析仍主要依靠肝组织活检,过程复杂且具有侵入性,因此临床亟需能反映病毒感染复制情况、监测cccDNA活性的替代标志物。1996年,德国学者KÖCK等[5]首次在CHB患者的血清中检测到HBV RNA。自此,学者们对于HBV RNA的检测和临床研究不断深入。
目前,国际上尚缺乏标准化的血清HBV RNA检测方法,这是当前HBV RNA研究的一大难题。本研究对湖南圣湘公司的HBV RNA定量检测试剂盒进行了性能评估。结果显示,高值、低值样本的批内精密度(CV)为0.56%、2.30%,批间精密度(CV)为3.13%、6.03%,精密度验证通过;对接近厂商声明的检测下限的样本重复检测20次,检出率达到100%,灵敏度验证通过;在HBV RNA 1.0×102~1.0×107拷贝/mL范围内成线性。试剂盒性能均满足临床要求,可用于临床检测。
本研究结果显示,HBeAg阳性组血清HBV RNA和HBV DNA载量均高于HBeAg阴性组(P<0.01、P<0.05)。HBV RNA载量在2个组之间差异更为显著,表明HBV RNA是更灵敏的病毒活动监测指标。作为当前应用广泛的乙型肝炎血清标志物,HBV DNA可以提示e抗原的血清学转化[12]。近年来,有研究指出HBV RNA载量对于HBeAg血清学转换有预测作用[13]。因HBV RNA在HBeAg阳性患者与阴性患者之间有更为显著的差异,所以HBV RNA或可作为更有效的治疗监测指标。本研究根据不同乙型肝炎血清标志物模式对CHB患者进行分组,结果显示,HBeAg阳性的2个组(第1组和第3组)HBV RNA载量更高,其中HBeAb同为阳性组(第1组)HBV RNA载量低于HBeAb阴性组(第3组)(P<0.01),表明HBeAb阳性的CHB患者血清HBV RNA载量低于阴性患者。这是由于HBeAb伴随HBeAg的消失而出现,其标志着病毒复制减少、传染性降低,HBV RNA逆转录效率降低,导致进入血清中的HBV RNA病毒颗粒减少[14-15]。由此可见,血清HBV RNA可作为一种能更加灵敏且有效地反映病毒复制过程,提示HBeAg血清学转化的潜在标志物。但本研究未能跟踪随访所有HBeAg阳性患者的血清学转换情况,后续将完善这方面的研究。
本研究结果显示,治疗组血清HBV RNA检出率略低于未治疗组,但差异无统计学意义(P>0.05)。但未治疗组血清HBV DNA和HBV RNA载量均高于治疗组(P<0.01、P<0.05)。表明血清HBV RNA亦可作为反映患者肝组织内病毒活动程度及疗效监测的指标。
本研究Spearman相关分析结果显示,HBV RNA载量与HBV DNA载量、HBeAg阳性滴度呈正相关(r值分别为0.348、0.544,P<0.05),与HBsAg滴度无相关性(r=0.040,P>0.05);在HBeAg阳性的CHB患者中,血清HBV RNA载量与血清HBV DNA载量呈弱正相关(r=0.338,P<0.05);但在HBeAg阴性的CHB患者中,血清HBV RNA载量与血清HBV DNA载量无相关性(r=0.140,P>0.05)。既往研究结果表明,HBV RNA与HBV DNA、HBeAg和HBsAg均有一定程度的相关性[16],HBeAg阴性患者HBV RNA与HBV DNA相关性弱可能是受病毒变异、宿主免疫应答或cccDNA表观遗传调控的影响[17-18]。HBsAg与血清HBV RNA无相关性可能是由于病毒DNA整合于宿主DNA,之后转录翻译的HBsAg来自于整合后的核酸而非病毒的cccDNA[19]。本研究得出了几种指标之间相关性较低的结果可能与样本量较小,结果分析不够全面有关。
综上所述,血清HBV RNA是能灵敏、有效地反映病毒活动的指标,且与HBV DNA和HBeAg有一定的相关性,可提示二者的血清学变化。临床可联合HBV RNA、HBV DNA和不同乙型肝炎血清标志物模式综合分析病毒感染及治疗情况[20],指导用药与停药。由于本研究的样本量较小,且在实际操作过程中HBV RNA极易降解,因此可能对实验结果造成了一定的影响,这些因素需在后续研究中不断完善与修正。总之,血清HBV RNA作为HBV研究领域的新型生物标志物,具有巨大的研究和应用价值。

