E-Cad、G-17、HER-2与胃癌术后复发风险的相关性
茆 政,钱增堃,应 斐,王昭俐,肖 群,崔 凡
(芜湖市第一人民医院检验科,安徽 芜湖 241000)
目前,全球胃癌的发病率和死亡率分别居所有肿瘤的第5位和第2位,在我国分别居第2位和第3位[1]。胃癌的治疗主要采取手术及放疗、化疗的方法,但有学者发现,在早期胃癌根治术后仍有一定比例的患者会复发[2]。因此,预测胃癌患者的复发情况,及时调整治疗方案,对于患者的预后具有积极的意义。有研究结果显示,上皮型钙黏蛋白(epithelial cadherin,E-Cad)与肿瘤的迁移、浸润及预后有关[3]。人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)除与肿瘤发生、发展相关外,还是临床治疗、监测及预后评估的指标,与胃癌患者术后的生存时间显著相关[4]。有研究结果显示,HER-2激活可进一步促进肿瘤细胞的分裂及分化,促使肿瘤恶化[5]。胃泌素-17(gastrin-17,G-17)是近年来发现的胃癌的早期筛查指标,可用于反映胃癌细胞的增殖情况和肿瘤负荷状态[6]。本研究拟探讨E-Cad、HER-2、G-17与早期胃癌患者根治术后复发风险的相关性,为胃癌的预后判断提供参考。
1 材料和方法
1.1 研究对象
选取2015年1月—2016年12月芜湖市第一人民医院行胃癌根治术的患者100例,在术后进行为期5年的随访,有8例患者因联系方式变更等原因失访,失访率为8%;最终入组92例患者(胃癌组),其中男55例、女37例,年龄(50.29±2.59)岁,体质量指数(body mass index,BMI)为(24.55±2.11)kg/m2。以患者复发或随访满5年作为随访终点,随访时间为21~60个月,中位随访时间为38个月。根据有无复发将患者分为复发组(25例)和非复发组(67例)。另选取同期芜湖市第一人民医院胃良性病变患者92例(低级别上皮内瘤变61例,慢性萎缩性胃炎31例)作为对照组,其中男50例、女42例,年龄(50.37±2.46)岁,BMI为(24.61±3.48)kg/m2。2个组之间性别、年龄和BMI差异均无统计学意义(P>0.05)。本研究经芜湖市第一人民医院伦理委员会批准,所有患者均签署知情同意书。
1.2 纳入和排除标准
1.2.1 纳入标准 (1)符合胃癌的诊断标准[7];(2)预计生存时间>6个月;(3)卡氏(Karnofsky,KPS)评分[6]均≥70分;(4)患者知情且同意本研究方案。
1.2.2 排除标准 (1)心、肝、肾功能严重不全者;(2)存在交流障碍者;(3)不配合本研究方案者。
1.3 方法
1.3.1 一般资料 收集所有对象性别、年龄、临床分期、分化程度、复发情况等一般资料。
1.3.2 E-Cad、G-17检测 采集所有患者术前清晨空腹静脉血5 mL,1 800×g离心10 min,分离血清,-80 ℃保存待测。采用酶联免疫吸附试验检测血清E-Cad、G-17水平,E-Cad试剂盒购自上海江莱实业股份有限公司,G-17试剂盒购自必欧瀚生物技术(合肥)有限公司,检测仪器为HR801型酶标仪(深圳华科瑞科技有限公司)。严格按仪器和试剂盒说明书操作。
1.3.3 HER-2检测 收集胃癌患者行胃癌根治术时切除的肿瘤组织,胃良性病变患者行胃镜检查时采集的组织样本。采用免疫组化法检测胃组织样本中HER-2的表达量,BenchMark XT免疫组化染色试剂盒购自瑞士罗氏公司,严格按试剂盒说明书进行操作。采用CX43型显微镜(日本奥林巴斯公司)观察5个高倍镜视野,每个高倍镜视野计数100个肿瘤细胞。根据细胞膜着色的肿瘤细胞比例及染色程度进行评分:无染色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜着色,评分为0;>10%的浸润癌细胞呈现不完整的、微弱的细胞膜着色,评分为1+;>10%的浸润癌细胞呈现不完整的和/或弱到中等强度的细胞膜着色,或≤10%的浸润癌细胞呈现强的、完整的细胞膜着色,评分为2+;>10%的浸润癌细胞呈现强的、完整的细胞膜着色,评分为3+,见图1。将评分0、1+定义为阴性,评分2+定义为弱阳性,评分3+定义为阳性。

图1 胃癌组织HER-2阳性(3+)(×400)
1.4 统计学方法
采用SPSS 19.0软件进行统计分析。呈正态分布的计量资料以±s表示,2个组之间比较采用t检验。计数资料以例或率表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估各项指标判断胃癌复发的效能。采用Cox回归分析评估影响胃癌复发的因素。采用Kaplan-Meier生存曲线评估胃癌患者的5年复发率。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组与对照组血清E-Cad、G-17水平及肿瘤组织HER-2阳性率比较
胃癌组血清G-17水平和肿瘤组织HER-2阳性率均显著高于对照组(P=0.000),血清E-Cad水平显著低于对照组(P=0.000)。见表1。

表1 胃癌组与对照组血清E-Cad、G-17水平及肿瘤组织HER-2阳性率比较
2.2 不同临床病理参数胃癌患者血清E-Cad、G-17水平及肿瘤组织HER-2阳性率比较
血清E-Cad、G-17水平及肿瘤组织HER-2阳性率与胃癌的TNM分期、分化情况及是否复发有关(P<0.05),与性别无关(P>0.05)。见表2。
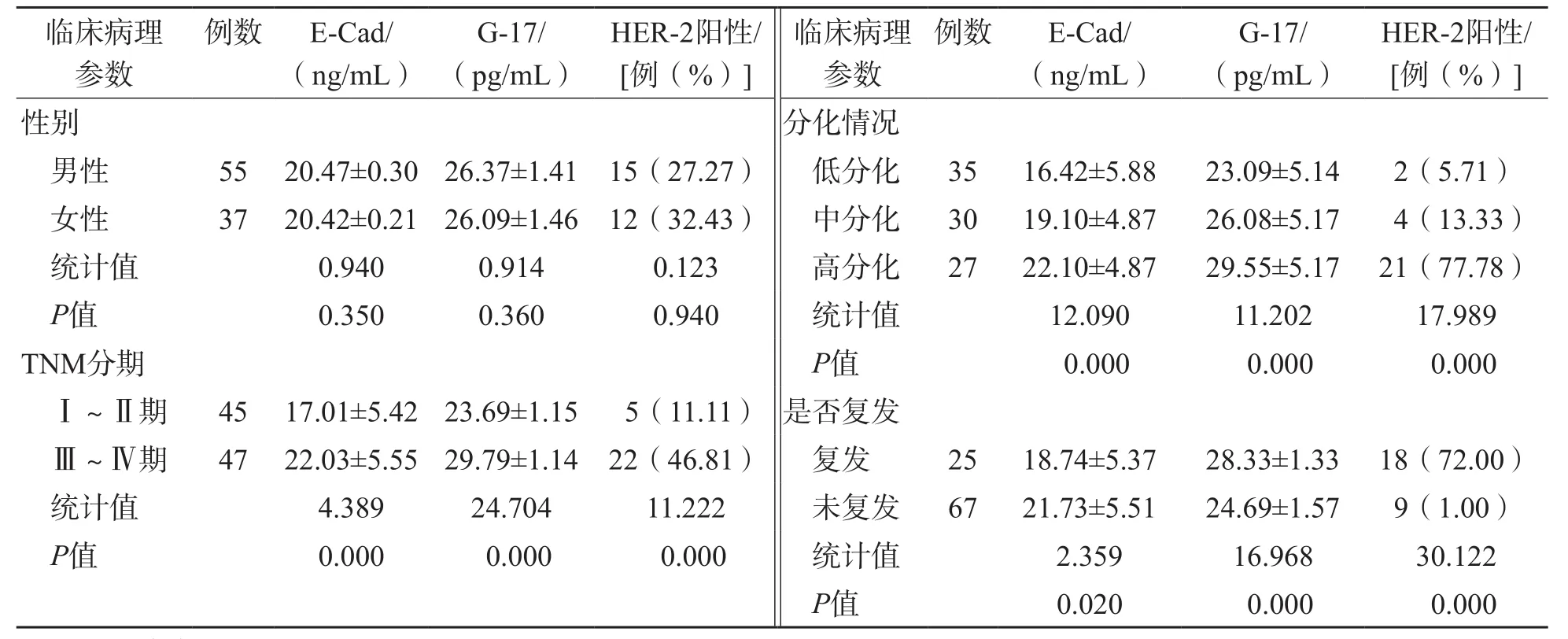
表2 不同临床病理参数胃癌患者血清E-Cad、G-17水平及肿瘤组织HER-2阳性率比较
2.3 E-Cad、HER-2、G-17判断胃癌复发的效能
ROC曲线分析结果显示,E-Cad、G-17、HER-2单项检测及3项指标联合检测判断胃癌复发的曲线下面积(area under curve,AUC)分别为0.775、0.822、0.603、0.950。见表3、图2。
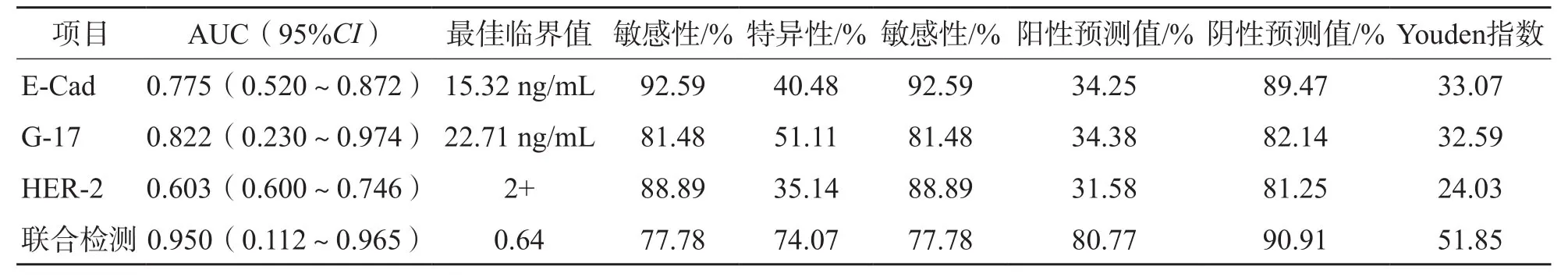
表3 E-Cad、HER-2、G-17判断胃癌复发的ROC曲线参数
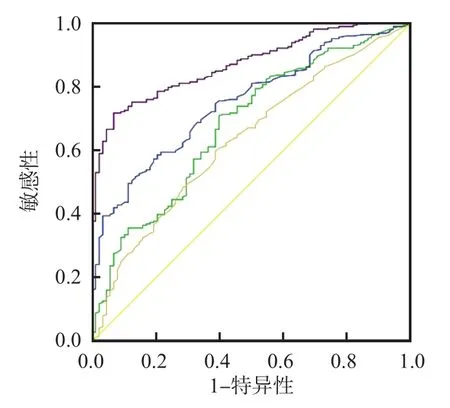
图2 E-Cad、HER-2、G-17判断胃癌复发的ROC曲线
2.4 胃癌患者的5年复发率分析
血清E-Cad、G-17分别以≥15.32 ng/mL、≥22.71 pg/mL为高表达,以<15.32 ng/mL、<22.71 pg/mL为低表达;HER-2以弱阳性(2+)和阳性(3+)为高表达,以阴性为低表达。Kaplan-Meier生存曲线分析结果显示,胃癌复发患者E-Cad低表达组复发率高于高表达组(P<0.05),而G-17低表达组、HER-2低表达组复发率低于G-17高表达组、HER-2高表达组(P<0.05)。见图3。
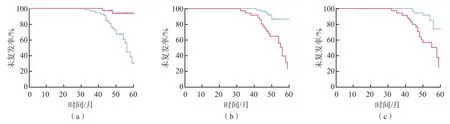
图3 胃癌患者的Kaplan-Meier生存曲线
2.5 影响胃癌复发的单因素分析
将与患者预后可能相关的临床病理因素(年龄、性别、肿瘤大小、分化情况、TNM分期、E-Cad、G-17、HER-2)进行单因素分析。结果显示,年龄、TNM分期、E-Cad、G-17、HER-2与胃癌根治术后患者预后相关。见表4。

表4 影响胃癌复发因素的单因素分析
2.6 影响胃癌复发的多因素分析
将单因素分析有统计学意义的项目纳入多因素Cox回归分析,结果显示,TNM分期Ⅲ~Ⅳ期、E-Cad水平降低、G-17水平升高、HER-2阳性(2+~3+)均是胃癌复发的危险因素(HR值分别为0.292、0.745、1.997、2.895,95%CI分别为0.139~0.714、0.664~0.985、0.658~4.328、0.548~7.758)。见表5。
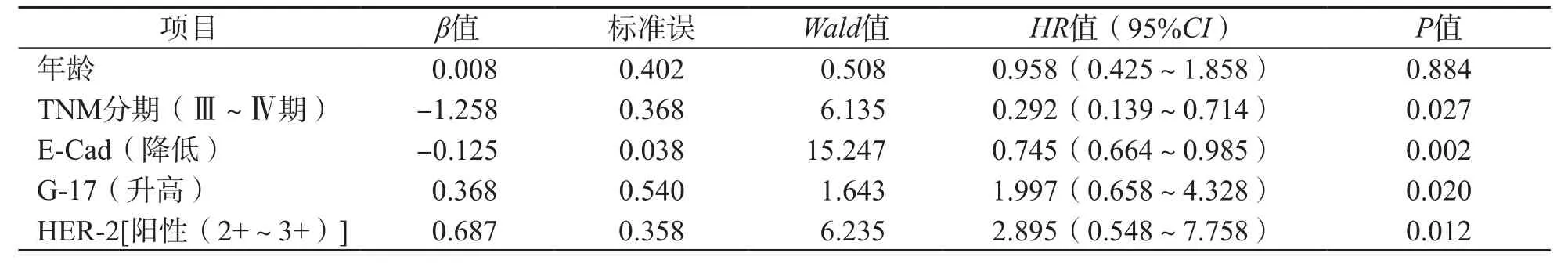
表5 影响胃癌复发因素的多因素分析
3 讨论
目前,针对胃癌的治疗主要遵循早发现、早诊断、早治疗的原则,但仍有一部分行胃癌根治术的患者会发生复发。因此,通过分析胃癌患者相关指标的检测结果,寻找复发的危险因素,进而对患者的术后治疗方案进行有针对性的调整,这对胃癌患者的预后具有积极的意义[8]。
本研究结果显示,胃癌患者血清E-Cad水平显著低于胃良性病变患者(P=0.000),复发患者血清E-Cad水平低于未复发患者(P<0.05)。有研究结果显示,胃癌患者E-Cad水平的降低会进一步促进胃癌细胞的迁移及向周边正常组织侵袭。胃癌主要起源于胃部上皮细胞[9],E-Cad又被称为上皮细胞黏附因子,是维持细胞完整结构的极性钙依赖性跨膜糖蛋白,在肿瘤发展的早期及迁移过程中有重要作用。有研究发现,胃癌根治术后,因肿瘤以及部分有分泌功能的胃黏膜被切除,正常情况下E-Cad会呈显著上升趋势,但当发生复发或转移后,E-Cad水平会显著下降[10]。张毅等[11]的研究结果显示,E-Cad与胃癌的进展显著相关。本研究结果显示,E-Cad低表达组5年复发率高于E-Cad高表达组(P<0.05),且E-Cad表达降低是胃癌复发的危险因素(HR=0.835,95%CI为0.767~0.909),与文献报道[12]一致。以往有关E-Cad的研究结论均是基于肿瘤组织得出的,本研究对胃癌患者血清E-Cad水平进行了分析,得出的结论与基于肿瘤组织的研究结论[13]基本一致。
G-17是一种多肽激素,调控了胃酸分泌量的90%。当胃部突变表现为多灶性萎缩,G-17水平明显下调,G-17在一定程度上反映了胃癌患者的肿瘤负荷状态[14]。本研究结果显示,胃癌患者血清G-17水平显著高于胃良性病变患者(P=0.000);复发患者血清G-17水平高于未复发患者(P=0.000)。有研究显示,胃癌患者G17水平显著升高,可促进癌细胞的生长和增殖[15]。本研究结果显示,G-17高表达组5年复发率高于G-17低表达组(P<0.05),G-17表达升高是胃癌复发的危险因素(HR=1.568,95%CI为1.292~1.904)。董曲文等[16]的研究结果显示,随着胃癌的进展,患者G-17水平显著升高,与本研究结果一致。
HER-2是一种胞内膜蛋白,具有酪胺酸激活酶活性。在正常情况下,HER-2为非激活状态,而HER-2与特异性配体结合后,可促进肿瘤细胞的有丝分裂及分化,导致肿瘤患者病情恶化[17]。有研究结果显示,胃癌细胞的HER-2阳性表达率为7%~34%[18]。本研究中,胃癌患者肿瘤组织HER-2阳性表达率为29.35%,显著高于胃良性病变患者(5.43%)(P=0.000)。陈玲等[12]的研究结果显示,胃癌患者的肿瘤组织HER-2表达升高与胃癌根治术后复发显著相关。本研究结果显示,HER-2高表达组5年复发率高于HER-2低表达组(P<0.05),HER-2表达升高是胃癌复发的危险因素(HR=3.981,95%CI为1.504~10.538)。虽然HER-2的阳性表达率与胃癌患者术后生存时间显著相关,但单独采用HER-2评估肿瘤进展有一定的局限性,有研究发现,在不同的研究中,HER-2高表达者的胃癌发病率不同[19]。
本研究ROC曲线分析结果显示,E-Cad、G-17、HER-2单项检测与联合检测判断胃癌复发的AUC分别为0.775、0.822、0.603、0.950,提示3项指标对于胃癌复发的判断均有一定的价值,联合检测的诊断效能更高。
综上所述,E-Cad、G-17、HER-2在胃癌术后复发的预测中具有重要价值。

