幽门螺杆菌毒力基因分型与消化性溃疡患者早期肾损伤相关性研究
延喜胜,雷 磊,王 剑
(1.榆林市第一医院消化内科,陕西 榆林 718000;2.榆林市第一医院检验科,陕西 榆林 718000)
幽门螺杆菌(Helicobacter pylori,Hp)感染是人类最为常见的慢性细菌感染,与胃炎、消化性溃疡、胃癌等多种慢性胃肠道疾病有关[1]。近年来的研究结果表明,Hp感染与慢性肾脏衰竭、免疫球蛋白(immunoglobulin,Ig)A肾病、膜性肾病等肾脏疾病密切相关[2-3]。目前,Hp感染与早期肾损伤指标的关系尚不明确,Hp不同毒力基因分型与早期肾损伤的关系及其可能存在的作用机制也鲜有报道。本研究旨在分析Hp不同毒力基因与早期肾损伤的关系及其作用机制,以期为临床预防和早期治疗Hp感染相关肾损伤提供参考。
1 材料和方法
1.1 研究对象
选取2017年10月—2019年11月榆林市第一医院消化性溃疡患者504例,根据是否感染Hp分为Hp(+)组(315例)和Hp(-)组(189例)。入选标准:(1)经胃镜和病理检查确诊为消化性溃疡;(2)取胃窦部黏膜行快速尿素酶实验和13C尿素呼气试验检测,其中1项为阳性则为Hp(+),两者均为阴性判定为Hp(-);(3)年龄18~70岁;(4)临床资料完整,依从性高。排除标准:(1)近4周内服用抗Hp药物;(2)患有严重心、肺、肝、脑部疾病;(3)依从性差,临床资料不完整;(4)有胃部手术史;(5)其他原因引起的早期肾损伤,病理检查确定为肿瘤。早期肾损伤判定标准:尿视黄醇结合蛋白(retinol binding protein,RBP)>70 mg/L、尿α1-微球蛋白(alpha1-microglobulin,α1-MG)>12.5 mg/L、尿β2-微球蛋白(beta2-microglobulin,β2-MG)>3 mg/L、尿转铁蛋白(transferrin,TF)>2 mg/L中的1项或1项以上符合。另选取同期健康体检者100名作为健康对照组,均为Hp(-),肾功能正常,胃泌素17和13C尿素呼气试验检测结果均正常。
1.2 方法
1.2.1 一般资料 收集所有对象年龄、性别、体质量指数(body mass index,BMI)、消化性溃疡病程、吸烟史、酗酒史等临床资料。
1.2.2 实验室指标检测 采集所有对象空腹静脉血5 mL,同时收集晨起中段尿10 mL。总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol LDL-C)、空腹血糖(fasting blood glucose,FPG)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒购自武汉艾美捷公司,检测仪器为76002全自动生化分析仪(日本日立公司)。采用ADAMS A1c HA-8160全自动糖化血红蛋白分析仪(日本爱科来株式会社)检测糖化血红蛋白(glycated hemoglobin A1c,HbA1c)。采用A15全自动特定蛋白分析仪(西班牙BioSystems S.A.公司)及配套试剂检测尿白蛋白、尿肌酐及血清尿素(urea,Urea)。尿RBP、尿β2-MG、尿α1-MG、尿TF、血清胱抑素C(cystatin C,Cys C)试剂盒购自上海景源医疗器械有限公司,检测仪器为Mission P300特定蛋白分析仪[艾康生物技术(杭州)有限公司]。计算尿白蛋白/肌酐比值(urinary albumin creatinine ratio,UACR)。采用酶联免疫吸附试验检测高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、血清IgA1以及蚕豆凝集素(vicia vilosa lectin,VVL)与IgA1铰链区多肽中丝氨酸或苏氨酸结合N-乙酰氨基半乳糖的总结合力(以VVL-IgA1结合力表示),试剂盒均购自美国B&D公司。采用99m锝-二乙烯三胺五乙酸(99mtechnetium diethylene triamine penta-acetic acid,99mTC-DTPA)肾动态显像法检测肾小球滤过率(glomerular filtration rate,GFR)。
1.2.3 Hp基因分型检测 采用逆转录聚合酶链反应(polymerase chain reaction,PCR)检测Hp 16S rRNA,引物由上海英骏生物科技工程有限公司设计并合成。PCR引物序列和产物长度见表1。采用Trizol试剂提取总RNA,采用Prime Script逆转录试剂盒(日本TaKaRa公司)将RNA逆转录为cDNA,严格按试剂盒说明书操作,采用逆转录PCR检测Hp毒力基因cagA、vacA和babA,反应条件为30 ℃ 9 min,55 ℃39 min,产物于-80 ℃冰箱中保存待用。PCR扩增体系:10×缓冲液2.5 μL,25 mmol/L MgCl2溶液1.5 μL,2.5 mmol/L dNTP溶液2 μL,0.5 μL Tag DNA聚合酶,2 μL DNA模板,上、下游引物各1.25 μL,加双蒸水至总体积25 μL。扩增条件:94 ℃预变性3 min;92 ℃变性30 s,55 ℃退火35 s,72 ℃延伸30 s,共36个循环;72 ℃延伸4 min。每份样本重复检测3次。

表1 Hp不同毒力因子PCR引物序列和产物长度
1.3 统计学方法
采用SPSS 17.0软件进行统计分析。呈正态分布的计量资料采用±s表示,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验,2个组之间比较采用两独立样本t检验。计数资料采用例或率表示,组间比较采用χ2检验。采用多元非线性Logistic回归分析Hp感染消化性溃疡患者早期肾损伤的影响因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估相关指标诊断Hp感染消化性溃疡患者早期肾损伤的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 Hp(+)组、Hp(-)组及健康对照组一般资料比较
Hp(+)组RBP、α1-MG、β2-MG、TF、Cys C、hs-CRP、IgA1和VVL-IgA1结合力与Hp(-)组、健康对照组比较,差异均有统计学意义(P<0.05)。3个组之间年龄、性别、吸烟史、酗酒史、BMI、尿素、UACR、eGFR差异均无统计学意义(P>0.05)。见表2。

表2 Hp(+)组、Hp(-)及健康对照组一般资料比较
续表2
2.2 Hp不同毒力基因表达情况
Hp(+)组cagA、vacA、ureA阳性率分别为48.57%(153/315)、64.76%(204/315)、25.08%(79/315);HP(-)组、健康对照组cagA、vacA和ureA均为阴性。3个组Hp不同毒力基因PCR分析结果见图1。
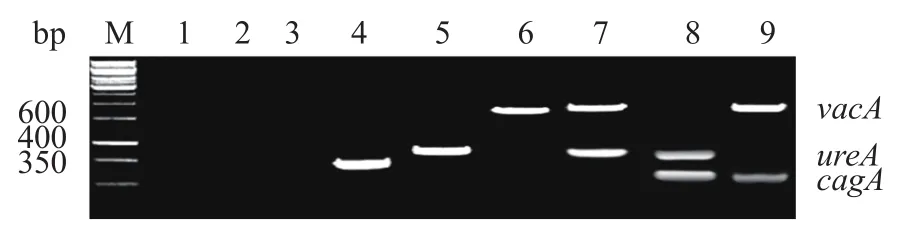
图1 3个组Hp不同毒力基因电泳图
2.3 早期肾损伤与Hp感染及毒力基因的关系
2.3.1 Hp(+)组与Hp(-)组早期肾损伤发生率比较 Hp(+)组早期肾损伤发生率为18.73%(59/315),高于Hp(-)组[7.41%(14/189)](χ2=12.227,P=0.000)。
2.3.2 Hp(+)患者早期肾损伤组与无肾损伤组Hp毒力基因比较 早期肾损伤组cagA+vacA检出率高于无肾损伤组(P<0.05),cagA、vacA、ureA检出率2个组之间差异均无统计学意义(P>0.05)。见表3。

表3 Hp(+)患者早期肾损伤组与无肾损伤组Hp毒力基因比较
2.3.3 Hp(+)患者早期肾损伤组与无肾损伤组各项指标的比较 早期肾损伤组病程、RBP、α1-MG、β2-MG、TF、Cys C、hs-CRP、IgA1和VVL-IgA1结合力均高于无肾损伤组(P<0.05),其他指标2个组之间差异均无统计学意义(P>0.05)。见表4。

表4 Hp(+)患者早期肾损伤组与无肾损伤组各项指标的比较
2.4 Hp(+)消化性溃疡患者早期肾损伤影响因素分析
以Hp感染消化性溃疡患者是否出现早期肾损伤(是为1,否为0)为自变量进行Logistic回归分析。结果显示,病程、Cys C、RBP、α1-MG、IgA1、VVL- IgA1结合力及cagA+vacA阳性表达是Hp感染消化性溃疡患者早期肾损伤的影响因素。见表5。
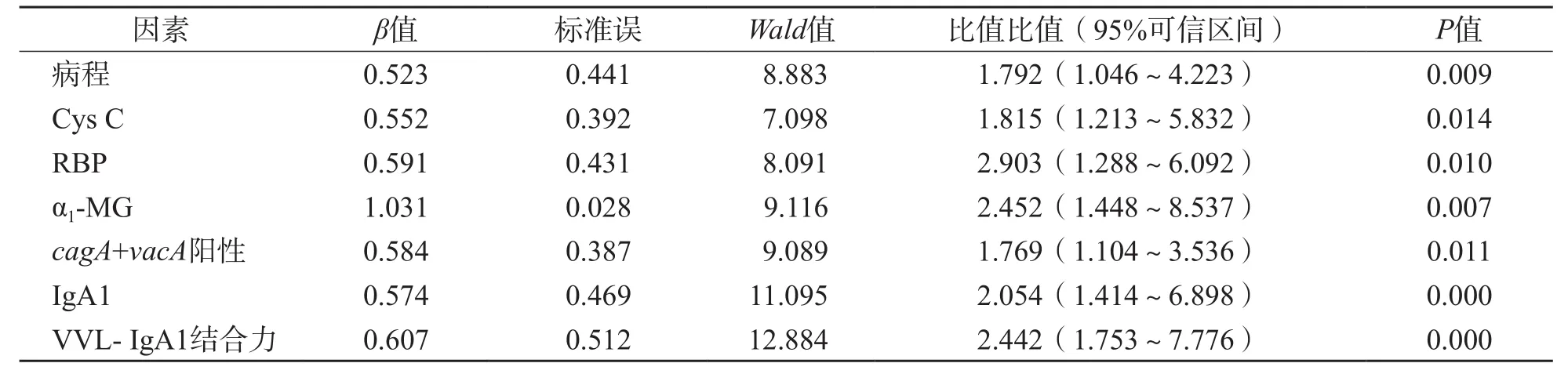
表5 Hp感染消化性溃疡患者早期肾损伤影响因素分析
2.5 各项指标诊断Hp感染消化性溃疡患者早期肾损伤的效能
以是否发生早期肾脏损伤为自变量(是为1,否为0),绘制ROC曲线,结果显示,以2.20 g/L为最佳临界值,IgA1诊断Hp感染消化性溃疡患者早期肾损伤的敏感性和特异性分别为76.99%和87.89%,曲线下面积为0.792(95%可信区间为0.684~0.866);以3.48 AU/mg为最佳临界值,VVL-IgA1结合力诊断Hp感染消化性溃疡患者早期肾损伤的敏感性和特异性分别为74.23%和89.43%,曲线下面积为0.773(95%可信区间为0.673~0.892)。见图2。
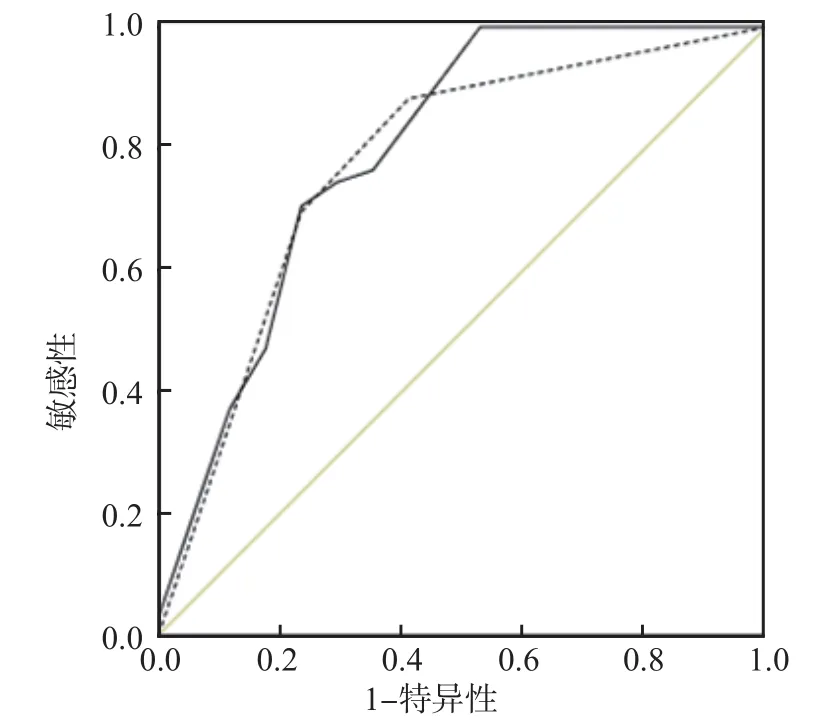
图2 IgA1、VVL-IgA1对Hp感染消化性溃疡患者早期肾损伤的诊断价值
2.6 Hp不同毒力基因分型患者肾功能指标和炎症指标比较
将59例早期肾损伤患者按照不同毒力基因分型分为cagA+vacA组(30例)和非cagA+vacA组(29例)。cagA+vacA组RBP、α1-MG、Cys C、hs-CRP、VVL-IgA1结合力与非cagA+vacA组比较,差异均有统计学意义(P<0.05),IgA1差异无统计学意义(P>0.05)。见表6。

表6 不同毒力基因分型组肾功能指标和炎症指标比较
3 讨论
Hp是一种定植于胃肠道的革兰阴性微需氧细菌,已被证实是导致多种慢性胃肠道疾病的常见致病菌,除胃肠道疾病外,Hp感染还涉及心血管疾病、呼吸系统疾病、血液病、代谢功能障碍的发生、发展[4-6]。有研究结果表明,Hp感染参与了膜性肾病、IgA肾病、紫癜性肾病等多种原发性肾脏疾病的发生、发展,Hp感染患者发生终末期肾脏疾病的风险明显高于非Hp感染患者[7]。另有研究结果表明,大多数膜性肾病患者肾小球毛细血管壁颗粒状沉积物中出现Hp阳性反应;Hp感染与糖尿病肾脏病变也存在一定的相关性[8]。提示Hp感染与早期肾脏病变的关系较为密切。但Hp感染与早期肾损伤的关系及作用机制尚不明确。本研究结果显示,Hp(+)消化性溃疡患者Urea、UACR高于Hp(-)消化性溃疡患者及健康对照者,而GFR低于Hp(-)消化性溃疡患者及健康对照者,提示Hp感染与早期肾损伤存在一定的关系,进一步提示Hp感染可能参与了早期肾脏病变的发生、发展,也证明了尽早根除Hp感染的必要性。
尽管Hp感染与早期肾损伤之间的关系已经有诸多报道,但Hp不同毒力基因与早期肾损伤之间的关系的研究尚不多见。为此本研究将Hp(+)消化性溃疡患者按是否出现早期肾损伤分为无肾损伤组和早期肾损伤组,结果显示,早期肾损伤组cagA+vacA检出率明显高于无肾损伤组(P<0.05),提示cagA+vacA共表达患者早期肾损伤可能更明显。cagA和vacA作为2个独立的致病因素在胃肠道疾病中发挥作用,cagA阳性表达可导致胃黏膜多核细胞浸润和表皮蜕变[9],而vacA阳性则会导致胃黏膜修复功能受损[10]。另有研究发现,cagA+vacA在胃溃疡、慢性浅表性胃炎及胃癌患者体内的表达量均高于单一毒力因子[11],但cagA+vacA对早期肾损伤是否较单一毒力基因更为明显尚无足够证据。本研究发现,cagA+vacA共表达患者早期肾损伤发生率明显高于单一Hp毒力因子所致的早期肾损伤患者,提示cagA+vacA共表达对疾病早期肾脏组织的损伤作用更大,这些毒力因子可表达于肾脏组织,引起早期肾脏炎症、氧化应激表达,从而导致早期肾损伤。本研究发现,cagA+vacA导致的早期肾损伤发生率可能更高,但本研究纳入的样本量不够大,2个组之间的差异不明显,后续将进行大样本量的多中心研究加以证实。
有研究发现,2型糖尿病伴有微量白蛋白尿患者Hp感染率较正常白蛋白尿患者高,提示Hp感染是导致2型糖尿病患者尿白蛋白升高的原因,其机制可能是Hp产生的具有抗原性的脂多糖介导了机体免疫反应,从而诱导体内白细胞介素-1、肿瘤坏死因子-α[12]。Hp感染会导致机体产生炎症反应,使C反应蛋白和尿白蛋白水平升高[13]。本研究发现,Hp感染患者hs-CRP、Cys C显著高于Hp阴性患者,提示Hp感染与机体炎症因子高表达有关,而炎症因子的高表达可能与肾脏早期损伤有关。为了进一步研究Hp感染消化性溃疡患者早期肾损伤与机体免疫反应之间的关系,本研究纳入了IgA1、VVL-IgA1结合力进行分析。IgA1及其免疫复合物水平在过敏性紫癜患者急性肾损伤中发挥作用,其水平越高,早期肾脏损伤越明显,可能与IgA1半乳糖水平低下有关[14]。本研究结果显示,Hp(+)消化性溃疡伴早期肾损伤患者Cys C、hs-CRP、IgA1及VVL-IgA1结合力均显著高于无肾损伤患者,提示Hp感染伴早期肾损伤与机体免疫反应有一定相关性。为了分析不同毒力基因与机体免疫反应之间的关系,本研究将59例Hp(+)伴早期肾损伤患者按cagA+vacA表达与否分为cagA+vacA组和非cagA+vacA组,结果显示,2个组UACR、GFR、Cys C、hs-CRP、VVLIgA1结合力差异均有统计学意义(P<0.05),cagA+vacA共表达患者机体炎症反应更为明显。本研究Logistic回归分析结果显示,cagA+vacA阳性表达、IgA1及VVL-IgA1结合力是Hp感染致早期肾损伤的影响因素(比值比值分别为1.769、2.054、2.442,95%可信区间分别为1.104~3.536、1.414~6.898、1.753~7.776)。ROC曲线分析结果显示,IgA1及VVL-IgA1结合力对Hp感染消化性溃疡患者早期肾损伤有一定的诊断价值,后续将进一步加大样本量,研究其在临床诊断中的作用。
本研究明确了Hp不同毒力基因分型与消化性溃疡患者早期肾损伤之间的关系,但未明确Hp感染与早期肾损伤之间的关系,Hp感染患者出现高比例早期肾损伤与不同毒力基因之间的关系及作用机制尚未阐明,且cagA+vacA是否是通过机体炎症反应导致消化性溃疡患者早期肾损伤,需要通过基础研究加以证实。此外,本研究未分析采用Hp根除法后患者早期肾损伤的发生情况,后续将进一步分析。
综上所述,部分Hp感染消化性溃疡患者会发生早期肾损伤,而cagA+vacA共表达患者早期肾损伤发生率更高,可能与炎症反应、机体免疫应答有关。

