胶体金免疫层析法快速检测CRE碳青霉烯酶效果评价
姚锂凤,郑巧平,杨 蒙,罗清琼,陈 旭,陈福祥
(上海交通大学医学院附属第九人民医院检验科,上海 200011)
近年来,多重耐药耐碳青霉烯类肠杆菌科细菌(carbapenem-resistant Enterobacteriaceae,CRE)的分离率快速升高[1-3],且可以在院内传播[4],给临床抗感染治疗和医院感染控制带来了极大挑战。产碳青霉烯酶是CRE的主要耐药机制[5],碳青霉烯酶在超广谱β-内酰胺酶的Ambler结构分类中,涉及A类(丝氨酸酶)、B类(金属β-内酰胺酶)和D类[苯唑西林酶(oxaclillinase,OXA)]。目前,全球广泛流行的是A类中的肺炎克雷伯菌碳青霉烯酶(Klebsiella pneumoniae carbapenemase,KPC)[1],B类酶中的新德里金属β-内酰胺酶(New Delhi metallo-beta-lactamase,NDM)、维罗纳亚胺培南酶(Verona imipenemase,VIM)和亚胺培南酶(imipenemase,IMP)[6-7],以及D类中的OXA酶[8]。多中心研究结果显示,我国的CRE菌株主要产KPC酶和NDM酶[9]。有研究结果显示,CRE引起的血流感染患者中,约32%在2周内死亡[10],而分析CRE的不同酶型可以为临床治疗提供依据[11]。早期检测CRE并进行酶型分析,有助于指导临床合理用药,从而提高患者感染后的生存率,并控制其院内传播。目前,用于检测碳青霉烯酶的方法有美国临床实验室标准化学会提出的标准改良Hodge试验(modified Hodge test,MHT)、改良碳青霉烯灭活试验(modified carbapenem inactivation method,mCIM)、乙二胺四乙酸改良碳青霉烯灭活试验(ethylenediaminetetraacetic acid carbapenem inactivation method,eCIM)和Carba NP实验[12],以及在此基础上衍生的Carba NP纸片检测[13]、聚合酶链反应(polymerase chain reaction,PCR)、多重实时荧光定量PCR[14]和基质辅助激光解吸电离飞行时间质谱(matrixassisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)[15]等。然而,MHT只能鉴别产酶与否,mCIM和eCIM仅能区分是否是金属酶表型,Carba NP实验则需要昂贵的蛋白抽提液,而PCR、多重实时荧光定量PCR和MALDI-TOF MS步骤繁琐,并需要相应的检测设备。胶体金免疫层析技术(gold immunochromatography assay,GICA)在过去的30年中已被广泛应用于临床检验,通过抗原与金标抗体结合为抗原抗体复合物,并利用免疫层析显色的原理进行检测,无需复杂的操作和专用设备[16-17]。本研究以PCR为参考方法来评估GICA快速检测CRE碳青霉烯酶的临床应用价值。
1 材料和方法
1.1 样本收集
收集2016年1—12月上海交通大学医学院附属第九人民医院临床分离的CRE,采用VITEK-2 Compact全自动微生物鉴定系统(法国生物梅里埃公司)进行细菌鉴定。
1.2 样本入选标准
CRE菌株根据美国疾病预防控制中心2015年公布的标准[18]进行确定:对任一碳青霉烯类不敏感的肠杆菌属,即对多利培南、美罗培南或亚胺培南的最小抑菌浓度(minimum inhibitory concentration,MIC)≥4 mg/L,或者对厄他培南的MIC≥2 mg/L,又或者是被证实为产生碳青霉烯酶的肠杆菌。收集的CRE菌株保存于含30%甘油的营养肉汤中,置-80 ℃冰箱内保存。菌株复苏时挑取1环至血平板上培养,第2天再次挑取单个菌落纯化、分离得到复苏的菌株。
1.3 方法
1.3.1 PCR扩增碳青霉烯酶型基因 采用简化碱裂解法提取细菌的DNA作为模板,碳青霉烯酶基因blaKPC、blaNDM、blaIMP、blaOXA和blaVIM的引物序列[19]见表1,引物由生工生物工程(上海)股份有限公司合成,采用美国ABI公司GeneAmp 9700 PCR仪进行PCR扩增。反应条件:95 ℃5 min;95℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,共25个循环;72 ℃延伸10 min。扩增产物用上海天能公司Tanon EPS600电泳仪进行凝胶电泳后,于Tanon 3500凝胶成像仪上观察结果。PCR扩增阳性产物送至生工生物工程(上海)股份有限公司进行测序,测序结果于https://blast.ncbi.nlm.nih.gov查询验证为相应基因后,作为阳性质控,每批PCR均设置阴性、阳性对照进行质量控制。

表1 5种主要碳青霉烯酶基因的PCR引物序列
1.3.2 GICA检测碳青霉烯酶 按免疫显色试剂说明书进行检测,试剂购自北京金山川科技发展有限公司,具体操作步骤为:(1)准备1个无菌Eppendorf管,滴加10滴样本处理液;(2)复苏保存于-80 ℃冰箱的实验菌株,挑取复苏后的单个菌落再次纯化、分离,用一次性细菌环蘸取纯化、分离后的1个克隆菌株,并将该接种环插入含有样本处理液的无菌Eppendorf管;(3)充分搅拌,使溶液均匀;(4)取50 μL稀释后的样本加至检测卡的加样孔处;(5)等待10 min后读取结果。结果判读:出现2个条带(检测条带和对照条带)表明检测结果为阳性;仅出现1个对照条带表明检测结果为阴性;若对照条带未出现,则说明该检测无效,应重新检测。质量控制:质控线(C线)为内部质控,质控线不显色,结果无效。
1.4 统计学方法
采用SPSS 24.0软件对进行统计分析。计数资料以例或率表示。
2 结果
2.1 菌株鉴定结果
共收集到CRE菌株73株,包括64株肺炎克雷伯菌、5株阴沟肠杆菌、2株大肠埃希菌、1株产酸克雷伯菌、1株弗劳地枸橼酸杆菌。
2.2 酶型基因PCR检测结果
73株CRE经酶型基因PCR分析,检出51株blaKPC阳性、19株blaNDM阳性、2株blaIMP阳性菌、1株blaVIM阳性菌株,未检出blaOXA阳性菌株。PCR产物部分电泳结果见图1。
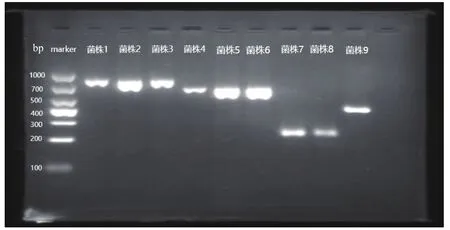
图1 部分PCR产物电泳图
2.3 GICA检测结果
73株CRE GICA检测结果显示,blaKPC阳性样本为51例,blaNDM阳性样本为19例,blaIMP阳性样本为2例,blaVIM阳性样本为1例,与酶型基因PCR检测结果一致性为100%。部分碳青霉烯酶类型GICA检测结果见图2。
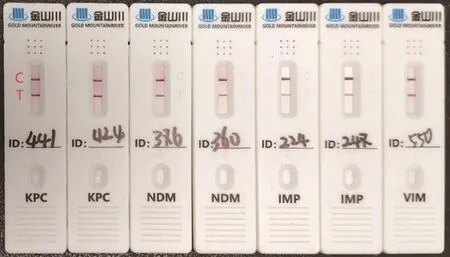
图2 部分CRE菌株GICA检测结果
2.4 GICA与酶型基因PCR鉴定结果比较
将GICA与酶型基因PCR鉴定的blaKPC、blaNDM、blaIMP和blaVIM阳性的结果进行比较,以酶型基因PCR检测结果作为检测碳青霉烯酶类型的参考方法,结果显示,GICA检测CRE产KPC酶、NDM酶、IMP酶及VIM酶的准确性均为100%。
3 讨论
碳青霉烯类作为对超广谱β-内酰胺酶具有较高稳定性的非典型β-内酰胺类抗菌药物,已经成为治疗严重细菌感染的主要药物[20],而碳青霉烯酶对其具有极高的水解活性,这使得临床治疗CRE感染面临严峻挑战,最终导致了较高的病死率[21]。我国耐药监测网2020年发布的报告显示,肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%上升到了2018年的25.0%和26.3%,耐药率上升超过8倍[22],所以快速检测碳青霉烯酶对早期监测CRE并预防其传播具有重要意义。普通PCR检测基因是目前用于确定碳青霉烯酶酶型的金标准,但PCR检测过程中需要菌株纯化及DNA提取,平均鉴定时间约20 h,而GICA无需菌株DNA提取,挑取单个菌落后仅需10 min便可读取结果,在检测的时间上具有非常大的优势。作为一种常用的检测方法,GICA具有快速、便捷和直观的特点,可以通过直接读取结果来分辨KPC、IMP、NDM、VIM和OXA 5个CRE的主要酶型,可在鉴定产酶的同时对菌株产酶类型进行分析,尽早确认临床感染,指导临床用药。
本研究共收集到73株CRE,PCR酶型基因检测结果为blaKPC阳性51株、blaNDM阳性19株、blaIMP阳性菌2株、blaVIM阳性菌株1株,未检出blaOXA阳性菌株。以PCR检测结果作为检测碳青霉烯酶类型的参考方法,GICA检测CRE产KPC酶、NDM酶、IMP酶、VIM酶的准确性均为100%。但由于GICA涉及的酶型亚型的局限性,只能检测IMP-4,OXA-23和OXA-48型酶,对于IMP和OXA的其他亚型酶无法检测,会造成假阴性的结果[16]。另一方面,本研究中blaIMP、blaVIM及blaOXA阳性菌株较少,具有一定的局限性,后续将扩大样本量,进一步评估GICA的其他诊断学参数。
综上所述,GICA不仅可以快速检测碳青霉烯酶,还可以对酶型进行快速鉴定,步骤简单、结果直观,具有较好的临床应用前景,可作为酶型确定和耐药监测的重要方法,为医院感染控制和指导治疗提供实验室证据。
致谢:衷心感谢上海交通大学医学院附属第九人民医院检验科微生物室王院霞老师、唐毅老师、虞中敏老师、方敏老师和孙康德老师在临床菌种收集方面提供帮助。

