醋酸泼尼松对糖尿病肾病模型大鼠肾功能、肾脏炎性反应及AMPK/SIRT1信号通路的影响
邓九红,郑 超,王声遥,王心怡
(1.温州医科大学第二临床医学院, 浙江 温州 325035; 2.平阳县第二人民医院 内分泌科,浙江 平阳 325405)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最严重微血管病变之一,约占糖尿病患者的40%,也是导致终末期肾脏疾病的主要原因[1-2]。DN的病因复杂,肾脏炎性反应在促进DN的发展进程中至关重要[3]。目前,临床仍缺乏有效的药物来预防和治疗DN。醋酸泼尼松是肾上腺皮质激素类药,具有显著的抗炎作用,主要用于过敏性与自身免疫性炎性疾病[4]。近年来,醋酸泼尼松片治疗狼疮性肾炎[5]、肾病综合征[6]、特发性膜性肾病[7]疗效确切,可有效减轻病情程度,说明醋酸泼尼松片可减轻肾脏炎性反应,但其对DN是否具有药理活性却鲜有报道。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)/沉默信息调节因子1(silent information regulator 1,SIRT1)信号通路是重要的能量传感信号传导途径,在糖尿病中具有调控作用[3];AMPK失活和SIRT1水平降低与DN的进展有关,激活AMPK和SIRT1对降低氧化应激和炎性反应,保护DN小鼠肾损伤,降低蛋白尿有重要作用[8]。因此,本研究拟采用DN大鼠模型,探究醋酸泼尼松对DN大鼠肾脏炎性反应的影响及可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级SD雄性大鼠70只,6~8周龄,体质量(200±20)g[温州医科大学实验动物中心,动物生产许可证号为SCXK(浙)2019-0009]。大鼠适应性饲养1周后开始实验。
1.1.2 主要药品、试剂:醋酸泼尼松片(天津药业集团新郑股份有限公司,规格:5 mg);链脲佐菌素(streptozotocin,STZ)(Sigma公司);AMPK抑制剂compound C(CC,TargetMo公司);空腹血糖(fasting blood glucose,FBG)、尿微量白蛋白(urine microalbumin,U-mAlb)、血肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN)检测试剂盒(南京建成生物工程研究所);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(武汉贝茵莱生物科技有限公司);苏木精-伊红(hematoxylin eosin,HE)染色试剂、高碘酸-希夫(periodate schiff,PAS)染色试剂、放射免疫沉淀试验(radioimmunoprecipitation assay,RIPA)裂解液和二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(碧云天生物科技公司);兔源AMPK、磷酸化AMPK(phosphorylated AMPK,p-AMPK)、SIRT1、乙酰化核因子-κB p65(acetylated nuclear factor-κB p65,ac-NF-κB p65)、核因子-κB p65(nuclear factor-κB p65,NF-κB p65)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、β-肌动蛋白(β-actin)一抗和山羊抗兔二抗(英国Abcam公司)。
1.2 方法
1.2.1 大鼠的分组及处理:将大鼠分为对照组,喂以普通饲料。其余大鼠给予高糖高脂饲料喂养4周联合1次性腹腔注射STZ(55 mg/kg)成功制备DN模型[9]。模型判断标准:连续3 d大鼠FBG>16.7 mmol/L,且出现典型的“三多一少”(即多食多饮多尿,体质量减少)表现,连续3次U-mAlb>15 μg/mL,且病理学检查发现肾组织出现明显病变(表现为肾小管管腔变大,肾小球体积变小,系膜细胞增生,基底膜增厚,大量炎性细胞浸润)。成功造模48只大鼠,将造模成功的大鼠随机分为模型组、醋酸泼尼松低(6.25 mg/kg)、高(12.5 mg/kg)剂量组、醋酸泼尼松+CC组(醋酸泼尼松12.5 mg/kg+compound C 0.2 mg/kg)[10],每组12只。分组完成后于给药前收集大鼠24 h尿液检测了U-mAlb水平,并通过尾末梢采血检测了FBG水平以及经过眼眶静脉丛取血检测了血清SCr、BUN水平,结果显示模型大鼠U-mAlb、FBG、SCr、BUN水平均较对照组显著升高(P<0.05),说明分组均匀。
分组完成后,醋酸泼尼松各剂量组分别给予相应剂量的醋酸泼尼松灌胃,醋酸泼尼松+CC组大鼠在给予醋酸泼尼松灌胃的同时腹腔注射0.2 mg/kg的compound C,对照组和模型组灌胃等量的蒸馏水,1次/d,灌胃体积10 mL/kg,共给药4周。醋酸泼尼松给药剂量根据其临床剂量(60 kg成人给药剂量60 mg/d),按种属间体表面积换算,大鼠对应给药剂量为成人的6.25倍,换算大鼠等效剂量为6.25 mg/kg,因此,设置醋酸泼尼松低、高剂量为6.25、12.5 mg/kg。
1.2.2 大鼠一般状态观察及FBG、24 h U-mAlb的检测:实验过程中观察大鼠的毛色、饮食饮水量、尿量、体质量等一般状态;采集尾末梢全血,检测给药结束后大鼠FBG水平;并在给药结束后通过代谢笼收集大鼠24 h尿液,检测大鼠尿液24 h U-mAlb含量。
1.2.3 大鼠血清SCr、BUN和炎性因子水平的检测:实验结束时,戊巴比妥钠腹腔注射麻醉大鼠后,打开腹腔,腹主动脉取血,分离血清,检测大鼠血清SCr、BUN、IL-1β、IL-6和TNF-α水平。
1.2.4 肾脏组织病理形态学变化的检测:取大鼠右侧肾组织,于4%多聚甲醛中固定,乙醇梯度脱水,石蜡包埋,切片,进行HE和PAS染色,观察肾脏病理学变化。
1.2.5 蛋白免疫印迹法检测肾组织AMPK/SIRT1信号通路相关蛋白的表达:取大鼠部分肾组织,在含有蛋白酶抑制剂的RIPA裂解液中匀浆,以20 000 r/min的速度在4 ℃离心10 min。取上清,BCA法进行蛋白定量,RIPA平衡蛋白浓度后加热变性,然后取等量蛋白样品上样(30 μg),凝胶电泳分离,湿转法转膜,5%脱脂奶封闭膜1 h,随后在4 ℃下与一抗(AMPK、p-AMPK、SIRT1、ac-NF-κB p65、NF-κB p65、MCP-1、β-actin,按1∶1 000的比例稀释;β-actin按1∶2 000的比例稀释)孵育过夜,第2天加入二抗室温下孵育2 h,洗去二抗,ECL显色,以β-actin为内参,分析膜上蛋白表达水平。
1.3 统计学分析
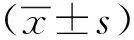
2 结果
2.1 大鼠一般状态
对照组大鼠精神良好,活跃度高,毛色有光泽,饮食正常,垫料干燥;模型组大鼠出现不同程度的精神萎靡,活动减少,毛色发黄无光泽,进食和饮水量明显增多,尿量也增多,垫料潮湿,大便糖稀状;给药结束后,醋酸泼尼松低、高剂量组大鼠上述症状较模型组大鼠明显好转,而醋酸泼尼松+CC组大鼠一般状态较醋酸泼尼松高剂量组有加重趋势。
2.2 各组大鼠FBG和肾功能指标的变化
与对照组相比,模型组大鼠FBG、24 h U-mAlb、血清SCr、BUN水平显著升高(P<0.05);与模型组相比,醋酸泼尼松低、高剂量组大鼠FBG、24 h U-mAlb、血清SCr、BUN水平显著降低(P<0.05);与醋酸泼尼松高剂量组相比,醋酸泼尼松+CC组大鼠上述指标显著升高(P<0.05)(表1)。

表1 各组大鼠FBG和肾功能指标的比较Table 1 Comparison of FBG and renal function indexes of rats in each group n=12)
2.3 各组大鼠血清炎性因子水平
与对照组相比,模型组大鼠血清IL-1β、IL-6和TNF-α水平显著升高(P<0.05);与模型组相比,醋酸泼尼松低、高剂量组大鼠血清IL-1β、IL-6和TNF-α水平显著降低(P<0.05);与醋酸泼尼松高剂量组相比,醋酸泼尼松+CC组大鼠上述指标显著升高(P<0.05)(表2)。

表2 各组大鼠血清炎性因子水平比较Table 2 Comparison of serum inflammatory factor levels of rats in each pg/mL, n=12)
2.4 各组大鼠肾组织病理学变化
对照组大鼠肾组织染色均匀,结构清晰,肾小球、肾小管形态正常,肾小管上皮细胞排列整齐,未见炎性细胞浸润;模型组大鼠肾小管-肾间质出现局灶性病变,肾小管管腔变大,空泡化明显,胞质染色变浅,肾小球体积变小,肾小管上皮细胞核固缩,大量炎性细胞浸润,肾小球系膜细胞增生,系膜区扩大,基底膜增厚;醋酸泼尼松低、高剂量组大鼠上述肾脏病变情况明显改善,炎性细胞浸润、系膜细胞和基质增生减轻,肾小管扩张数量减少,且醋酸泼尼松高剂量组改善效果较优;而醋酸泼尼松+CC组大鼠肾脏病变较醋酸泼尼松高剂量组有加重趋势(图1)。

A.control group; B.model group; C.prednisone acetate low dose group; D.prednisone acetate high dose group; E.prednisone acetate+CC group图1 各组大鼠肾组织病理学变化Fig 1 Renal histopathological changes of rats in each group (HE and PAS staining)
2.5 各组大鼠肾组织AMPK/SIRT1信号通路相关蛋白表达
与对照组相比,模型组大鼠肾组织p-AMPK/AMPK、SIRT1蛋白表达显著降低,ac-NF-κB p65/NF-κB p65和MCP-1蛋白表达显著升高(P<0.05);与模型组相比,醋酸泼尼松低、高剂量组大鼠肾组织p-AMPK/AMPK、SIRT1蛋白表达显著升高,ac-NF-κB p65/NF-κB p65和MCP-1蛋白表达显著降低(P<0.05);与醋酸泼尼松高剂量组相比,醋酸泼尼松+CC组大鼠肾组织p-AMPK/AMPK、SIRT1蛋白表达显著降低,ac-NF-κB p65/NF-κB p65和MCP-1蛋白表达显著升高(P<0.05)(图2,表3)。

1.control group; 2.model group; 3.prednisone acetate low dose group; 4.prednisone acetate high dose group; 5.prednisone acetate+CC group图2 各组大鼠肾组织AMPK/SIRT1信号通路相关蛋白的表达Fig 2 Expression of AMPK/SIRT1 pathway related proteins in renal tissue of rats in each group

表3 各组大鼠肾组织AMPK/SIRT1信号通路相关蛋白表达比较Table 3 Comparison of AMPK/SIRT1 signal pathway related protein expression in renal tissue of rats in each group n=12)
3 讨论
糖尿病产生的高血糖状态会刺激趋化因子的产生,随后介导白细胞进入肾组织产生炎性反应,促进DN的发生发展,因此靶向炎性反应是防治DN发展的有效途径[11]。
高血糖可以触发NF-κB,NF-κB p65活化进入细胞核后可激活转录,诱导下游多种细胞因子的转录,如MCP-1、TNF-α和白介素系统(IL-6、IL-1β)[12]。醋酸泼尼松是强效的免疫抑制剂和抗炎药,被广泛用于过敏性与自身免疫性炎性疾病的治疗[4];其对肾炎具有显著的改善作用,可有效改善肾病综合征患者肾功能、血脂水平,并降低尿蛋白含量[5-7]。在本次研究中,采用高糖高脂饲料联合STZ腹腔注射成功建立DN大鼠模型,肾功能损伤严重;而醋酸泼尼松干预后可明显减轻DN大鼠的肾功能损伤,使大鼠血清TNF-α、IL-6、IL-1β和MCP-1蛋白水平降低。
AMPK是一种对能量高度敏感的丝氨酸/苏氨酸激酶,与糖尿病密切相关[13]。SIRT1是AMPK的下游效应分子,是一种依赖NAD+的脱乙酰酶,它通过使目标分子脱乙酰化而激发转录因子的抑制活性,抑制与炎性有关的基因的转录,参与炎性反应的调节。研究表明,NF-κB p65亚单位上310位赖氨酸(Lys)的乙酰化修饰水平与NF-κB的活性有明显的正相关性[14]。AMPK磷酸化后可激活SIRT1,而SIRT1可将p65蛋白的Lys310位点去乙酰化,减弱NF-κB p65的转录激活能力[15]。本研究结果显示,DN大鼠肾组织中AMPK/SIRT1通路失活。经醋酸泼尼松干预后,肾组织p-AMPK/AMPK、SIRT1蛋白表达升高,ac-NF-κB p65/NF-κB p65和MCP-1蛋白表达降低;说明AMPK/SIRT1通路被激活;而AMPK抑制剂compound C可明显减弱醋酸泼尼松对AMPK/SIRT1通路的激活作用;提示,醋酸泼尼松可能通过激活AMPK/SIRT1通路,抑制NF-κB活化。
综上所述,醋酸泼尼松可减轻DN大鼠肾脏炎性反应,保护肾功能,其作用机制可能与激活AMPK/SIRT1通路,进而抑制NF-κB的激活有关。本研究仅从炎性反应的角度探究了醋酸泼尼松对DN的保护机制,然而,在DN中,除炎性反应外,其他机制(如氧化应激和自噬)与肾功能损伤密切相关,醋酸泼尼松能否通过影响氧化应激或自噬保护肾功能,有待进一步研究。

