HPLC-MS/MS法测定不同产地千里光中千里光菲灵碱的含量
张石宇 唐成林 林昶 宋信莉 刘英 张恩 石洪州 丁秦


摘要 [目的]测定不同产地11批千里光中千里光菲灵碱的含量。[方法]采用高效液相色谱-质谱联用(HPLC-MS/MS)法进行检测。色谱柱为ACE Excel 3 C 18-PFP (4.6 mm×150 mm,3 μm),流动相为0.1%甲酸乙腈-0.1%甲酸水,梯度洗脱;柱温40 ℃,流速0.6mL/min;质谱采用电喷雾(ESI)离子源,正离子模式,多反应监测(MRM)的扫描方式进行检测。[结果]该方法线性关系良好,精密度、重复性和稳定性良好,加样回收率在96.90%~102.13%,RSD为1.16%~1.48%,该方法符合方法学考察要求;11批千里光药材中千里光菲灵碱含量为0.069 6~0.811 1 μg/g。[结论]该研究建立的方法稳定可行,可用于千里光中千里光菲灵碱含量的测定,为中药千里光的质量控制提供新参考。
关键词 千里光;千里光菲灵碱;HPLC-MS/MS;不同产地;含量测定
中图分类号 R 284.1文献标识码 A
文章编号 0517-6611(2022)02-0202-04
doi:10.3969/j.issn.0517-6611.2022.02.055
开放科学(资源服务)标识码(OSID):
Determination of Seneciphylline in Senecio scandens from Different Origins Based on HPLC-MS/MS
ZHANG Shi-yu1,TANG Cheng-lin2,LIN Chang3,4 et al (1.The First Affiliated Hospital of Guizhou University of TCM,Guiyang,Guizhou 550001; 2.Guizhou General Station of Crop Technology Extension,Guiyang,Guizhou 550001; 3.College of Pharmacy,Guizhou University of TCM,Guiyang,Guizhou 5500253;4.Research Center of TCM under Forest of Guizhou University of TCM,Guiyang,Guizhou 550025)
Abstract [Objective]To determine the seneciphylline content in 11 batches of Senecio scandens from different origins.[Method]The method of high performance liquid chromatography-mass spectrometry (HPLC-MS/MS) was used for detection.Ace excel 3 C 18-PFP (4.6 mm×150 mm,3 μm) was used as the chromatographic column,and the mobile phase was 0.1% formic acid acetonitrile -0.1% formic acid water with gradient elution.Column temperature 40 ℃,flow rate 0.6mL/min.Mass spectrometry was detected by electrospray ionization (ESI),positive ion mode and multiple reaction monitoring (MRM).[Result]The method had good linear relationship,precision,repeatability and stability,and the recovery rate was 96.90%-102.13%,RSD was 1.16%-1.48%,which met the requirements of methodological investigation.The content of seneciphylline in 11 batches of Senecio scandens was 0.069 6-0.811 1 μg/g.[Conclusion]The method established in this study is stable and feasible,and can be used for the determination of seneciphylline content in Senecio scandens,providing a new reference for the quality control of Senecio scandens.
Key words Senecio scandens;Seneciphylline; HPLC-MS/MS; Different origins; Content determination
基金項目 贵州省农业农村厅项目“中药材生产技术标准制定”(XATH(GZ)2020/042号);贵州省教育厅青年科技人才成长项目(黔教合KY字〔2022〕259号);贵州省特色功能食品与中药制剂开发攻关大平台(黔教合KY字〔2020〕006)。
作者简介 张石宇(1987—),女,贵州遵义人,主管中药师,硕士,从事中药毒理与药物代谢研究。*通信作者,农艺师,硕士,从事中药材规范化种植技术及推广方面的研究。
收稿日期 2021-05-26;修回日期 2021-07-02
千里光为菊科植物千里光(Senecio scandens Buch.-Ham.)的干燥地上部分[1]。千里光原名千里及,别名九里明、九龙光、黄花草、九岭光、蒲儿根、一扫光等,始载于《本草拾遗》,主要分布于我国华东、中南及西南各地,常见于山地林边、灌木草丛和路边,夏秋采收,是应用历史悠久的常用中药之一[2]。千里光具有清热解毒、明目、利湿的功效,常用于治疗痈肿疮毒、感冒发热、目赤肿痛、泄泻痢疾、皮肤湿疹等。近年来研究发现,千里光中含有多种肝毒性吡咯里西啶生物碱(PAs),包括阿多尼弗林碱、千里光碱、千里光菲灵碱、克氏千里光碱等[3-5]。PAs可通过传统草药、茶剂、谷物或奶制品、肉类等食物链的传递被人类摄食,经肝脏细胞色素P450酶代谢活化形成亲电性中间体后,与体内生物大分子如蛋白质结合,形成吡咯蛋白加合物(pyrrole-protein adducts,PPA),与体内DNA结合,形成吡咯DNA加合物(pyrrole-DNA adducts,PDA),进而诱导肝脏肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome,HSOS),致严重的肝毒性[6-7]。此外,PAs还具有显著的肺脏毒性、遗传毒性、神经毒性和胚胎毒性等[8-9]。因此含PAs的中药一直是世界卫生组织(WHO)等国际组织及国家严密监控的对象。
2020年版《中国药典》规定了千里光药材中阿多尼弗林碱的含量限度,不得超过0.004%[1],然而对其他吡咯里西啶生物碱类均未作规定。千里光菲灵碱是千里光中的主要吡咯里西啶类生物碱之一,有研究报道,额河千里光中千里光菲灵碱的含量为0.055 7%,超过了千里光碱和全缘千里光碱在额河千里光中的含量[10]。千里光菲灵碱是一种具有十二元大环二酯-倒千里光碱类型的PAs,属于最具肝毒性的PAs[7]。Hincks等[11]研究表明,与其他PAs相比,千里光菲灵碱可以在体外产生更多的PDA。韩佳寅等[12]研究表明,千里光菲灵碱浓度在12.5 ~100 μg/mL时,可在体外致小鼠胚胎毒性。Wang等[13]报道,千里光菲灵碱浓度为5~50 μmol/L时,可通过激活线粒体介导的小鼠和原代肝细胞凋亡诱导其肝毒性。很多研究表明,千里光菲灵碱毒性比其他PAs更大[14-16]。因此,笔者建立了千里光中千里光菲灵碱的含量测定方法,对来源不同产地的11批千里光药材进行分析与比较,以明确其安全性,为其临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 仪器。FW100型高速粉碎机(泰斯特仪器有限公司);SB-5200DT型超声机(宁波新芝生物科技股份有限公司);QL-901型涡旋混合器(江苏海门市麒麟医用仪器厂);AE240型電子天平(梅特勒-托利多仪器上海有限公司);美国AB 5500 Q TRAP 质谱仪(Applied Biosystems公司)。
1.1.2 药品与试剂。千里光菲灵碱(纯度≥99%,成都德斯特生物技术有限公司,批号DST200910-125);乙腈、甲醇和甲酸(质谱级别,德国Merck公司);水为娃哈哈纯净水。
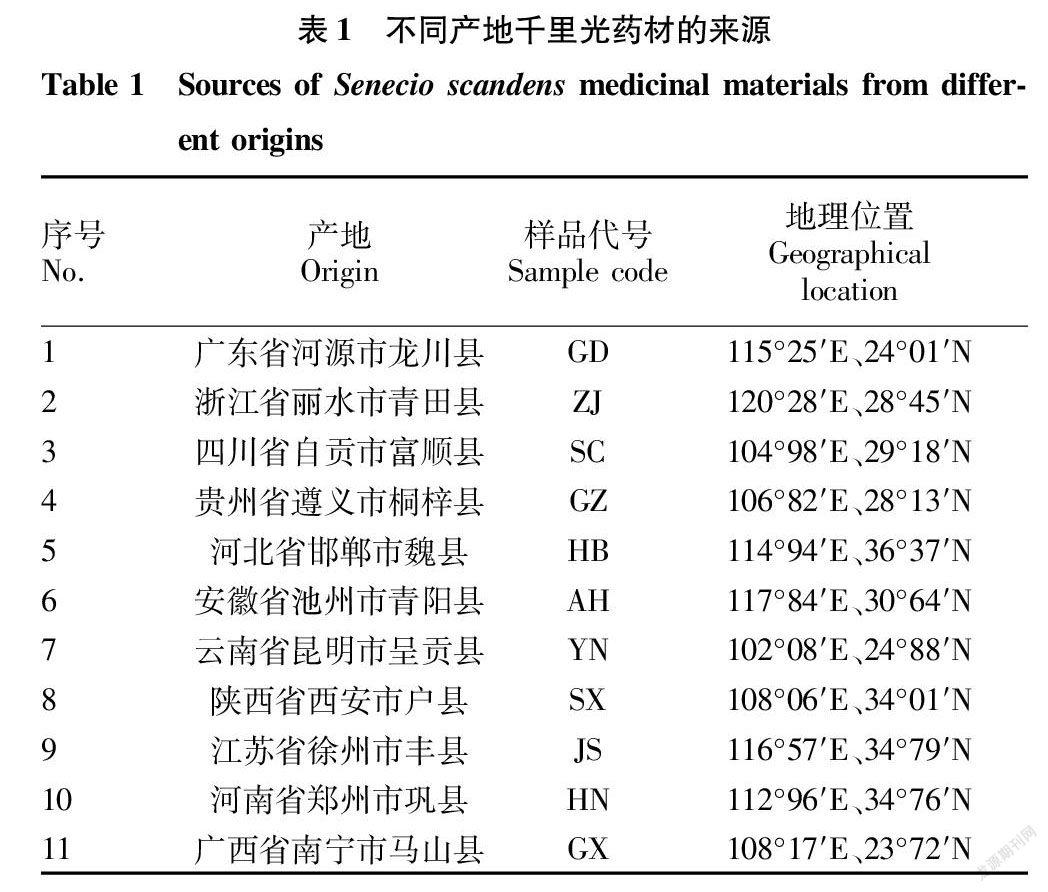
1.1.3 药材。试验用药材为来自11个产地的千里光样品,经贵州中医药大学药学院中药鉴定教研室孙庆文教授鉴定为菊科植物千里光(Senecio scandens Buch.-Ham.)的干燥地上部分。各样品来源及编号详见表1。
1.2 方法
1.2.1 溶液的制备。
1.2.1.1 对照品溶液的制备。取千里光菲灵碱对照品适量,精密称定,加0.5%甲酸溶液配制成每l mL含0.1 μg的溶液,即得千里光菲灵碱的对照品溶液,4 ℃保存备用。
1.2.1.2 供试品溶液的制备。分别取11批千里光药材的粉末(过三号筛)约0.2 g,精密称定,置具塞锥形瓶中,精密加入0.5%甲酸溶液25mL,称定重量,超声处理(功率250 W,频率40 kHz)40 min,放冷,再称定重量,用0.5%甲酸溶液补足减失的重量,摇匀,滤过,取续滤液,经0.25 μm微孔滤膜过滤,续滤液即为供试品溶液。
1.2.2 液质联用条件。
1.2.2.1 色谱条件。色谱柱为ACE Excel 3 C 18-PFP(4.6 mm×150 mm,3 μm);流速0.6mL/min;柱温40 ℃;进样量 20 μL;流动相为0.1%甲酸乙腈(B)-0.1%甲酸水溶液(A),梯度洗脱(0~2 min,5%~5%B;2~6 min,5%~90%B;6~8 min,90%~90%B;8~9 min,90%~5%B;9~11 min,5%~5%B)。
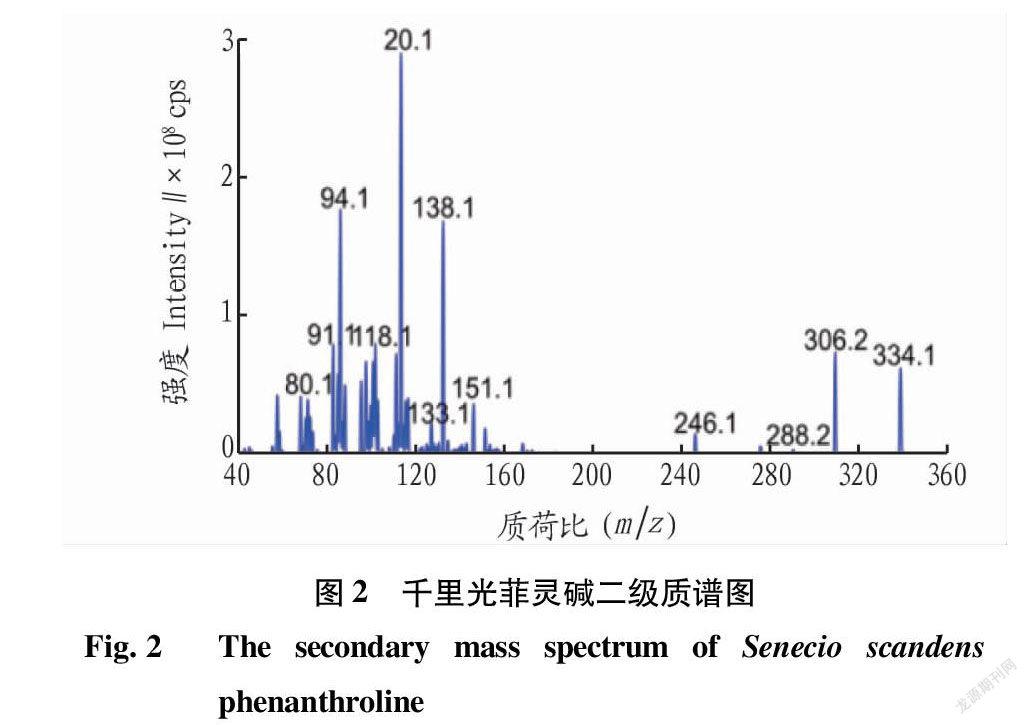
1.2.2.2 质谱条件。离子源为ESI源;检测模式为正离子模式;喷雾电压5 500 V;碰撞气为N 2;雾化温度550 ℃;雾化气379.2 kPa;辅助气379.2 kPa;去簇电压70 eV;碰撞电压38 eV;射入电压10 eV,扫描方式为多反应检测(MRM)。为了得到千里光菲灵碱的结构信息,该研究采用Q-Trap质谱上的IDA(information-dependent acquisition)标准触发的EPI(enhanced product ion)扫描对目标化合物进行二级碎片分析。EPI扫描选择在正离子模式下,扫描范围为m/z 50~400。
1.2.3 方法学考察。
1.2.3.1 系统适应性试验。分别吸取空白溶剂、对照品溶液和供试品溶液各20 μL,在“1.2.2”液质联用条件下进行测定,记录色谱图,考察系统适应性。
1.2.3.2 标准曲线的绘制。分别精密吸取千里光菲灵碱对照品溶液适量,用0.5%甲酸稀释成质量浓度分别为0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0、500.0和1 000.0 ng/mL的系列对照品溶液。吸取各对照品溶液20 μL,按“1.2.2”液质联用条件分别进样分析。以质量浓度(ng/mL)为横坐标、峰面积积分值为纵坐标绘制标准曲线。
1.2.3.3 精密度试验。精密吸取20 ng/mL千里光菲灵碱对照品溶液20 μL,按“1.2.2”液质联用条件连续进样6次,测定千里光菲灵碱的峰面积,计算其RSD值。
1.2.3.4 重复性试验。取同一批号千里光药材粉末,按“1.2.1.2”方法分别制备6份供试品溶液,按“1.2.2”液质联用条件进样分析,测定千里光菲灵碱的含量,计算其RSD值。
1.2.3.5 稳定性试验。取同一批浙江千里光药材粉末,按“1.2.1.2”方法制备供试品溶液,分別于0、2、4、8、12、24 h,按“1.2.2”液质联用条件进样分析,测定千里光菲灵碱的含量,计算其RSD值。
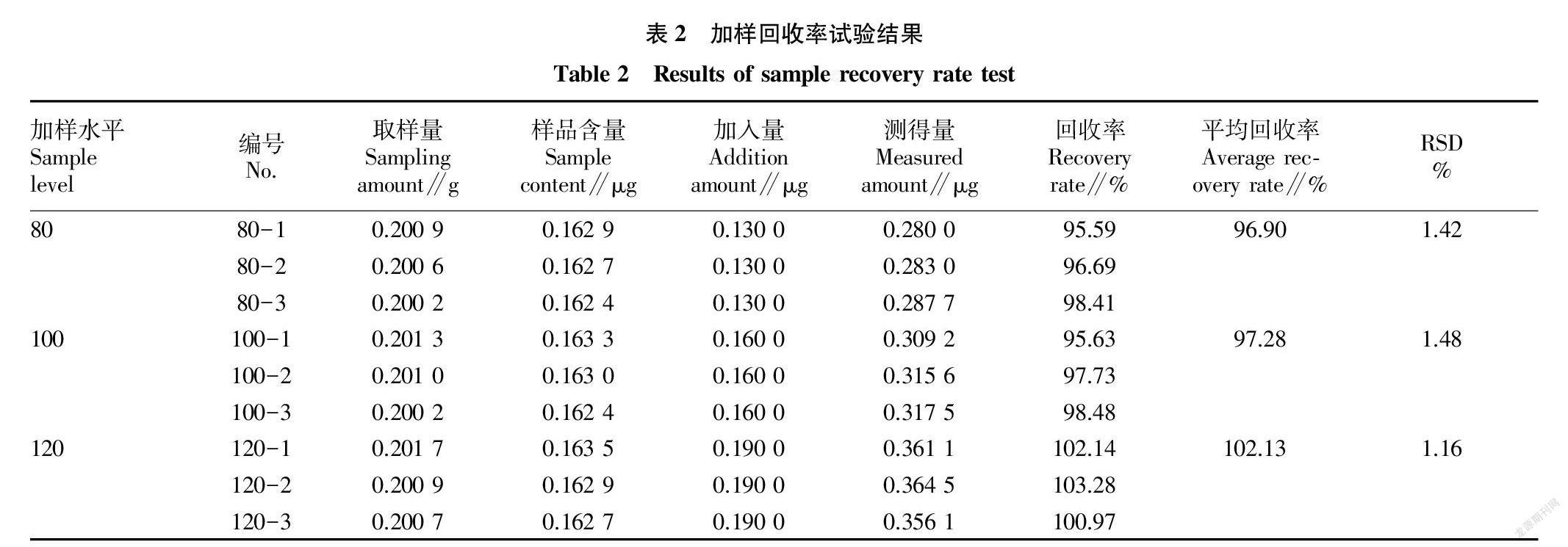
1.2.3.6 加样回收率试验。分别称取已测定含量的浙江千里光药材粉末0.2 g,共9份,精密称定,按80%、100%、120%比例分别加入千里光菲灵碱对照品适量,再按照“1.2.1.2”方法制备供试品溶液,按照“1.2.2”液质联用条件进样分析,测加样回收率,计算RSD值。
1.2.4 千里光菲灵碱含量的测定。取11个产地的11批千里光药材样品各3份,每份0.2 g,精密称定,分别按“1.2.1.2”方法制备供试品溶液,再按照“1.2.2”液质联用条件进样,测定峰面积并计算千里光菲灵碱含量。
2 结果与分析
2.1 方法学考察
2.1.1 系统适应性试验。试验对千里光菲灵碱的离子对(m/z)334/120进行检测,所得对照品、供试品和空白溶剂总离子流色谱图如图1所示,结果表明对照品和供试品溶液中千里光菲灵碱的保留时间均为7.1 min,空白溶剂在7.1 min时无出峰,证明该方法专属性良好。且供试品所测定主峰旁边无明显杂峰,经计算样品与其他组分峰的分离度>1.5,理论塔板数按千里光菲灵碱计算不低于4 000,符合药典测定要求。试验采用Q-Trap质谱对目标化合物进行二级碎片分析,EPI扫描选择在正离子模式下,扫描范围为m/z 50~400,得到的二级质谱图如图2所示。
2.1.2 标准曲线的绘制。按“1.2.3.2”方法操作,以质量浓度(ng/mL)为横坐标、峰面积积分值为纵坐标绘制标准曲线,得出回归方程为y=76 742x-13 277(R2=1),结果表明,千里
光菲灵碱在质量浓度0.5~1 000.0 ng/mL线性关系良好。
2.1.3 精密度试验。按“1.2.3.3”方法操作,连续进样6次,测定千里光菲灵碱的峰面积,计算其RSD为2.19%,表明仪器精密度良好。
2.1.4 重复性试验。按“1.2.3.4”方法操作,分别进样平行样6份,测定千里光菲灵碱的含量,计算其RSD为1.74%,表明该方法重复性良好。
2.1.5 稳定性试验。按“1.2.3.5”方法操作,测定千里光菲灵碱的含量,计算其RSD为2.85%,表明供试品溶液在24 h内基本稳定。
2.1.6 加样回收率试验。由表2可见,在供试品中按80%、100%和120%比例分别加入千里光菲灵碱对照品时,平均回收率分别为96.90%、97.28%和102.13%,RSD值分别为1.42%、1.48%和1.16%,表明该方法准确、可靠,可用于千里光药材中千里光菲灵碱的含量测定。
2.2 千里光菲灵碱的含量测定
由表3可知,不同产地的11批千里光药材中千里光菲灵碱的含量差异较大,产自广东、江苏和云南的千里光药材中千里光菲灵碱含量较低,而产自贵州、河南、四川、广西和浙江的千里光药材中千里光菲灵碱的含量较高。而产自浙江的千里光药材中千里光菲灵碱含量明显高于其他产地的,为0.811 1 μg/g。
3 讨论与结论
现代药理学研究表明,千里光具有广谱抗菌、抗氧化、清除自由基、抗病毒和抗肿瘤等药理作用。千里光中亦含有有毒成分吡咯里西啶类生物碱,对人和家畜肝脏有蓄积性损害,可造成肝硬化和坏死[17]。世界卫生组织(WHO)在1989年发布了有关吡咯里西啶生物碱的健康与安全指南,推测导致成人肝脏肝窦阻塞综合征(HSOS)的每日最低摄入量为每日1 mg PAs(按70 kg体重质量)。2020版《中国药典》仅对千里光药材中阿多尼弗林碱进行了含量限定,对其余吡咯里西啶类生物碱均无任何规定,其安全性值得注意。
该研究采用HPLC-MS/MS测定千里光中千里光菲灵碱的含量,采用MRM的扫描方式进行检测,所建立的含量测定方法具有较好的稳定性、灵敏度、准确度,检测结果科学、可靠。该试验参考了Bolechová等[18]所建立的方法中有关离子对的选择,在经历多次调整之后最终所得到的HPLC-MS/MS的检测条件,可为千里光药材的相关研究提供参考。试验中检测了11个产地千里光药材中千里光菲灵碱的含量,结果表明,产自广东、江苏和云南的千里光药材中千里光菲灵碱含量较低,而产自贵州、河南、四川、广西和浙江的千里光药材中千里光菲灵碱的含量较高。由于不同地区千里光药材中千里光菲灵碱的含量差异较大,为避免其造成的安全隐患,相关部门应给予充分的重视,从原药材、成品制剂、用药指导等方面进行严格把控,从整体水平揭示千里光等含PAs中药及其制剂的用药风险,为全面系统评价其安全性和指导其临床合理用药提供科学依据。
参考文献
[1]
国家药典委员会.中华人民共和国药典:2020年版 一部[S].北京:中国医药科技出版社,2020:35-36.
[2] 冯群,李晓宇,孙蓉.千里光药理作用和毒性研究新进展[J].中国药物警戒,2014,11(3):151-153,157.
[3] LI S L,LIN G,FU P P,et al.Identification of five hepatotoxic pyrrolizidine alkaloids in a commonly used traditional Chinese medicinal herb,Herba Senecionis scandentis(Qianliguang)[J].Rapid Commun Mass Spectrom,2008,22(4):591-602.
[4] XIONG A Z,FANG L X,YANG X,et al.An application of target profiling analyses in the hepatotoxicity assessment of herbal medicines:Comparative characteristic fingerprint and bile acid profiling of Senecio vulgaris L.and Senecio scandens Buch.-Ham[J].Anal Bioanal Chem,2014,406(29):7715-7727.
[5] WANG Y,LI Y Y,CANG S,et al.Qualitative and quantitative analysis of pyrrolizidine alkaloids for the entire process quality control from Senecio scandens to Senecio scandens-containing preparations by high performance liquid chromatography-tandem mass spectrometry[J/OL].J Mass Spectrom,2020,55(10)[2021-01-27].https://doi.org/10.1002/jms.4532.
[6] 陳依然,张玮,张明,等.PA-HSOS严重度分级预测经劲静脉肝内门体分流术治疗PA-HSOS患者预后的研究[J].中华肝脏病杂志,2021,29(1):46-53.
[7] FU P P,XIA Q S,LIN G,et al.Pyrrolizidine alkaloids-genotoxicity,metabolism enzymes,metabolic activation,and mechanisms[J].Drug Metab Rev,2004,36(1):1-55.
[8] TAMARIZ J,BURGUEO-TAPIA E,V ZQUEZ M A,et al.Pyrrolizidine alkaloids[J].Alkaloids Chem Biol,2018,80:1-314.
[9] HADI N S A,BANKOGLU E E,SCHOTT L,et al.Genotoxicity of selected pyrrolizidine alkaloids in human hepatoma cell lines HepG2 and Huh6[J/OL].Mutat Res,2021,861/862[2021-01-27].https://doi.org/10.1016/j.mrgentox.2020.503305.
[10] 程东亮,曹小平.额河千里光中吡咯啶型生物碱的分离鉴定及相对含量的测定[J].中草药,1992,23(6):286-288,334.
[11] HINCKS J R,KIM H Y,SEGALL H J,et al.DNA cross-linking in mammalian cells by pyrrolizidine alkaloids:Structure-activity relationships[J].Toxicol Appl Pharmacol,1991,111(1):90-98.
[12] 韩佳寅,易艳,梁爱华,等.千里光对小鼠体外培养胚胎的胚胎毒性研究[J].药学学报,2014,49(9):1267-1272.
[13] WANG W Q,YANG X,CHEN Y,et al.Seneciphylline,a main pyrrolizidine alkaloid in Gynura japonica,induces hepatotoxicity in mice and primary hepatocytes via activating mitochondria-mediated apoptosis[J].J Appl Toxicol,2020 ,40(11):1534-1544.
[14] HESSEL-PRAS S,BRAEUNING A,GUENTHER G,et al.The pyrrolizidine alkaloid senecionine induces CYP-dependent destruction of sinusoidal endothelial cells and cholestasis in mice[J].Arch Toxicol,2020,94(1):219-229.
[15] XIONG A Z,SHAO Y L,FANG L X,et al.Comparative analysis of toxic components in different medicinal parts of Gynura japonica and its toxicity assessment on mice[J].Phytomedicine,2019,54:77-88.
[16] YANG X,WANG H,NI H M,et al.Inhibition of Drp1 protects against senecionine-induced mitochondria-mediated apoptosis in primary hepatocytes and in mice[J].Redox Biol,2017,12:264-273.
[17] MOREIRA R,PEREIRA D M,VALENTO P,et al.Pyrrolizidine alkaloids:Chemistry,pharmacology,toxicology and food safety[J].Int J Mol Sci,2018,19(6):1-22.
[18] BOLECHOV M,Cˇ SLAVSKY′ J,POSPCHALOV M,et al.UPLC-MS/MS method for determination of selected pyrrolizidine alkaloids in feed[J].Food Chem,2015,170:265-270.

