超高效液相色谱-串联质谱法测定新生儿血浆中氟康唑的浓度
覃冬杰 李 萍 吴 婧 梁 婧 韦艳飞 蒋永江 于桥爱 何 静 王宏虹
1.柳州市质量检验检测研究中心药品科,广西柳州 545006;2.柳州市妇幼保健院 广西科技大学附属妇产医院、儿童医院药学部,广西柳州 545001;3.柳州市妇幼保健院 广西科技大学附属妇产医院、儿童医院新生儿科,广西柳州 545001;4.柳州市妇幼保健院 广西科技大学附属妇产医院、儿童医院医学检验科,广西柳州 545001
近年来,新生儿重症监护室真菌感染的发病率、死亡率呈逐年上升趋势[1-3],氟康唑是目前治疗全身性真菌感染的首选药物,临床使用较为广泛[4-7]。对于存在真菌感染高危因素的新生儿,早期给予预防性氟康唑治疗可明显降低真菌的定殖率和感染率,有效降低侵袭性真菌感染的发病率及死亡率[8-11]。常规治疗药物监测方法有高效液相色谱法[12-14]和高效液相色谱-串联质谱法[15-17]。高效液相色谱法由于灵敏度的局限性,需较大釆血量才能达到分析要求,然而新生儿特别是早产儿体重较轻,釆血量过大易导致医源性贫血,危及健康[18]。因此,为了新生儿氟康唑血药浓度监测工作的顺利开展,建立一种釆血量小,高效、快速、灵敏的测定方法尤为必要。本研究旨在建立一种测定新生儿血浆中氟康唑浓度的超高效液相色谱-串联质谱的方法,为临床监测其血药浓度提供检测手段。
1 一般材料
1.1 仪器
1290-6430 超高效液相色谱-质谱联用仪(电化学喷雾离子源,美国安捷伦公司);SK8200HP 超声波清洗器(上海科导超声仪器有限公司);3-3OK 台式高速离心机(德国Sigma 公司);VIBRAX VXR 振荡器(德国IKA 集团);XP26 电子分析天平(瑞士梅特勒托利多公司,0.01 mg);24 UV 超纯水器(德国默克密理博公司)。
1.2 药品
氟康唑对照品(中国食品药品检定研究院,批号100314-201605,含量99.7%);非那西丁对照品(中国食品药品检定研究院,批号100095-201606,含量100%);甲醇(美国Fisher Scientific 公司)为色谱纯;水为自制超纯水;其余化学试剂均为分析纯。
2 方法与结果
2.1 色谱及质谱条件
2.1.1 色谱条件 色谱柱:Eclipse Plus C18RRHD(2.1 mm×100 mm,1.8 μm);柱温:30℃;流速:0.3 ml/min;流动相A:0.1%甲酸,流动相B:甲醇。梯度洗脱:0~0.50 min 80%A,0.50~3.00 min 80%~20%A,3.00~4.50 min 20%A,4.50~4.51 min 20%~80%A,4.51~6.00 min 80%A;进样量:1 μl。
2.1.2 质谱条件 电化学喷雾离子源,正离子模式电离,多反应监测模式采集。离子源温度:350℃;干燥器流量:8 L/min;毛细管电压4000 V,雾化器压力45 psi。化合物参数分别为氟康唑:母离子质核比(m/z)307.1,定量子离子m/z 220.0,碎裂电压90 V,碰撞能量15 V。非那西丁:母离子m/z 180.1,定量子离子m/z 110.0,碎裂电压110 V,碰撞能量15 V。质谱图见图1。

图1 氟康唑和非那西丁的二级质谱图
2.2 对照品及内标溶液的制备
精密称取氟康唑对照品5.005 mg 置于5 ml 容量瓶,加纯化水溶解并定容至刻度,制成浓度为1.001 mg/ml的对照品储备液。精密称取非那西丁对照品5.131 mg置于5 ml 容量瓶,加纯化水溶解并定容至刻度,制成浓度为1.026 mg/ml 的内标储备液,取储备液定量稀释制成浓度为0.5131 μg/ml 的内标使用液。
2.3 血浆样品的制备及处理
2.3.1 含药血浆样品的制备 取空白血浆,精密加入氟康唑对照品使用液适量,使血浆样品的浓度分别为:0.1001、0.5005、1.0010、5.0050、10.0100、20.0200、50.0500、60.0600 μg/ml。
2.3.2 血浆样品的处理 取50 μl 血浆样品,加入50 μl非那西丁内标使用液,加乙腈400 μl,涡旋1 min,4000 r/min 离心2 min(离心半径为3 cm),取上清液过0.22 μm 微孔滤膜,待测。
2.4 方法学考察
2.4.1 专属性试验 取6 份空白血浆样品及浓度为1.0010 μg/ml 的含药血浆样品,按“2.3.2”项下方法处理,进样测定。结果显示,空白血浆中内源性物质对待测成分无干扰,专属性高。见图2。
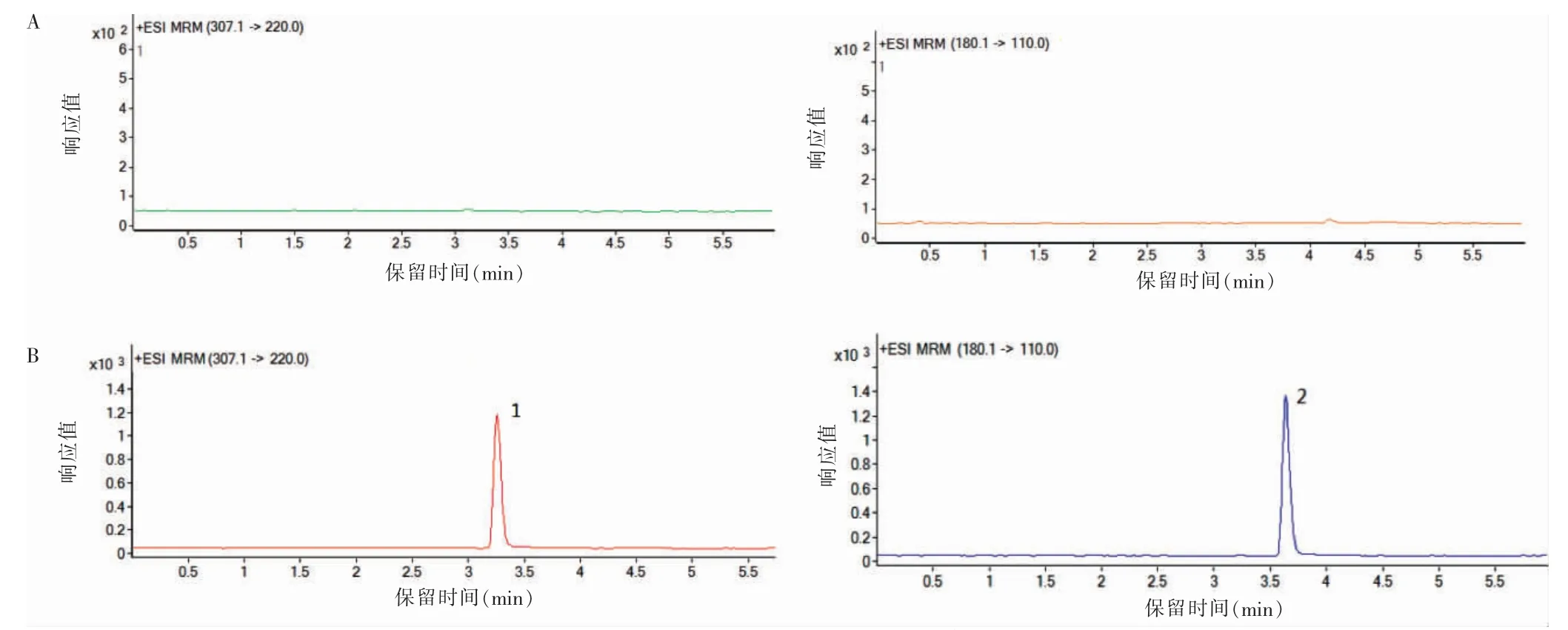
图2 血浆中氟康唑和非那西丁色谱图
2.4.2 标准曲线与定量限 精密吸取“2.3.1”项下的含药血浆样品,按“2.3.2”项下方法处理,进样测定。结果显示:回归方程为Y=0.5325X+0.1762(r=0.9999),氟康唑在0.1001~60.0600 μg/ml 浓度范围内与峰面积呈良好线性关系。见图3。以10 倍基线噪音时所对应的氟康唑浓度确定定量限为0.01 μg/ml。
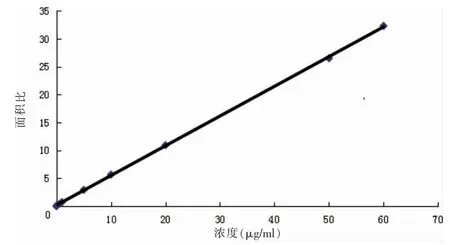
图3 标准曲线图谱
2.4.3 精密度与准确度 精密量取含药血浆样品(浓度分别为0.5005、10.0100 和50.0500 μg/ml)各5 份,于5 d 内每日按“2.3.2”项下方法处理,每份样品分别测定1 次,考察日内及日间精密度;将实测浓度与理论添加浓度进行比较,考察准确度。结果显示,日内精密度RSD 分别为3.74%、1.38%和2.59%,日间精密度RSD 分别为8.88%、1.88%和2.38%,准确度分别为(86.0±3.5)%、(98.1±1.6)%和(99.0±2.2)%。
2.4.4 提取回收率与基质效应 精密量取含药血浆样品(浓度分别为0.5005、10.0100 和50.0500 μg/ml)各5 份,按“2.3.2”项下方法进行处理,每份样品分别测定1 次,得氟康唑峰面积(A);另取空白血浆,按“2.3.2”项下方法进行处理,用获得的空白基质液配制基质对照品溶液,使其与前者浓度一致,测定,得氟康唑峰面积(B);再取氟康唑对照品溶液,用80%乙腈配制成相同浓度的溶剂对照品溶液,测定,得氟康唑峰面积(C)。提取回收率=A/B×100%,基质效应=B/C×100%。结果显示,提取回收率分别为(103.3±5.7)%、(87.8±2.8)%和(98.7±3.7)%,基质效应分别为(103.6±2.5)%、(102.1±1.8)%和(101.3±1.6)%。
2.4.5 稳定性试验 取含药血浆样品(浓度分别为0.5005、10.0100 和50.0500 μg/ml)各5 份,分别于室温放置12 h、-20℃反复冻融3 次及-20℃冷冻放置30 d 后,按“2.3.2”项下方法处理,每份样品分别测定1 次,考察稳定性。结果显示,室温放置12 h 后稳定性RSD分别为8.53%、1.35%和2.07%,-20℃反复冻融3 次后稳定性RSD 分别为4.35%、1.54%和1.43%,-20℃冷冻放置30 d 后稳定性RSD 分别为4.66%、2.53%和2.26%。
2.5 临床样品测定
选择2020 年7 月至11 月柳州市妇幼保健院新生儿科住院患儿10 例,因预防或治疗侵袭性念珠菌感染给予氟康唑,于给药后取静脉血0.5 ml,分离血浆,按“2.3.2”项下方法处理,测定氟康唑血药浓度,见表1。本研究经柳州市妇幼保健院医学伦理委员会批准,患者监护人知情并签署知情同意书。
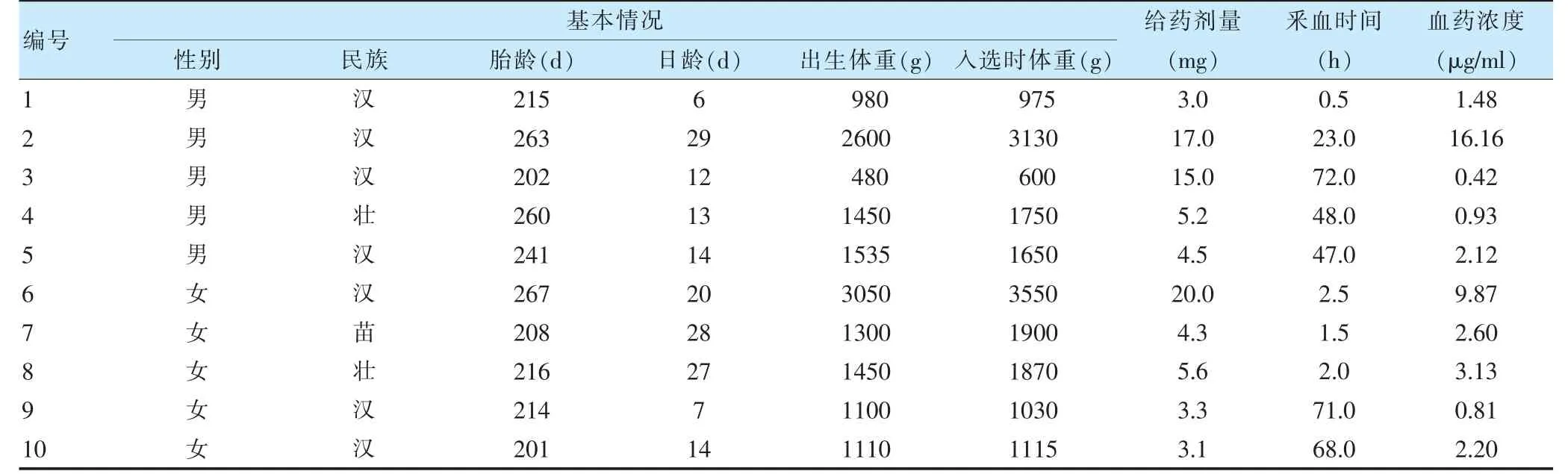
表1 患儿基本情况及血药浓度测定结果
3 讨论
采用内标法定量测定,可以减少由仪器系统或操作过程产生的误差。新生患儿由于基础疾病较多,会使用较多的、不同类型的药物进行治疗,选取一种自身不含且不会应用于新生儿的成分作为内标尤为重要。本研究选取非那西丁作为内标,并考察了它的色谱保留行为。结果显示,氟康唑与非那西丁的保留时间相近,两色谱峰能完全分开,且不受内源性物质的干扰,说明非那西丁作为本研究的内标物较合适。
在血浆样品处理时,有文献报道用液液萃取法[19-20]、固相柱萃取法[21]和蛋白沉淀法[22-24],本研究在比较甲醇和乙腈沉淀蛋白时,发现乙腈作为蛋白沉淀剂时的提取效率较甲醇高,故选用乙腈作为蛋白沉淀剂。
早产儿是侵袭性真菌感染的高危人群,氟康唑的新生儿治疗用量为3~12 mg/kg,≤2 周的患儿每隔72 h给药1 次,预防真菌感染的用法用量尚无统一标准。本研究发现早产儿按3 mg/kg 给药后氟康唑血药浓度处于低水平维持,足月儿按6 mg/kg 给药后个体差异较大。因此,氟康唑用于该人群的用药剂量、有效性、安全性需进一步研究探讨。
本研究建立的方法操作简便、快速、准确、灵敏度高,经方法学验证,各项指标均符合生物样品定量分析的相关要求[25]。每个样品仅需50 μl 即可进行分析测定,用量较小,适用于新生儿血浆中氟康唑浓度的测定。

