miR-195 调控人乳腺癌细胞MCF-7 增殖与凋亡的作用及机制研究
刘嘉祺 翟凤国 高金霞 刘佳维 杨旭东 周福波 李孟全
1.牡丹江医学院药理教研室,黑龙江牡丹江 157011;2.牡丹江医学院预防医学教研室,黑龙江牡丹江 157011;3.牡丹江医学院有机化学教研室,黑龙江牡丹江 157011;4.牡丹江医学院医药研究中心,黑龙江牡丹江 157011
乳腺癌是导致患者死亡的常见妇科恶性肿瘤[1-2],其发病机制尚不十分清楚。蛋白磷酸酶1D(protein phosphatase magnesium-dependent 1 delta,PPM1D)为一种癌基因,在乳腺癌细胞中高表达,发挥重要作用[3-5]。miR-195 为非编码RNA 分子[6-7],调控癌症发生发展过程[8-10]。而miR-195 在乳腺癌发病机制中扮演着什么样的角色?miR-195 与靶基因的调控作用怎样?目前相关报道尚少。本实验观察人乳腺癌细胞miR-195 和PPM1D 表达,探讨miR-195 对乳腺癌细胞增殖和凋亡的影响及其机制,旨在为乳腺癌的发生机制提供新思路。
1 材料与方法
1.1 材料与试剂
DMEM 高糖培养基(货号:11995);胎牛血清(货号:SV30087);胰蛋白酶消化液(货号:C0201);蛋白酶抑制剂(货号:P1005);细胞裂解液(货号:P0013);中国上海碧云天生物公司;SYBR qPCR Mix,RtqPCR Kit(货号:FSQ-101);日本东洋纺(上海)生物科技有限公司;X-treme GENE siRNA(货号:04476093 001),瑞士罗氏公司;DAPI 染色液(货号:E-IR-R103),中国武汉博士德生物工程有限公司;TUNEL 试剂盒(货号:11684817910),瑞士罗氏公司。
1.2 细胞培养
正常乳腺上皮细胞MCF-10A 和人乳腺癌细胞MCF-7 复苏,细胞沉淀中加入细胞培养液,转移至培养瓶,37℃,5% CO2孵箱培养。待细胞生长至70%~80%,适量胰蛋白酶消化细胞,补足培养液,继续培养。
1.3 MCF-7 转染
MCF-7 瞬时转染,实验MCF-7 组;miR-195 mimics组(MCF-7 转染miR-195 拟似物);miR-195 inhabitor组(MCF-7 转染miR-195 抑制剂);阴性对照NC 组(MCF-7 转染无关阴性对照序列negative control,NC)。转染过程避光进行,36 h 后进行后续实验。
1.4 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法检测细胞增殖
将各实验组细胞接种于96 孔板中,各实验组设5 个复孔。MTT 溶液(20 μl/孔)培养箱中孵育4 h。随后加150 μl 二甲基亚砜,室温摇床振荡10 min。490 nm 波长下检测各孔吸光度值。
1.5 DNA 断裂的原位末端标记法(TdT-mediatedduTP nick end labeling,TUNEL)法检测细胞凋亡
培养细胞,将灭菌后的玻片铺于24 孔板中,每孔加入500 μl 细胞悬液。孵育48 h 后处理细胞,参照TUNEL 检测试剂盒检测细胞凋亡。
1.6 蛋白质免疫印迹(Western blot,WB)检测蛋白表达
转染的细胞用刮刀刮下,2500 r/min,4℃离心10 min。弃上清,每份样品加入RIPA 和蛋白酶抑制剂,冰上超声破碎。经10%丙烯酰胺凝胶电泳分离后转移到硝酸纤维素膜上。5%脱脂牛奶封闭,室温摇床2~3 h,孵育一抗PPM1D 和β-actin,4℃孵育过夜。洗膜,室温孵育荧光二抗,再洗膜。总蛋白以β-actin 作内参,红外荧光扫描系统检测,odyssey 软件进行光密度积分值分析。
1.7 qRT-PCR 法检测miR-195 表达
qRT-PCR 包括总RNA 提取,逆转录和实时荧光定量PCR 三部分。逆转录反应体系:5×RT buffer 2 μl,RT Enzyme mix 0.5 μl,Primer mix 0.5 μl,Random 引物1 μl,总RNA 0.5 μg,Nuclease-Free Water 将反应体系补至10 μl。PCR反应体系:SYBR 混合体系10 μl,正向引物1 μl,反向引物1 μl,cDNA 1 μl,Nuclease-Free Water 7 μl 补足至20 μl。PCR 扩增条件:95℃预变性5 min,95℃变性10 s,60℃退火30 s,72℃延伸30 s,U6 为内参,ABI Prism®7500 fast 仪器设置40 个循环。miR-195-5p 正向引物5’-GCGCGTAGCAGCACAGAAA-3’,反向引物5’-AGTGCAGGGTCCGAGGTATT-3’;U6 正向引物5’-GCTTCGGCAGCACATATACTAAAAT-3’,反向引物5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.8 荧光素酶报告基因验证靶向调控作用
将HEK293 细胞接种于96 孔板,24 h 后转染miR-195 mimics 或阴性对照NC 及含miR-195 结合PPM1D 3’UTR 序列或突变序列的质粒,48 h 后通过双荧光素酶报告基因检测系统测定荧光素酶活性。
1.9 统计学方法
应用GraphPad Prism 6.0 软件对所得数据进行统计学分析,计量资料采用均数±标准差()表示,组间比较采用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 不同细胞系miR-195 表达
qRT-PCR 结果,MCF-7 组miR-195 表达低于MCF-10A 组,差异有统计学意义(P <0.05)。见图1。
2.2 不同细胞系PPM1D 表达
WB 结果,MCF-7 组PPM1D 蛋白表达高于MCF-10A 组,差异有统计学意义(P <0.05)。见图2。
2.3 miR-195 对人乳腺癌MCF-7 细胞增殖和凋亡影响
MTT 结果,miR-195 mimics 组细胞活力明显低于MCF-7 组,miR-195 inhabitor 组细胞活力高于MCF-7 组,差异有高度统计学意义(P <0.01)。见图3。TUNEL 结果,miR-195 mimics 组细胞凋亡率明显高于MCF-7 组,差异有高度统计学意义(P <0.01);miR-195 inhabitor 组细胞凋亡率低于MCF-7 组,差异有统计学意义(P <0.05)。见图4~5。
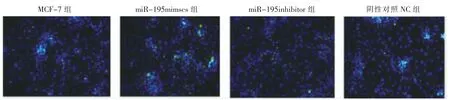
图4 TUNEL 染色图像显示绿色为凋亡细胞,为DAPI 染色细胞核(40×)(n=3)
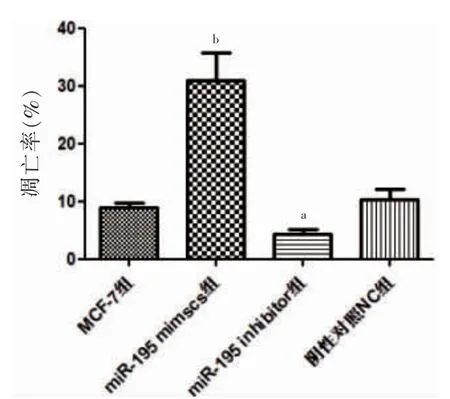
图5 TUNEL 结果(n=3)
2.4 miR-195 对PPM1D 调控作用
通过TargetScan 等miRNA 靶基因预测网站,预测miR-195 可能调控的靶基因。Has-miR-195-5p 的5’端有能够与PPM1D mRNA 3’非翻译区(untranslated area,UTR)互补区域,提示miR-195 可能在转录后水平靶向调控PPM1D 基因表达。见图6。

图6 预测miR-195 与PPM1D 3’UTR 之间结合位点
携带含有PPM1D 基因片段miR-195 mimics 组荧光素酶的活性低于MCF-7 组,差异有高度统计学意义(P <0.01);携带含有突变PPM1D 基因片段miR-195 mimics 组与MCF-7 组荧光素酶活性比较,差异无统计学意义(P >0.05)。见图7。
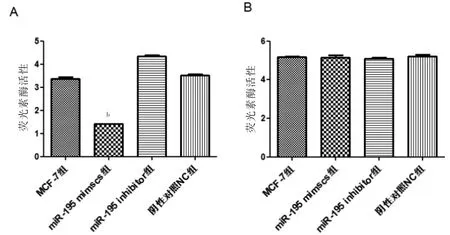
图7 miR-195 对PPM1D mRNA 3’UTR 调控作用(n=3)
3 讨论
微RNA 与多种癌症发病机制密切相关[11-13],其中miR-195 在癌细胞中表达异常[14-19],扮演着关键角色。PPM1D 为丝氨酸/苏氨酸磷酸酶,是一种重要的肿瘤蛋白[20-23],对许多重要的肿瘤抑制途径具有负调控作用[24-25]。在本实验中,MCF-7 组miR-195 表达低于MCF-10A 组,而PPM1D 蛋白表达高于MCF-10A 组。MCF-7 转染miR-195 mimics 后,细胞活力明显降低,细胞凋亡率显著增高;转染miR-195 inhabitor 后,细胞活力明显增高,细胞凋亡率降低。提示miR-195 对细胞的增殖和凋亡有一定程度影响。本文进一步探究miR-195 对人乳腺癌细胞增殖和凋亡作用机制。通过查询,PPM1D mRNA 的3’端有miR-195 可结合的序列。双荧光素酶报告基因实验显示,PPM1D 是miR-195 直接作用的靶点。
综上,MCF-7 中miR-195 与PPM1D 呈负相关,miR-195 可能通过直接靶向PPM1D mRNA 的3’-UTR,调控乳腺癌细胞的增殖与凋亡,这也是其调控机制的一部分,对于乳腺癌发病过程中所涉及miR-195正向作用或PPM1D 反向作用机制,还有待于进一步研究。

