个体化预测非小细胞肺癌患者化疗期间肺部感染风险Nomogram模型的建立与验证
张俐丽,冯国琴
(泰州市人民医院 1. 呼吸与危重症医学科; 2. 护理部,江苏 泰州 225300)
肺癌来源自腺体、气管及支气管黏膜中,是肺部原发性恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)约占80%左右[1]。近几年,由于受吸烟、饮食、环境污染等多种因素影响,肺癌患病人数正在逐年递增[2]。据2018年全球流行病学统计显示,在恶性肿瘤排名中男性肺癌的发病率及病死率位居首位,而女性肺癌发病率位列第3,病死率仅次于乳腺癌[3]。NSCLC早期无明显症状,大多数患者在确诊后往往已处于中晚期,失去了根治性手术的机会,只能采取放射治疗、化学治疗(简称化疗)等方式,然而放射治疗、化疗存在细胞毒性,在杀灭恶性肿瘤细胞的同时也会损伤人体正常细胞,造成免疫功能紊乱、免疫力下降,从而发生肺部感染,导致病情加重,死亡风险加大,住院时间延长,经济负担增加[4-5]。因此,如何有效预测和防控肺部感染发生一直是临床放射治疗、化疗时关注的焦点。国内外就此展开了大量研究[6-7],但大多数局限于引发肺部感染的危险因素,未能进一步构建有效的预测模型。Nomogram模型具备使用方便、预测效果好等优势,正逐渐广泛应用于医学领域中[8]。基于此,本研究拟在单因素、LASSO和多因素logistic回归分析的基础上,建立预测NSCLC患者化疗期间发生肺部感染的风险Nomogram模型,为提高临床治疗效果提供参考依据。
1 对象与方法
1.1 研究对象 回顾性选取2018年2月—2021年1月在泰州市人民医院进行治疗的218例NSCLC患者作为研究对象,设为训练集,在化疗的每个周期(3~4周)后进行规律随访,第1年内每2~3个月复查CT及X线片,之后每6个月复查1次,以发生肺部感染为随访结局事件,末次随访时间为2021年5月,根据是否发生肺部感染将其分为肺部感染组和非肺部感染组。按照相同标准选取2021年2—11月的58例NSCLC患者设为验证集,行外部验证。本研究符合《世界医学协会赫尔辛基宣言》相关要求,患者及其家属均知情同意。
1.2 纳入与排除标准 纳入标准:①符合《中华医学会肺癌临床诊疗指南(2018)版》中关于NSCLC诊断标准[9];②经影像学、病理学或细胞学检测确诊为NSCLC;③首次接受化疗者,且持续时间≥1周期;④年龄≥18岁且性别不限;⑤入院前无感染症状,未处于感染潜伏期;⑥临床资料完整者。排除标准:①患有精神疾病或智力低下者;②化疗期间中断>1周;③预期生存时间<6个月;④合并严重心、脑、肾、肺和肝等功能损伤或其他恶性肿瘤疾病者;⑤随访过程中失访者。
1.3 资料收集 参考既往文献关于诱发肺部感染的危险因素[10-11],并结合随访资料和医院信息系统收集患者的参数资料,其中包含①基本信息:性别、年龄、身体质量指数(BMI)、饮酒史、抽烟史和NSCLC类型;②基础疾病:糖尿病、高血压、心血管疾病(冠心病、心肌梗死、心绞痛、心力衰竭和短暂脑缺血病者等)、肺部疾病(支气管炎、慢性阻塞性肺疾病、支气管哮喘、肺结核等);③临床资料:TNM分期、化疗药物(顺铂、卡铂、奈达铂、紫杉醇、吉西他滨、多西他赛、依托泊苷等)、化疗周期、体温、化疗前肺功能[一秒钟用力呼气量/肺活量(FEV1/VC)和一氧化碳弥散率(TLCO)]、化疗前卡氏评分(KPS);④实验室指标:化疗后白细胞计数、化疗后清蛋白含量、化疗后血红蛋白含量。
1.4 相关定义 ①肺部感染:参照美国胸科协会制定的划分标准,评估是否发生肺部感染。a. 在化疗期间出现咳嗽、咳痰、发热、肺部湿啰音等感染症状或体征;b. 经胸部X线片显示肺部有浸润性阴影。以上两条标准均符合即可诊断为肺部感染。②年龄:根据我国年龄划分标准,将年龄≥60岁划分为老年人。③BMI:采用《中国成人超重和肥胖症预防控制指南》中制定的标准[12],超重为BMI >24 kg/m2,肥胖为BMI >28 kg/m2。④糖尿病:检测空腹血糖(FPG)≥7.0 mmol/L;或糖耐量试验(OGTT)中服糖后2 h血糖(2 h PG)≥11.1 mmol/L;或随机血糖≥11.1 mmol/L。⑤高血压:收缩压≥140 mmHg,舒张压≥90 mmHg。⑥高血脂:a.胆固醇(TC)≥ 5.2 mmol/L;b.甘油三酯(TG)≥ 1.7 mmol/L;c.高密度脂蛋白胆固醇(HDL-C)< 1.0 mmol/L;d.低密度脂蛋白胆固醇(LDL-C)≥3.4 mmol/L。当在空腹状态下检测静脉血浆时符合以上任意一项指标均可诊断为血脂异常。⑦KPS:KPS评分≥80分以上为非依赖级,即生活自理级;50~70分为半依赖级,即生活半自理;50分以下为依赖级,即生活需要别人帮助。
1.5 统计学处理 应用SPSS 22.0软件进行数据分析,采用χ2检验计数资料,LASSO回归筛选非零系数的预测因素,logistic回归分析筛选影响因素,以P≤0.05为差异有统计学意义。采用R(R3.5.3)软件包和rms程序包制作列线图,采用rms程序包计算一致性指数(C-index),并绘制校正曲线和受试者工作特征曲线( ROC曲线)评估模型的预测效能。
2 结果
2.1 一般情况 训练集218例NSCLC患者,化疗后56例发生肺部感染,感染发病率为25.69%。
2.2 训练集患者参数资料比较 肺部感染组与非肺部感染组患者的性别、BMI、饮酒史、抽烟史、高血压、心血管疾病、肺部疾病、NSCLC类型、体温、化疗前肺功能、化疗后白细胞和血红蛋白含量等资料比较,差异均无统计学意义(均P>0.05);两组患者的年龄、糖尿病、TNM分期、化疗药物、化疗周期、化疗后清蛋白含量和化疗前KPS评分等资料比较,差异均有统计学意义(均P<0.05)。见表1。
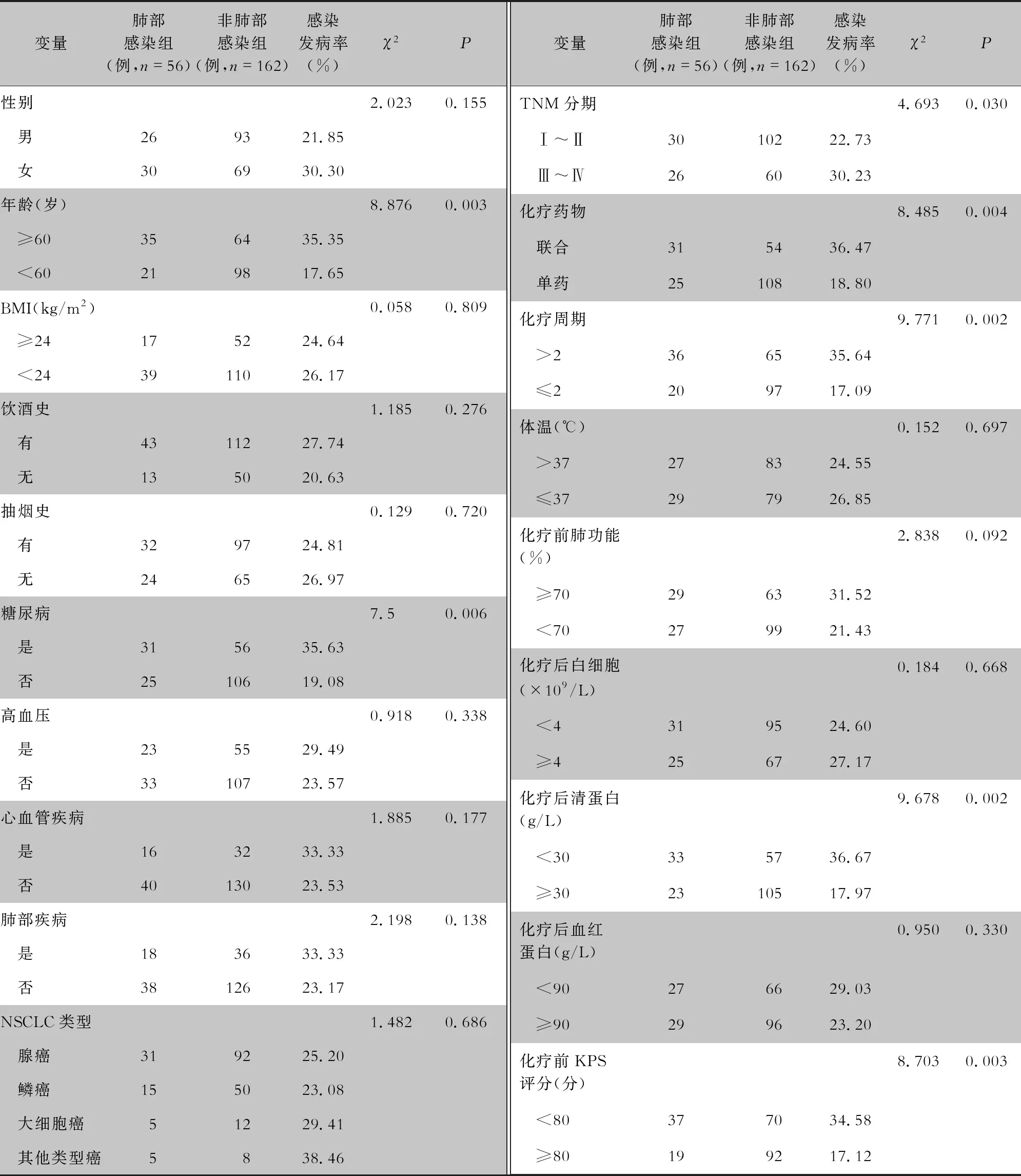
表1 训练集NSCLC患者参数资料单因素分析
2.3 预测因素筛选结果 基于218例NSCLC患者的参数资料进行LASSO回归分析,结果显示年龄、糖尿病、TNM分期、化疗药物、化疗周期、化疗后清蛋白含量和化疗前KPS评分等是系数不为零的预测因素。见图1。

注:A图表示λ(最优参数值)=0.021时绘制垂直线,选取7个变量关系图;B图表示调整参数λ后,各个临床特征系数与log(λ)的关系图。
2.4 多因素logistic回归分析 以肺部感染发生情况(发生=1,未发生=0)为因变量,以LASSO回归分析筛选的重要预测因子(年龄:≥60岁=1,<60岁=0;糖尿病:是=1,否=0;TNM分期:Ⅰ~Ⅱ期=1,Ⅲ~Ⅳ期=0;化疗药物:联合=1,单药=0;化疗周期:>2次=1,≤2=0;化疗后清蛋白含量:<30 g/L=1,≥30 g/L=0;化疗前KPS评分:<80分=1,≥80分=0)为自变量,进行多因素logistic回归分析,结果显示年龄≥60岁、糖尿病、联合化疗药物、化疗周期>2次、化疗后清蛋白含量<30 g/L、化疗前KPS评分<80分是NSCLC患者化疗期间发生肺部感染的独立危险因素(均P<0.05)。见表2。

表2 NSCLC患者化疗期间肺部感染的多因素logistic回归分析
2.5 Nomogram风险模型的建立 基于6项独立预测因素建立预测NSCLC患者化疗期间发生肺部感染的风险列线图模型,各条评分线左侧端点均对应为0分,右侧端点自年龄指标起依次为100、85、75、82、92、83分,总分为517分。见图2。如1例NSCLC患者,年龄≥60岁,选择联合化疗药物治疗,化疗前KPS评分<80分,根据列线图模型评分显示:100+75+82=257分,与之对应的肺部感染发生概率约为25%。
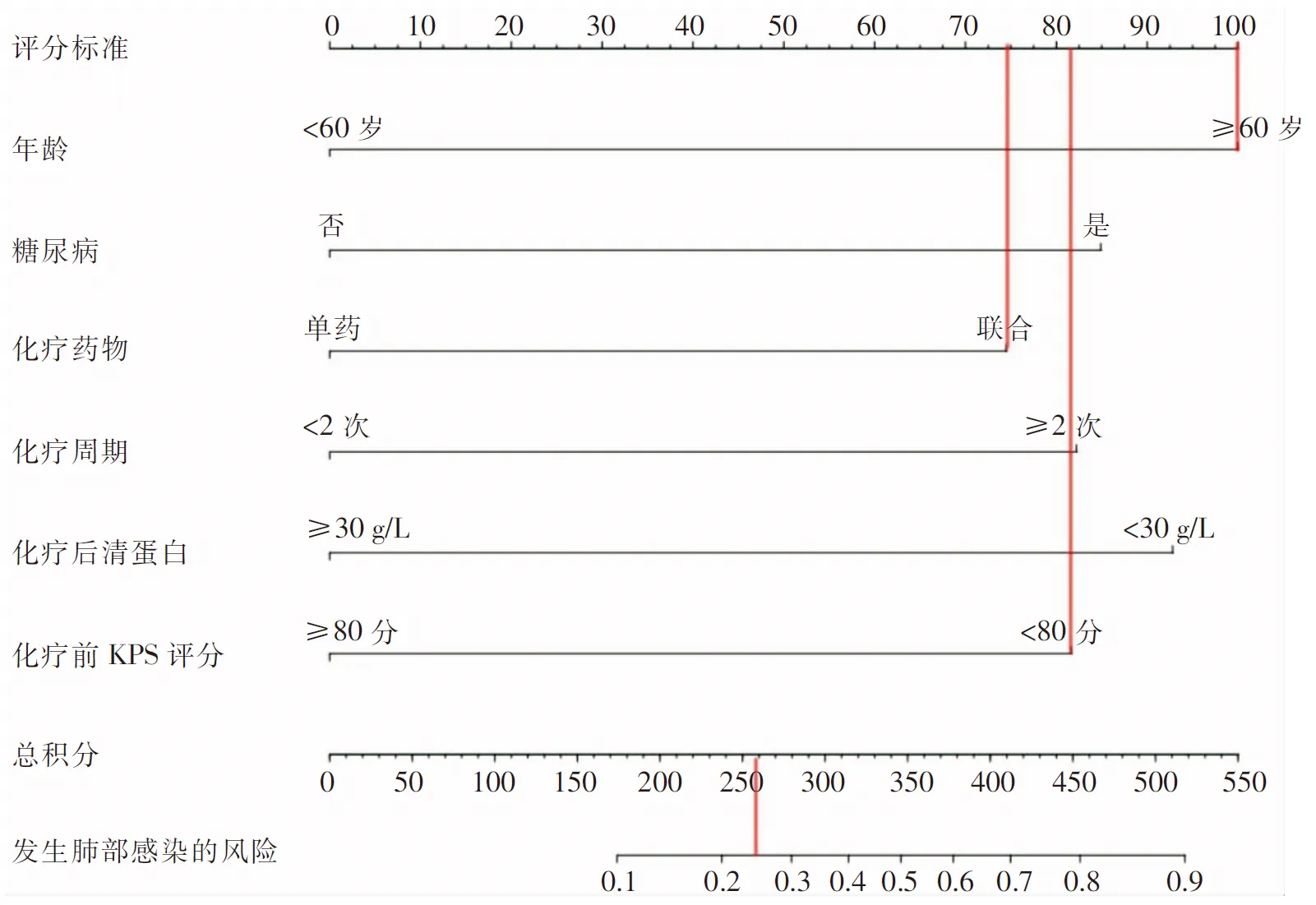
图2 NSCLC患者化疗期间肺部感染的Nomogram风险模型
2.6 Nomogram风险模型的验证 采用Bootstrap 法(原始数据重复抽样1 000次后)对列线图模型进行内部验证,外部验证通过验证集验证。结果显示:训练集和验证集的C-index分别为0.819(95%CI:0.788~0.850)、0.802(95%CI:0.778~0.829);两集的校正曲线均与理想曲线拟合反映良好,见图3,ROC曲线下面积(AUC)分别为0.807(95%CI:0.775~0.839)、0.797(95%CI:0.773~0.821),见图4;决策曲线显示阈值概率在1%~90%时,具有较高的净获益值,见图5。以上均显示本模型具有良好的预测精准度。
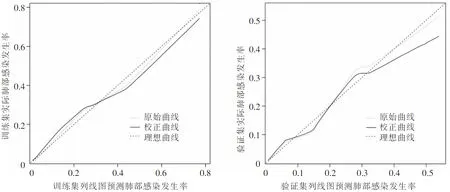
图3 Nomogram模型的校正曲线验证图
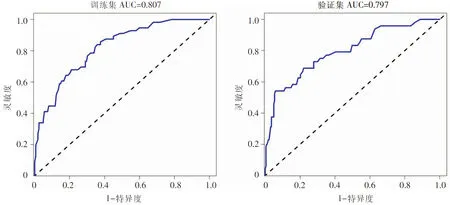
图4 Nomogram模型的ROC曲线验证图
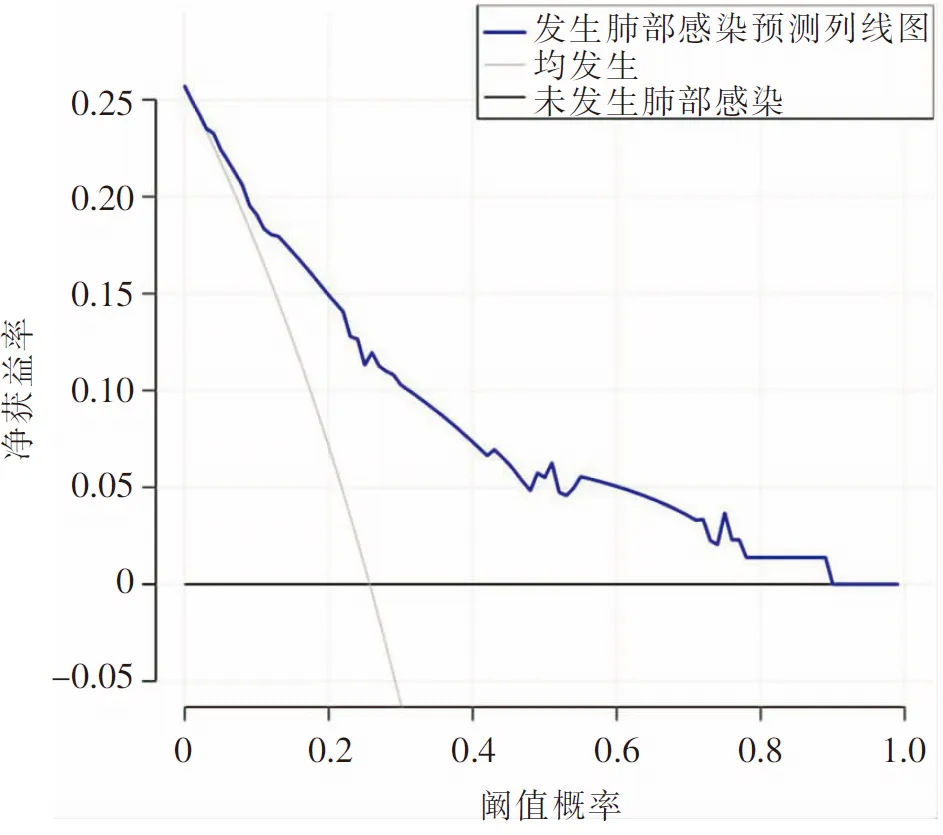
图5 Nomogram模型的决策曲线图
3 讨论
3.1 NSCLC患者化疗期间肺部感染发生情况分析肺癌是当前发病率最高的实体恶性肿瘤,全球每年大约160万例死亡,其中我国死亡人数高达62.6万[13]。由于NSCLC早期无明显特征,发现时往往已进入中晚期,失去了手术治疗最佳时期,只能进行化疗、放射治疗和靶向治疗等,且5年生存率不足15%[14]。化疗是应用化学药物清除患者体内肿瘤细胞,除了有效控制肿瘤细胞的繁殖和转移外,还会损伤人体正常细胞引发一系列不良反应,如神经毒性、肾毒性、骨髓抑制和肺部感染等,对患者的身心健康和生活质量造成严重影响[15]。国内外既往研究[16-17]表明,肺部感染的发生与患者临床特征、治疗因素和免疫功能紊乱等因素具有一定的关联性,但诸多因素之间的预测效能存在较大异质性,尚未达成一致而有效的NSCLC患者肺部感染的预测模型。本研究显示218例NSCLC患者化疗期间56发生例肺部感染者,感染发病率为25.69%,与叶晓明等[18]报道420例NSCLC患者在化疗期间肺部感染发病率为23.10%一致,提示NSCLC患者化疗期间易发生肺部感染。
3.2 NSCLC患者化疗期间肺部感染的危险因素 LASSO回归是通过构造一个惩罚函数获得一个较为精炼的模型,可同时进行参数估计和变量选择,不仅能克服逐步回归变量选择方法的局限性,还可以保留子集选择的可解释性和岭回归的稳定性,适合多个影响因素的变量选择问题[19]。logistic回归是一种非线性概率型的预测模型,能够研究分类观察结果和一些协变量之间的关系,临床上一般用于分析诱发疾病的高危因素[20]。本研究logistic回归分析结果显示,年龄≥60岁、糖尿病、联合化疗药物、化疗周期>2次、化疗后清蛋白含量<30 g/L、化疗前KPS评分<80分是NSCLC患者化疗期间发生肺部感染的独立危险因素。①年龄≥60岁。李乔等[10]对296例肺癌化疗患者的临床参数进行回顾性分析发现,年龄与肺部感染的发生显著相关;孙广玉等[21]研究也指出年龄越大,在化疗期间发生肺部感染的风险越大。可能是随着患者的年龄增长,各个组织器官功能退化,导致肺结构和功能退行性改变,呼吸肌张力降低,对化疗的耐受力也相应减弱,更易发生肺部感染。②糖尿病。苏强等[11]对107例NSCLC患者化疗期间发生肺部感染的危险因素进行多因素logistic回归分析发现,糖尿病是其独立危险因素。糖尿病会使血管壁发生纤维素样变性和脂肪变性,增强血管壁的通透性,引起血管管腔狭窄或形成血栓,造成血液供应不足,不利于炎症的吸收和消散,反而促进炎症迁延而不易愈合。③联合化疗药物。张良等[22]研究显示,联合使用化疗药物治疗是肺部感染的独立危险因素。可能是采取单药往往难以杀灭恶性肿瘤细胞,而联合用药能发挥协同效果,但多药联合化疗会引起更大的不良反应(如白细胞减少),引发肺部感染。④化疗周期>2次。鲍秋红等[7]报道化疗周期与NSCLC患者发生肺部感染相关。可能是随着化疗周期次数的增加,使患者机体免疫力减弱,体质变差,耐受力也逐渐降低,因而增加感染风险。⑤化疗后清蛋白含量<30 g/L。金剑英等[23]研究表明,NSCLC患者化疗后清蛋白含量<30 g/L易发生肺部感染。清蛋白水平能够反映出患者的免疫力和营养状况,当清蛋白含量<30 g/L时,机体免疫力减弱,营养状况差,难以抵御病原菌侵袭,尤其是长时间化疗患者,体内清蛋白大量损耗,更易发生感染。⑥化疗前KPS评分<80分。曹晓艳等[24]研究指出,肺癌患者化疗前KPS评分<80分与化疗期间发生肺部感染具有相关性。KPS评分一般可作为评估肿瘤患者的生存质量,化疗前KPS评分对评估肿瘤患者预后有重要价值,评分越高,表明健康状况越好,越能耐受化疗给身体带来的副作用。
3.3 NSCLC患者化疗期间发生肺部感染的Nomogram模型建立及应用价值 Nomogram即列线图,是一种建立在多因素回归模型基础上,将多个预测指标整合并由数条带有刻度的线段绘制而成的图形,可以将复杂的数据变成可视化,使预测模型更为直观,具有可读性,方便对患者进行个体化风险评估[25]。相较于陈晓艳等[26]通过多因素logistic回归分析构建颅脑创伤住院患者并发肺部感染的早期预警模型,本研究先采用LASSO分析初筛预测因子,再纳入多因素回归模型进行逐步回归分析,以此筛选出的变量更为严谨。相较于蒋虹等[27]仅采用ROC曲线验证术后肺部感染模型,本研究为避免模型的过度拟合,运用C-index、校正曲线、ROC曲线和决策曲线多种验证方式,更具有可信度。验证结果显示,训练集和验证集的C-index分别为0.819(95%CI:0.788~0.850)、0.802(95%CI:0.778~0.829),两集校准曲线走向与对角线(理想曲线)较为贴近,AUC分别为0.807(95%CI:0.775~0.839)、0.797(95%CI:0.773~0.821),决策曲线显示阈值概率在1%~90%时,有较高的净获益值,进一步证明Nomogram模型对预测肺部感染具有良好的预测精准度。
3.4 NSCLC患者化疗期间发生肺部感染的护理对策 护理人员可根据Nomogram模型的各项预测因素做好针对性的护理对策,如饮食护理、生活护理、呼吸道护理和氧疗护理等。
综上所述,年龄≥60岁、糖尿病、联合化疗药物、化疗周期>2次、化疗后清蛋白含量<30 g/L、化疗前KPS评分<80分是NSCLC患者化疗期间发生肺部感染的独立预测因素,基于独立预测因素建立的Nomogram模型具有较好的预测效能,有助于临床及早筛查高风险患者和进一步改进治疗计划。本研究的不足之处在于由于实践限制,生物学、功能影像学、同期治疗药物选择等因素未能参与构建模型,同时单中心样本量有限,存在一定程度的数据偏倚,故模型的精准度尚需多中心、大样本、纳入更多因素的研究予以进一步验证。
利益冲突:论文所有作者共同认可论文无相关利益冲突。
作者贡献声明:试验设计、研究实施、资料收集为张俐丽、冯国琴,论文撰写为张俐丽。

