术前白蛋白与碱性磷酸酶比值作为食管癌患者诊断指标的临床价值
周熙朗,费素娟
徐州医科大学附属医院消化内科,江苏 徐州 221002
食管癌的年发病率在我国恶性肿瘤中一直较高,并且占据了全球新发病例以及死亡病例的近一半[1],近期有统计数据[2]显示食管癌已成为我国第六大常见的恶性肿瘤,死亡率居第四位。多数食管癌患者早期无特异性的症状,多因出现吞咽困难才就医,但已经失去了最佳治疗时机,导致其死亡率较高。目前临床上诊断食管相关疾病,主要靠血清的消化道肿瘤相关标志物,如癌胚抗原(carcinoernbryonic antigen,CEA)、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)及内镜检查[3],其中消化道肿瘤相关指标的特异度及灵敏度均较低,无法满足早期诊断食管癌的要求,并且无法提供病理的金标准。而胃镜的依从性在我国一直较低,主要是由于胃镜的侵入性、高昂的检查费用以及较差的体验感导致。我国乡镇地区的食管癌发病率及死亡率显著高于城市地区,这种差异可能是由于地域偏僻、医疗技术不发达、经济欠发达等多种因素导致的[2]。这种矛盾就迫切需要我们开发出准确、经济且容易被患者接受的检验方法。据报道[4-5],肿瘤细胞的发生发展需要促癌微环境的孵育,而人体自身炎症反应、较差的营养状况及免疫缺陷均是促癌微环境的主要诱因。因此,近年来临床科研人员已证实[6-8],可以将血清标志物如中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、淋巴细胞与单核细胞比值(lymphocyte to monocytes ratio,LMR)等结合以评估治疗效果并识别出不同患者的结果风险及预后,而较少报道以这些炎症的标志物为基础诊断的价值。血清白蛋白是反映患者营养状况和身体炎症状况的重要指标,有时甚至可以反映抗肿瘤治疗的效果[9-10]。对29项流行病学研究[11]的系统评价表明,治疗前白蛋白水平是患者生存的独立预测指标。而升高的碱性磷酸酶水平与某些晚期癌症状态相关,因此,AAPR综合反映患者的炎症和营养状态,已被证明与肝癌、肾癌及膀胱癌的预后高度相关[12-14]。同样可能在食管癌的诊断中有较高的临床实践价值。总之,本研究探讨了AAPR对食管癌患者临床诊断的可行性,以及进一步联合多项消化道肿瘤相关标志物可否有效地区分食管癌和食管良性疾病。
1 资料与方法
1.1 一般资料收集2018年1月至2020年10月在我院胸外科行食管癌外科治疗的202例患者(食管病组),男145例,女57例,均符合美国癌症联合会指南[15]的诊断标准,年龄(61.37±10.86)岁;另选取同时期于我院消化内科住院的食管良性疾病患者215例(食管良性疾病组),其中反流性食管炎49例、食管息肉54例、食管平滑肌瘤112例,年龄(57.43±11.27)岁;健康对照组为同时段我院体检中心体检示胃镜无明显异常的健康体检者214名,年龄(58.33±10.48)岁。三组年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。本研究经徐州医科大学附属医院伦理委员会批准,批号:XYFY2021-KL203-01。
1.2 纳入与排除标准
1.2.1 纳入标准:(1)我院病理证实为食管癌的患者;(2)术前未接受过新辅助治疗的患者;(3)临床资料齐全的患者。
1.2.2 排除标准:(1)同时有癌症或其他恶性肿瘤病史;(2)术前接受过新辅助治疗;(3)有急性或慢性的炎症性疾病;(4)有贫血或其他血液系统疾病;(5)术前接受过抗凝治疗或输注过白蛋白;(6)既往肝功能异常或合并其他肝脏疾病;(7)临床及病理资料不完整。
1.3 方法
1.3.1 病理资料: 收集患者的肿瘤信息(包括肿瘤部位、分化程度、神经/脉管浸润、最大肿瘤直径、转移淋巴结数量等)。依据患者病理信息,按照国际抗癌联盟(UICC)/AJCC颁布的TNM分期标准[15]将患者分为Ⅰ期50例,Ⅱ期84例,Ⅲ期37例,Ⅳ期31例。
1.3.2 血样资料: 所有患者禁食8 h,于次日晨空腹抽取肘部静脉血,并采集血检测中性粒细胞、淋巴细胞、白蛋白、前白蛋白,碱性磷酸酶、纤维蛋白原及消化道肿瘤标志物(CEA、CA19-9),健康对照组收集体检中心的同等指标,并计算出AAPR、NLR、FPR。

2 结果
2.1 三组患者AAPR、FPR、NLR及肿瘤标志物等指标的比较先采用Kruskal WallisH检验分析相关指标,结果显示,三组患者AAPR、FPR、NLR、CEA、CA199水平比较,差异均有统计学意义(P<0.05),进而对两两指标用Nemenyi法比较,结果显示,食管癌组FPR、NLR、CEA、CA19-9水平均明显高于健康对照组和食管良性疾病组,差异均有统计学意义(P<0.05),食管良性疾病组与健康对照组FPR、NLR、CEA、CA19-9水平比较,差异均无统计学意义(P>0.05)。食管癌组AAPR水平明显低于健康对照组和食管良性疾病组,且食管良性疾病组明显低于健康对照组,差异有统计学意义(P<0.05)(见表1)。

表1 各组AAPR、FPR、NLR、CEA、CA19-9比较 [M(P25,P75)]
2.2 AAPR、FPR、NLR与食管癌患者临床病理特征的相关性分析不同临床分期、肿瘤部位、肿瘤直径、浸润深度、淋巴结转移、神经/脉管侵犯与AAPR、FPR、NLR水平的相关性分析结果显示,AAPR、FPR与临床分期、肿瘤直径、浸润深度、淋巴结转移有明显相关性(P<0.05),FPR与淋巴结转移临床分期、肿瘤直径、浸润深度、分化程度、神经/脉管侵犯有明显相关性(P<0.05),而两者均与肿瘤部位无相关性(P>0.05);NLR与临床分期、肿瘤部位、肿瘤直径、浸润深度、淋巴结转移、神经/脉管侵犯无相关性(P>0.05)(见表2)。根据我们的数据显示,随着淋巴结转移、浸润深度加深、肿瘤最大直径增加、临床分期增加,食管癌患者AAPR的中位数显著降低,FPR的中位数显著升高。
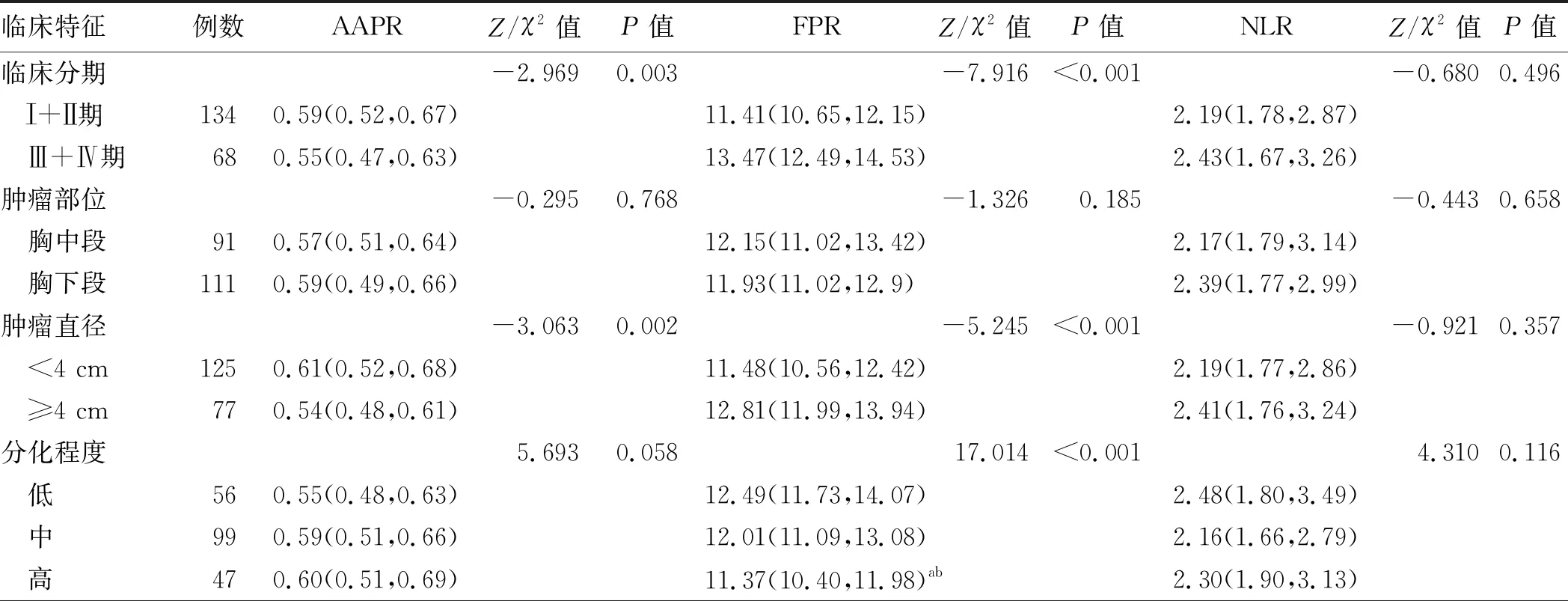
表2 AAPR、FPR、NLR与食管癌患者临床病理特征的相关性分析[M(P25,P75)]

续表2
2.3 AAPR、FPR、NLR对食管癌的诊断价值分析结果显示,AAPR有最高的诊断效率,其曲线下面积为0.838,显著高于FPR、NLR、CA19-9(0.699、0.697、0.623),差异有统计学意义(P<0.05)。AAPR的最佳截断值为0.654(灵敏度为77.9%,特异度为75.2%)。FPR和NLR的最佳截断值分别为10.27(灵敏度为87.1%,特异度为45.1%)和1.771(灵敏度为76.2%,特异度为58.8%)(见表3、图1)。

表3 食管癌的生物标志物在健康对照组和食管良性疾病组中的诊断价值分析

图1 炎症标志物在食管癌的诊断价值:食管癌组与健康对照组的ROC曲线
2.4 食管癌与食管良性疾病鉴别的危险因素分析以患者是否食管癌为因变量(是=1,否=0),以CEA、CA19-9、AAPR、FPR、NLR为自变量,采用进入法建立二元Logistic回归模型。结果显示,AAPR、NLR、CEA在模型中差异均有统计学意义(P<0.05),其中CEA、NLR均为食管癌发生的危险因素(OR>1),AAPR为影响食管癌发生的保护因素(OR<1)(见表4)。

表4 食管癌与食管良性疾病鉴别的危险因素分析
2.5 评价单一生物标志物或联合标志物对食管癌与食管良性疾病鉴别诊断的价值在食管癌与食管良性疾病的鉴别诊断中,AAPR、FPR、NLR、CEA、CA19-9的最佳截断值分别为0.645、10.18、1.913、2.62 ng/ml、7.285 U/ml,根据表3及图2显示,AAPR、FPR、NLR、CEA、CA19-9用于食管癌与食管良性疾病鉴别诊断的灵敏度分别为61.3%、88.1%、67.8%、71.8%、62.9%;特异度分别为72.8%、54.8%、58.8%、72.4%、43.2%;AAPR、FPR、NLR、CEA、CA19-9诊断食管癌的曲线下面积分别为0.727、0.692、0.654、0.760、0.628,差异均有统计学意义(P均<0.05)。各指标与AAPR诊断食管癌的曲线下面积经Z检验结果显示,AAPR曲线下面积明显高于NLR、CA19-9。
由表1、表3及图2可知,AAPR是鉴别食管癌与食管良性疾病最佳的生物标志物,因此我们利用ROC曲线分析AAPR+CEA、AAPR+CA19-9、AAPR+FPR、AAPR+NLR、AAPR+FPR+NLR、AAPR+CEA+CA19-9、AAPR+FPR+NLR+CA19-9+CEA等组合对食管癌与食管良性疾病的鉴别诊断价值,结果显示,AAPR、FPR、NLR、CEA、CA19-9联合可获得最大的诊断效率(AUC为0.830,灵敏度为79.2%,特异度为71.4%)。此外,AAPR、CEA、CA19-9联合诊断的效率是仅次于AAPR、FPR、NLR、CEA、CA19-9的联合诊断,差异有统计学意义(P<0.05),其ROC曲线下的面积为0.821,灵敏度为82.7%,特异度为66.8%(见图3)。
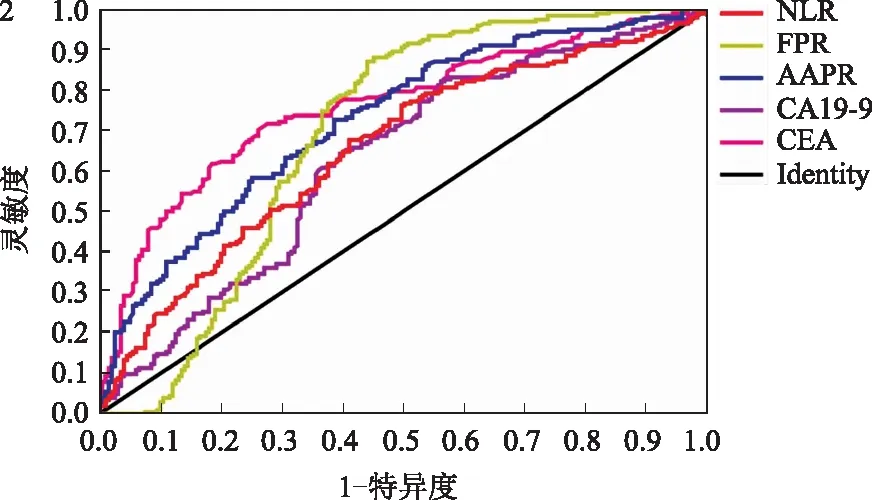
图2 炎症标志物对食管癌的诊断价值:食管癌组与食管良性疾病的ROC曲线; 图3 生物标志物的联合在食管癌组和食管良性疾病组的ROC曲线
3 讨论
无论是由于特定的感染还是异常的免疫反应机制,慢性炎症都与恶性肿瘤的发生、发展、侵袭及转移密切相关。持续性慢性炎症可以通过引起DNA的损伤,促进或影响癌症发生的易感性,从而引起组织的修复与增殖,促进正常组织向肿瘤的转变[16-17]。细胞增殖本身不会导致癌症,但持续的增殖发生在富含炎症因子、活化因子以及DNA损伤促进剂的肿瘤微环境中,就有促进肿瘤发生的风险[18]。食管癌的发生发展同样依赖炎症的“催化”,食管腺癌的发生与Barrett食管密切相关,Barrett食管是指食管下段的复层鳞状上皮被化生的单层柱状上皮所替代的病理现象,而Barrett柱状上皮化生的发生可归因于长期胃食管反流引起的慢性炎症性损伤[19-21]。多项研究[6-8]已经表明,如FPR、NLR、PLR、LMR在内的多项炎性标志物已经广泛用于结直肠癌、肾癌、肺癌、胃癌等多系统恶性肿瘤的诊断及预后,而AAPR在食管癌中诊断价值的研究尚缺乏。
我们首次探讨了AAPR在食管癌临床诊断中的作用。结果显示与食管良性疾病组、健康对照组比较,食管癌组患者的FPR、NLR均显著升高,而AAPR显著降低,这表明AAPR、FPR、NLR对于食管癌与食管良性疾病及健康人群的初步鉴别有一定的临床价值。AAPR在食管癌组与健康对照组的鉴别中特异度75.2%,截断值为0.654,而在与食管良性疾病鉴别中的特异度为72.8%,截断值为0.645,曲线下面积及特异度均显著高于FPR及NLR。这表明,当我们发现临床患者血检的AAPR低于0.645时,就高度提示需进一步完善食管癌相关检查。此外,我们发现AAPR、FPR等生物标志物与病理资料中肿瘤进展转移相关因素(瘤体直径、转移淋巴结数量、分化及浸润程度)有显著相关性。我们的分析结果还发现,NLR、FPR及消化道肿瘤指标对早期食管癌的诊断同样有着不小的作用,因此AAPR与其他指标联合可有效区分食管癌与食管良性疾病,其中AAPR联合FPR、NLR、CEA、CA19-9有较好的诊断价值。
前文得出的结果可能有两方面的原因。一方面,低蛋白血症是炎症、抑制性细胞因子(IL-6等),以及肿瘤患者蛋白质摄入不足的综合作用的结果,而白蛋白可以促进DNA的复制、促进细胞增殖和调节免疫反应[22],在肿瘤发生过程中也起着抗氧化作用[9]。因此,减少的白蛋白可能反映了营养缺乏,这将导致癌症患者抗癌反应差和免疫功能下降[22],所以低白蛋白血症与不良的预后及癌症病理类型之间的关联可以通过肿瘤更具有侵略性的生物学行为来解释,进而导致不良的体液及细胞免疫反应[23],而这与肿瘤的复发和预后密切相关。另一方面,碱性磷酸酶广泛存在于人体组织和体液,但尤其集中于肝脏、骨骼、肠中。它可以通过肝脏排出,使各种类型的分子去磷酸化。最新的文献表明[24-25],ALP可以通过嘌呤能信号传导在炎症中起重要作用,从而导致炎症信号传导的停止并引起抑制性免疫反应,ALP的升高意味着强烈的全身炎症反应。同时,ALP升高的患者从强化治疗中获益比标准治疗更多。此外,ALP还可以在癌细胞中高表达,可以调节肿瘤的生长[26]。
尽管白蛋白/前白蛋白和碱性磷酸酶异常是癌症患者中有据可查的预后及诊断指标,但并非是所有癌症患者均患有白蛋白/前白蛋白缺乏和碱性磷酸酶过多。有一些患者仅有白蛋白/前白蛋白缺乏症或只有碱性磷酸酶过量,因此,我们使用比率指数AAPR评估白蛋白和碱性磷酸酶的综合水平,是机体炎症和营养状况更全面的反馈[27]。
综上所述,AAPR作为机体炎症与营养情况的反应,对食管癌诊断有一定的临床价值。较低的AAPR值高度提示临床医师需进一步做针对性的检查,而与其他生物指标联合如CEA、CA19-9、FPR、NLR能更有效区分食管癌与食管良性疾病。在与临床病理特征的相关性研究中,而AAPR同样与最大瘤体直径、转移淋巴结数量、浸润程度等有显著相关性,这也为临床进一步的新辅助治疗提供指导。更重要的是AAPR来源于临床上常规的生化检查,经济而高效,同样为今后食管癌的筛查提供了新的方向。本研究为单中心小样本的回顾性研究,还需要开展多中心、大样本的前瞻性研究以验证我们的结论。

