结合虚拟单像素成像解卷积的双边照明光片荧光显微技术*
胡金虎 林丹樱† 张炜 张晨爽 屈军乐 于斌‡
1) (深圳大学物理与光电工程学院,光电子器件与系统教育部/广东省重点实验室,深圳 518060)
2) (佛山职业技术学院机电工程学院,佛山 528137)
光片荧光显微术(light-sheet fluorescence microscopy,LSFM)采用薄片光束从侧面激发样品,在垂直于光片方向上进行成像,具有成像速度快、光学层析能力强以及光漂白和光毒性低等优点,适用于对较大活体生物样品进行高质量、长时间三维动态观测.然而,传统高斯光束LSFM存在分辨率低和成像视场小的问题.本文在双边照明LSFM的基础上,结合虚拟单像素成像解卷积技术,提出了一种大视场高分辨双边照明LSFM,实现了视场和分辨率的同时提升.设计和搭建了双边照明LSFM,开展了荧光珠和转基因斑马鱼样品的三维光切片显微成像实验,实验结果证明了系统的三维高分辨成像能力,对于大视场、高分辨LSFM的发展和应用具有重要意义.
1 引言
光片荧光显微术(light-sheet fluorescence microscopy,LSFM),也称选择性平面照明显微术(selective plane illumination microscopy,SPIM)[1],它采用激发光路与探测光路相互垂直的特殊设计,即利用薄片光束从侧面激发样品,并通过垂直光片方向的显微物镜和探测器获取照明层面的荧光图像,从而避免非成像平面的荧光信号干扰,实现厚样品的三维层析成像.与同样具有光学层析成像能力的共聚焦及双光子荧光显微成像技术相比,LSFM采用光片面照明宽场成像取代点扫描成像方式,成像速度快,样品受光照时间大幅缩短,光漂白和光毒性低,适用于对较大活体生物样品进行高质量、长时间三维动态观测.目前,LSFM已被广泛应用于细胞生物学、发育生物学和神经生物学等领域的研究[2].
早期LSFM或SPIM中的照明光片一般是由高斯光束通过狭缝和柱面镜聚焦产生的[3,4],能量利用率低,且光片沿传播方向的强度不均匀,容易受样品吸收和散射影响,光片有效照明深度有限,成像视场较小.Swoger等[5]和Krzic等[6]提出了双边照明LSFM,利用两个相反方向的高斯光片同时激发样品,成功减少了散射的影响,提升了照明深度,扩大了成像视场.2008年,Keller等[7]提出利用高斯光束快速扫描形成虚拟光片以进一步改善高斯光片的光强均匀性,不仅光能利用率高(可达95%),还可以生成多种类型的光片.但由于扫描速度很快,需要比静态高斯光片更高的峰值激发功率.随后LSFM研究进入一个高速发展阶段,各种新型的LSFM相继出现,并被广泛应用于斑马鱼、果蝇等模式生物的发育过程研究[8,9].
然而这些基于高斯光束的LSFM技术在应用于强散射的活体组织等厚样品成像时,其视场和分辨能力仍十分有限.为此,贝塞尔光束、艾里光束等无衍射光束被相继应用于产生数字扫描的照明光片并较好地解决了LSFM视场受限的问题[10−13].但无衍射光束光片存在旁瓣,会导致非焦平面的样品激发,既降低了成像质量,又增大了对样品的光毒性,因此需要设法消除其影响[14].此外,也有文献[15]报道了利用平铺拼接的方法实现了大视场成像.为了进一步提高LSFM的空间分辨率,研究人员还将LSFM与多种超分辨荧光显微术结合[16−23],以期实现对活体生物厚样品的超高时空分辨显微成像.例如,2014年,Betzig研究组[24]发明了晶格光片显微术(lattice light-sheet microscopy,LLSM),利用贝塞尔光学晶格大幅减小了光片厚度并抑制了旁瓣,提升了LSFM的层析能力和扫描速度,结合结构光照明超分辨技术,LLSM可成功以较高的时空分辨率研究活细胞内甚至活体组织内的动力学过程.然而,受生物样品散射影响,其典型的成像深度也只有20 µm,限制了在活体厚样品中的应用,且这种技术光学扫描系统复杂,不便推广应用.
综上,如何在保持LSFM成像速度快、光学层析能力强的优势基础上实现对厚样品的大视场、高分辨三维成像,仍然是LSFM发展及其推广应用面临的关键问题.研究和开发新型LSFM系统和方法,进一步提升其性能,使其更适用于活体厚样品的高分辨快速三维成像,对于生命科学和生物医学等领域的研究具有重要的意义.
本课题组在前期研究工作中提出了一种新的宽场超分辨成像解卷积算法,即虚拟单像素成像(virtual single-pixel imaging,v-SPI)[25]技术,采用数字结构光模板调制宽场荧光图像,并根据积分等量关系将虚拟调制图像转换为单像素成像数据,进而结合单像素图像重构技术获得宽场超分辨图像.v-SPI可将宽场荧光显微成像的横向分辨率提高2倍,与传统结构光照明显微术可相比拟,但由于只需采集单幅宽场图像,成像速度至少提高了9倍.在此基础上,本文提出了基于v-SPI的大视场高分辨双边照明LSFM (dual-sided illumination LSFM,dLSFM)成像方法和系统,实现了传统高斯光束LSFM视场和分辨率的同时提升.设计和搭建了dLSFM系统,开展了荧光珠和斑马鱼样品的三维光切片显微成像实验,验证了系统的分辨率和视场;编制了v-SPI图像重构程序,实现了厚样品的高分辨光切片层析成像和三维图像重构;实验结果证明,系统具有同时提升LSFM视场和分辨率的能力,为高分辨率LSFM进一步发展及其在活体厚样品快速高分辨成像方面的应用提供理论和技术基础.
2 系统与方法
2.1 dLSFM系统设计与搭建
所搭建的双边LSFM系统示意图如图1所示.首先,波长为488 nm的固体激光器(Sapphire 488-200 CW CDRH,Coherent,)发出的激光束经透镜L1 (f1=25 mm)和L2 (f2=250 mm)扩束准直后经反射镜M1、分束镜BS分为两束:一束沿原方向传播,经狭缝MS1、柱透镜CL1聚焦后再经过照明物镜IO1(10×/NA0.3水镜,尼康)形成光片;另一束经反射镜M2,M3和M4后,经狭缝MS2和柱透镜CL2进入照明物镜IO2,形成另一侧的光片.其中,两路光中狭缝、柱透镜和物镜的参数和相对位置保持相同,且物镜的前焦面均要与柱透镜的后焦面重合,光片的厚度和宽度可通过改变狭缝的宽度来调节.这样,两束激发光以相反方向汇入样品池,生成的两束光片在同一焦面处对样品进行激发.样品产生的荧光信号通过探测物镜DO(40×/NA0.8水镜,尼康)、滤光片F和管镜TL,在高灵敏度sCMOS相机(ORCA-Fusion BT,像素数2304 × 2304,像素尺寸6.5 µm × 6.5 µm,滨松)上成像.样品固定在一个4D微米位移台(USB 4D-Stage,Picard Industries,)上,可在电机系统控制下实现X,Y,Z和R方向上的移动,实现成像区域的选择和轴向扫描三维成像.

图1 dLSFM 系统光路示意图Fig.1.Schematic diagram of the dLSFM system.
2.2 光片性能参数分析
光片的厚度和宽度决定了LSFM的轴向分辨率和视场,且二者相互制约,由照明物镜的等效数值孔径NAill决定.光片的厚度和宽度均随着NAill值的增大而减小,即系统轴向分辨率提升的同时成像视场变小.理想的LSFM成像要求光片厚度尽可能薄且强度均匀,因此如何生成厚度薄而视场大的光片一直以来都是LSFM追求的重要目标.本文所搭建的双边照明LSFM系统,与传统单边照明的高斯光束LSFM系统相比,能在保持光片厚度不变的情况下扩大系统的视场,还能通过改变狭缝的大小生成多种不同厚度和视场的光片,来适应不同的样品成像.在本文涉及的实验中,狭缝的宽度设置为6 mm,则相应的照明物镜NAill值为0.15.可利用均匀罗丹明溶液对光片的光学参数进行标定.此时需要将柱面镜旋转90°,使光片方向垂直于探测面,从侧面采集光片图像,结果如图2所示.对其强度分布进行高斯拟合,得到高斯光片束腰处的强度轮廓的半高宽(full width at half maximum,FWHM)厚度为1.9 µm,单边照明时视场为53.8 µm,双边同时照明时在光片厚度不变的情况下视场为106.3 µm,近似为单边照明时的2倍.

图2 用于厚度和宽度标定的光片侧视图 (a) 通道I单边照明时的光片;(b) 双边照明时的光片;(c) 通道II单边照明时的光片Fig.2.Side view images of light sheet for thickness and width calibration:(a) Single-sided illumination with the path I;(b) dualsided illumination;(c) single-sided illumination with path II.
2.3 超分辨图像重构方法
在宽场荧光显微成像中,常用解卷积技术来滤除非焦面背景荧光噪声,进而提高焦面图像的对比度.与传统的解卷积方法相比,v-SPI方法除了提高图像对比度,还可以显著提高图像的分辨率,实现单帧宽场图像的超分辨重构[25].其基本原理基于如下积分等量关系:
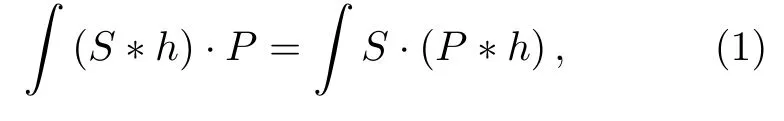
其中S为理想像(对应样品的真实分布),h为系统的点扩散函数,∗表示卷积运算,因此S∗h为宽场图像;P为虚拟数字模板,⋅表示点积运算,(S∗h)·P表示对宽场图像进行虚拟调制.
v-SPI技术首先采用虚拟数字模板调制普通宽场荧光图像,然后根据该积分等量关系将虚拟调制图像转换为单像素成像数据,再结合单像素图像重构技术实现超分辨图像的重构.根据采集的荧光图像、数字模板和系统点扩散函数计算出积分值和卷积模板.因此,可以采用SPI方程求解方法重构出待求的样品分布.在实际样品重构过程中使用的是简单数字模板,每个模板上仅有一个像素亮度轮流设置为1,其余像素亮度设置为0.在本文中,v-SPI技术被用于改善dLSFM系统的空间分辨率,从而达到同时提升LSFM视场和分辨率的目的.
3 成像结果与讨论
3.1 系统分辨率标定
为了验证dLSFM系统的成像能力,以直径100 nm的荧光珠为样品对该系统的分辨率进行标定.在实验之前,首先,利用体积浓度为1%的琼脂糖溶液将原始荧光珠溶液(TetraSpeckTM微球,0.1 µm,1.8 × 1011个/mL,ThermoFisher)稀释200倍左右,摇匀以后将混合溶液吸入到氟化乙烯丙烯(FEP)细管(外径为1.6 mm,内径为0.8 mm)中,在室温下放置5 min左右,混合溶液成凝胶状态,然后将FEP浸入到充满水的样品池中,从FEP中推出荧光珠凝胶,对荧光珠进行成像,结果如图3所示.选取视场范围内的若干荧光珠图像进行分析和统计,以每个荧光珠强度分布曲线的FWHM作为其尺寸并进行统计分析(N=25),以其平均值表征系统的横向分辨率(这里以X方向的分辨率为例).荧光珠尺寸的统计直方图如图3(b)和图3(d)所示,其中前者为未采用v-SPI技术处理的结果,荧光珠直径的平均值为407 nm±14 nm,后者为利用v-SPI处理后的结果,荧光珠直径的平均值减小为300 nm±15 nm.可见,双边照明LSFM系统获取的光片荧光显微图像经v-SPI技术处理后,横向分辨率提升了约26%.
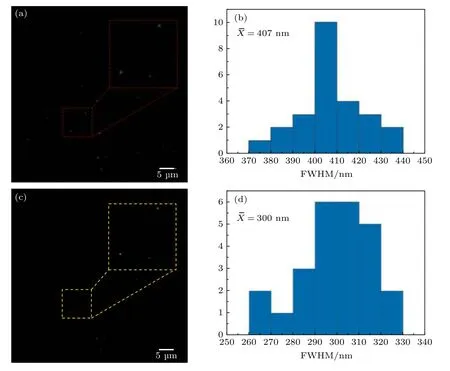
图3 用于系统成像分辨率标定的直径100 nm荧光珠图像及其尺寸统计直方图 (a) 未经v-SPI处理的图像;(b) 图(a)中荧光珠沿X方向强度曲线FWHM的直方图分布(N=25);(c) 经v-SPI处理的图像;(d) 图(c)中相同荧光珠沿X方向强度曲线FWHM的直方图分布;为平均值Fig.3.Images of 100-nm-diameter fluorescent beads for system resolution calibration:(a) Image without v-SPI processing;(b) the corresponding histogram distribution of the intensity profile FWHM from 25 fluorescent beads in X direction;(c) image with v-SPI processing;(d) the corresponding FWHM histogram distribution from the same beads in X direction; is the average value.
3.2 成像视场验证
为了验证双边照明LSFM系统的成像视场,选用心血管特异标记的转基因斑马鱼(CZ62,s843 Tg/+,Tg(kdrl:EGFP),国家斑马鱼资源中心)作为实验样品进行成像.图4所示为斑马鱼心脏附近血管结构的成像结果,其中图4(a)为通道I成像结果,图4(b)为双通道成像结果,图4(c)为通道II成像结果.从图4中可以可出,单通道成像,即采用单边照明时,由于样品的散射,照明光束的穿透深度有限,成像视场受限;而双边照明可以成倍地增加穿透深度,扩大了系统的成像视场.
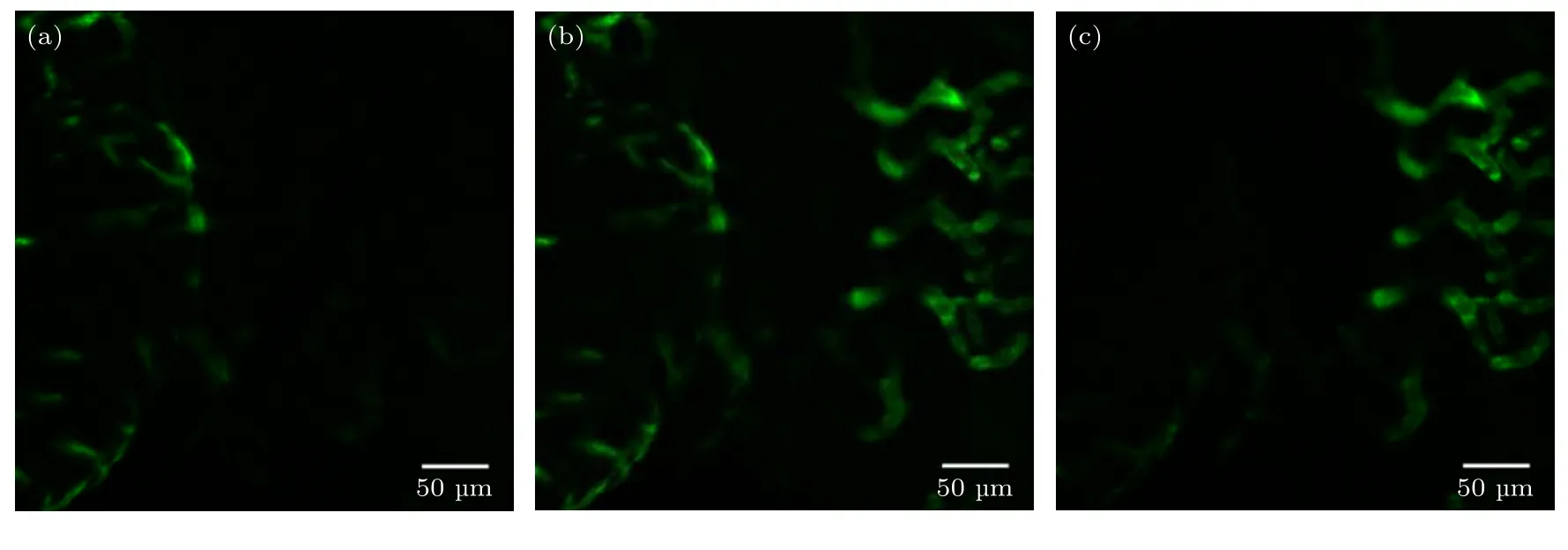
图4 斑马鱼血管结构的大视场成像 (a) 通道I单边照明成像;(b) 双边照明成像;(c) 通道II单边照明成像Fig.4.Large FOV imaging of vascular structures in a zebrafish:(a) Single-sided illumination imaging with path I;(b) dual-sided illumination imaging;(c) single-sided illumination imaging with path II.
进一步地,通过比较双边照明LSFM系统获取的大视场生物样品图像在经过v-SPI技术处理前后的效果,验证本文所提技术在同时提升视场和分辨率方面的能力,结果如图5所示.实验样品为神经系统特异性标记的转基因斑马鱼(CZ79,ml3Tg/+,Tg(mnx1:mGFP),国家斑马鱼资源中心).图5(a)为dLSFM系统采集的未经特殊处理的原始图像,图5(b)为采用传统Richardson-Lucy(RL)解卷积算法处理的图像,图5(c)为采用v-SPI算法处理的图像,图5(d)为对三个图像中划线的同一位置的归一化强度曲线.对比图像(图5(c))和强度曲线(图5(d))可以明显看出,双边照明LSFM系统获取的大视场生物样品图像经v-SPI技术处理后,图像的对比度和分辨率均得到明显提升,且效果比传统RL算法更好.该结果同时也和前文100 nm荧光珠的分辨率标定结果相符合.可见,结合了v-SPI技术的双边照明LSFM,可以在实现大视场成像的前提下获得较高的分辨率,即同时实现LSFM视场和分辨率的提升,适合用于较厚生物样品的成像.
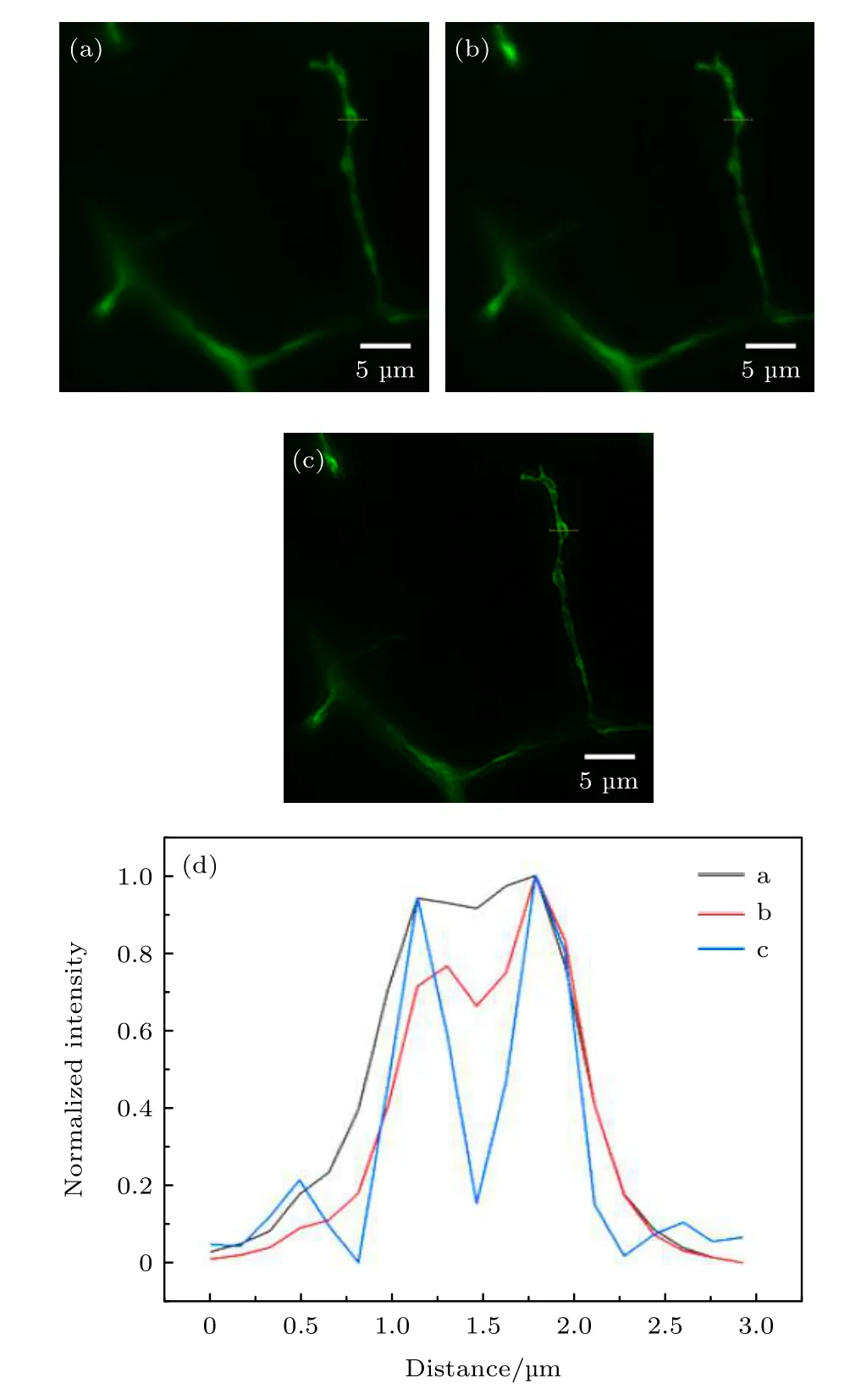
图5 斑马鱼运动神经元成像(a)未经特殊处理的图像;(b)RL解卷积处理的图像;(c) v-SPI处理图像;(d) 图(a)−(c)中黄色色实线标记位置的归一化强度曲线Fig.5.Images of motoneurons in a zebrafish:(a) Image without special processing;(b) image with RL deconvolution;(c) image with v-SPI processing;(d) normalized intensity profiles along the yellow solid lines in panels (a)−(c).
3.3 厚样品三维成像
为了验证系统对厚样品的三维成像能力,利用上述神经系统特异标记的转基因斑马鱼作为样品进行成像,通过微米位移台的轴向移动采集运动神经元的光切片数据并进行三维重构.采集间隔为1 µm,共采集20幅源图像进行三维重构,结果如图6所示,其中图6(a)—(c)为不同采集深度的二维图像,图6(d)和图6(e)为三维重建后不同视角的效果图.所有图像均已用v-SPI技术进行处理.
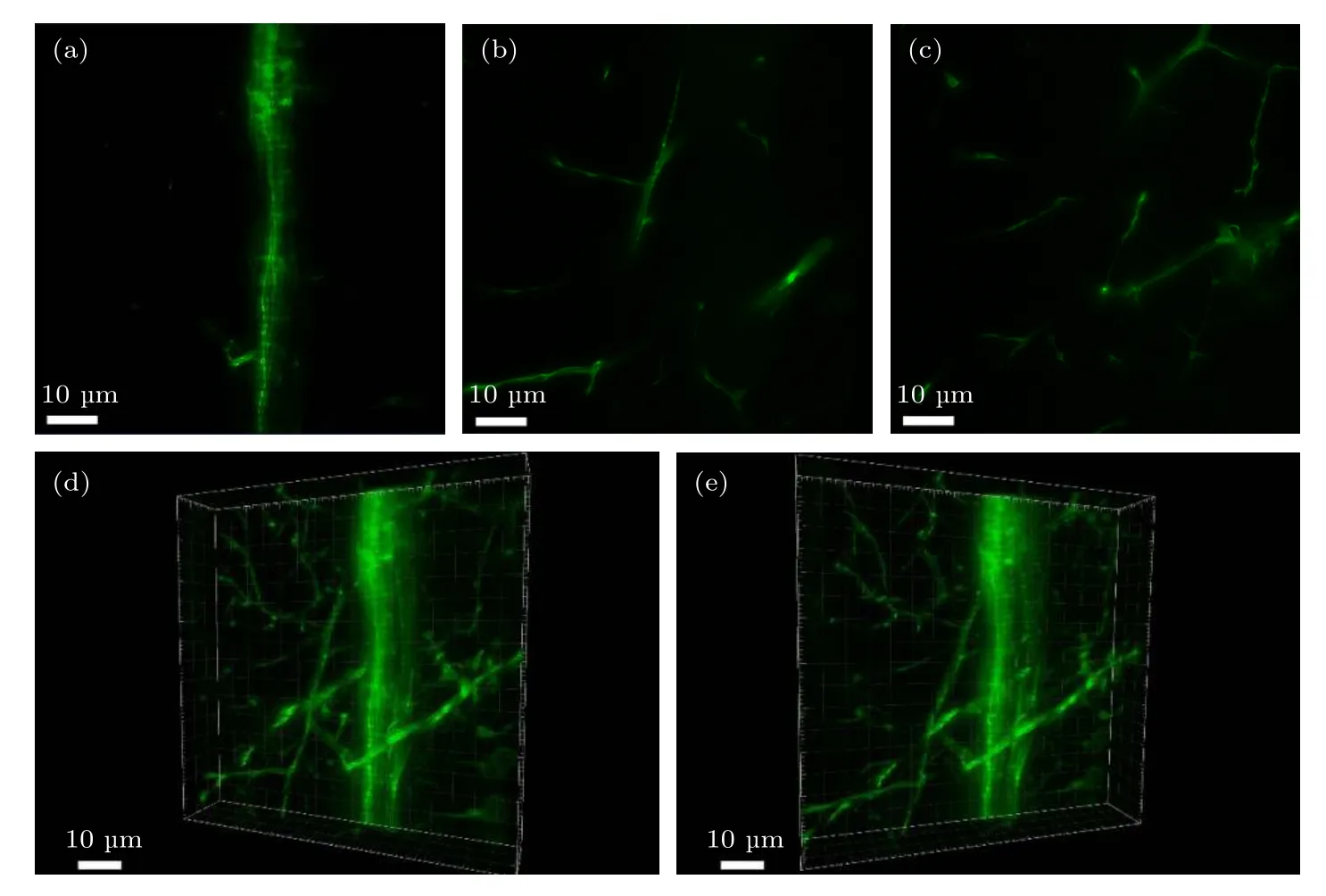
图6 斑马鱼运动神经元的三维成像 (a)−(c) 不同轴向位置拍摄的图像;(d),(e)三维重建效果图Fig.6.Three-dimensional imaging of motoneurons in a zebrafish:(a)−(c) Images from different axial positions;(d),(e) three-dimensional reconstruction renderings.
4 结论
本文将双边照明光片荧光显微技术与虚拟单像素成像技术相结合,发展了一种大视场高分辨光片荧光显微成像技术,相比传统高斯光束LSFM,可将视场扩大至原来的两倍(达到约100 µm),同时可将系统横向分辨率提升约26%,并实现了对斑马鱼等较大生物样品的三维高分辨率层析成像,为进一步开展活体生物样品快速高分辨成像以及生物样品的超分辨成像奠定了基础.

