银黄口服液制备过程中绿原酸含量稳定性考察*
冯 倩,张洪亮,庄华青,沈庆国,孙 艳,关永霞Δ,张贵民
(1.鲁南厚普制药有限公司,山东 临沂276006;2.中药制药共性技术国家重点实验室,山东 临沂 276006)
银黄口服液是以金银花和黄芩提取物为原料制成 的中药口服制剂,可用于治疗风热感冒所致咽干、咽痛、上呼吸道感染等证[1−3],主要成分为黄酮类、挥发油、三萜皂苷类、无机元素、有机元素[4−5]。绿原酸为金银花提取物中最重要的有效成分,具有抗菌消炎作用,是银黄口服液质量控制的指标性成分[6]。绿原酸是由咖啡酸和奎尼酸组成的酯类化合物,其分子结构中含有酯键、不饱和双键、多元酚羟基等不稳定化学键[7],具有清热解毒作用,能有效抑制大肠杆菌、金黄色葡萄球菌的生长增殖[8−9]。在银黄口服液的制备过程中,绿原酸往往会发生水解和异构化,导致含量显著下降。本研究中以2015年版《中国药典(一部)》中银黄口服液制备工艺为基础,优选了银黄口服液的制备工艺,并考察了制备过程中绿原酸含量的稳定性,以提高其绿原酸的含量。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1100型高效液相色谱仪(美国安捷伦公司);SENCOR501型旋转蒸发仪(上海申顺生物科技有限公司);Himac CR−GⅢ型系列高速离心机(天美科学仪器有限公司);ME1002型电子天平(瑞士梅特勒−托利多有限公司,精度为十万分之一);DRHH−S6型数显恒温水浴锅(上海双捷实验设备有限公司)。
1.2 试药
金银花(鲁南厚普制药有限公司,批号为20180602),经山东中医药大学李宝国副教授鉴定为忍冬科植物杀青干燥的花蕾;绿原酸对照品(中国食品药品检定研究院,批号为111720−201708,纯度为98.7%);新绿原酸对照品(批号为MUST−17100201,纯度为98.4%),隐绿原酸对照品(批号为MUST−18110603,纯度为98.6%),均购于成都曼思特生物科技有限公司;甲醇为色谱纯,水为二次蒸馏水,其他试剂均为分析纯。
2 方法与结果
2.1 绿原酸、隐绿原酸、新绿原酸含量测定
2.1.1 色谱条件
色谱柱:Aglient Zorbax SB−C18柱(250 mm×4.6 mm,5µm);流动相:乙腈−0.4%磷酸溶液(10∶90,V/V);流速:1 mL/min;柱温:30℃;检测波长:327 nm;进样量:5µL。
2.1.2 溶液制备[10]
取绿原酸、隐绿原酸、新绿原酸对照品各1.50 mg,精密称定,置50 mL棕色容量瓶中,加50%甲醇适量,超声溶解并定容,得质量浓度为0.03 mg/mL的混合对照品溶液。
取黄芩提取物[按2015年版《中国药典(一部)》工艺制备],加水适量使溶解,用8% NaOH溶液调pH至8.0,滤过,滤液与金银花提取物[按2015年版《中国药典(一部)》工艺制备]合并,用8% NaOH溶液调pH至7.2,煮沸60 min,滤过,加单糖浆适量,加入适量饮用水,混匀,用8%NaOH溶液调pH至7.2,加水至1 000 mL,滤过,灌封得100支。经100℃蒸汽灭菌30 min,即得样品(自拟批号为190725−2)。
2.1.3 方法学考察
专属性试验:分别精密移取2.1.2项下混合对照品溶液1.0,2.0,3.0,5.0,7.0,10.0 mL,置10 mL容量瓶中,加50%甲醇定容,混匀;吸取2.1.2项下样品溶液5 mL,加水定容至100 mL容量瓶中,经0.45µm微孔滤膜滤过。精密吸取上述溶液各5µL,按2.1.1项下色谱条件进样测定,样品溶液色谱图中,有与混合对照品溶液对应的色谱峰出现。色谱图见图1。

1.新绿原酸2.绿原酸3.隐绿原酸A.混合对照品溶液B.样品溶液图1专属性试验高效液相色谱图1.Neochlorogenic acid 2.Chlorogenic acid 3.Cryptochlorogenin acidA.Mixed reference solution B.Sample solutionFig.1 HPLC chromatograms of the specificity test
精密度试验:取同一批(批号为190725−2)样品,按2.1.1项下色谱条件于第1,2,3天分别测定6次,绿原酸、新绿原酸、隐绿原酸日内精密度保留时间的RSD分别为1.78%,1.92%,1.59%(n=6),峰面积的RSD分别为2.21%,1.82%,2.09%(n=6);日间精密度保留时间的RSD分别为1.43%,1.84%,2.34%(n=6),峰面积的RSD分别为1.98%,2.56%,2.13%(n=6)。结果表明,仪器精密度良好。
稳定性试验:取同一批(批号为190725−2)样品,分别于4,8,12,16,20 h时进样测定。结果绿原酸、新绿原酸、隐绿原酸保留时间的RSD分别为1.39%,2.43%,2.89%(n=5),峰面积的RSD分别为1.90%,2.18%,2.71%(n=5),表明样品溶液在20 h内稳定性良好。
重复性试验:取同一批(批号为190725−2)样品,按2.1.1项下色谱条件进样测定。结果绿原酸、新绿原酸、隐绿原酸保留时间的RSD分别为2.89%,2.56%,2.19%(n=6),峰面积的RSD分别为2.32%,2.43%,2.71%(n=6),表明方法重复性良好。
2.2 银黄口服液制备过程中绿原酸稳定性研究
2.2.1 金银花提取物制备中绿原酸含量变化
取金银花药材40.0 kg,按2.1.1项下色谱条件进样测定其绿原酸含量为3.0 %,均分为4批(分别编号为01,02,03,04),每批药材分别用10倍量和8倍量15%乙醇回流提取2次,合并提取液;减压浓缩至相对密度为1.16的浓缩液;用95%乙醇调节醇度至65%,静置24 h后用滤纸滤过,得醇沉液;加水至7.5 kg,得供配液。分别吸取上述提取液、浓缩液、醇沉液和供配液,按2.1.1项下色谱条件进样测定绿原酸的含量。详见图2。
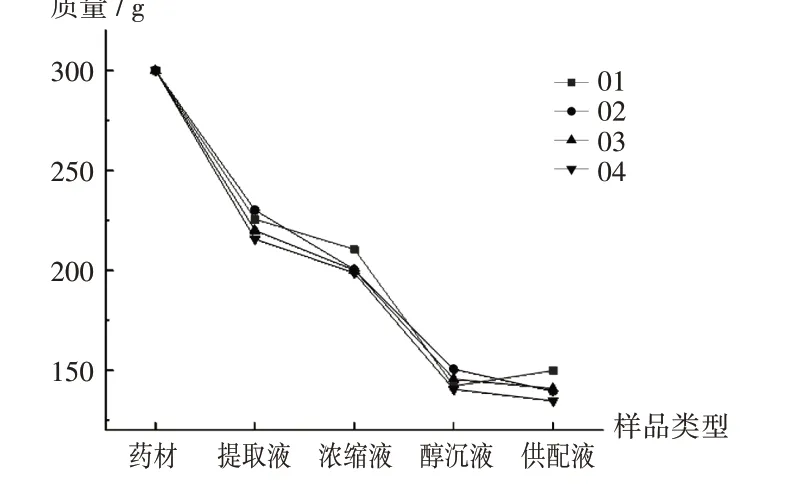
图2 不同溶液绿原酸质量Fig.2 Quality of chlorogenic acid in different solutions
在金银花提取物制备过程中,绿原酸平均提取率为73.91%,浓缩液平均转移率为67.83%,绿原酸在提取和浓缩过程中较稳定。醇沉液中绿原酸的总量为药材的48.03%,与浓缩液相比,绿原酸损失率为29.20%,主要原因为沉淀中吸附大量绿原酸。供配液(编号为01)的绿原酸总含量高于醇沉液,可能原因为绿原酸向异构体的转化具有可逆性。
2.2.2 不同pH条件下煮药对绿原酸含量的影响
取黄芩提取物1.2 kg,按2015年版《中国药典(一部)》工艺,加水溶解,用8%NaOH溶液调pH至8.0,滤过,滤液备用;取样品(编号为01)适量,依法制备金银花提取物供配液5 kg,与上述滤液混合,均分为5份,分别用8% NaOH溶液调pH至5.6,6.0,6.5,7.0,7.2,煮沸1 h,分别测定其在调节pH前和煮药后的绿原酸、隐绿原酸、新绿原酸含量变化。详见图3。可见,绿原酸和总绿原酸的含量随pH升高而降低,新绿原酸和隐绿原酸的含量随pH升高而升高,表明pH升高,有利于绿原酸转化为新绿原酸和隐绿原酸,且绿原酸的水解程度加大。调节pH至5.6时,黄芩提取物部分析出,黄芩苷稳定性好,pH对黄芩苷的含量影响较小,故煮药前调节药液pH至6.0。

图3 不同pH条件下煮药对绿原酸含量的影响Fig.3 Effect of decocting medicinal herbs at different pH on the chlorogenic acid content
2.2.3 不同煎煮时间对绿原酸含量的影响
取黄芩提取物1.8 kg,加水溶解,用8%NaOH溶液调pH至8.0,滤过,滤液备用;取样品(编号为02),依法制备金银花提取物供配液7.5 kg,与上述滤液混合,用8%NaOH溶液调pH至6.0,均分为5批,每批3份,分别煎煮30,45,60,75,90 min,测定绿原酸含量,并计算平均转移率。详见图4。可见,煮药时间为30 min和60 min时的绿原酸平均转移率相差3.98%,煮药时间为60 min和90 min时的绿原酸转移率相差1.87%,表明绿原酸转移率随着煎煮时间的延长而降低,即水解和异构化的速率降低,故煎煮时间确定为30 min。

图4 不同煎煮时间的绿原酸转移率变化Fig.4 Changes of chlorogenic acid content at different decoction time
2.2.4 不同灭菌方式对绿原酸含量的影响
取黄芩提取物1.8 kg,加水溶解,用8%NaOH溶液调pH至8.0,滤过,滤液备用;取样品(编号为03),依法制备金银花提取物供配液,与上述滤液混合,用8%NaOH溶液调pH至6.0,煎煮30 min,滤过,加单糖浆适量,加饮用水适量,搅匀,用8%NaOH溶液调pH至7.2,补水至6 000 mL,滤过,灌封得600支样品,均分为8份,采用0.1%苯甲酸钠+0.1%苯甲酸、80℃水浴60 min、100℃水浴30 min、100℃蒸汽30 min进行灭菌。灭菌后自然冷却,分别测定其绿原酸、新绿原酸、隐绿原酸的含量。详见图5。可见,0.1%苯甲酸钠+0.1%苯甲酸灭菌后,绿原酸和新绿原酸平均转移率分别为96.23%和102.12%;100℃蒸汽灭菌30 min,绿原酸和新绿原酸平均转移率分别为85.21%和112.01%。结果表明,灭菌条件越剧烈,绿原酸转移率越低,新绿原酸转移率越高;不同灭菌方式下,总绿原酸和隐绿原酸转移率变化均较小,提示灭菌过程中绿原酸水解程度较轻,灭菌过程中绿原酸损失的主要原因为其异构化为新绿原酸。

a.0.1%苯甲酸钠+0.1%苯甲酸b.80℃水浴60 min c.100℃水浴30 min d.100℃蒸汽30 min图5不同灭菌方式对绿原酸转移率的影响a.0.1% Sodium benzoate+0.1% Benzoic acid B.80℃Water bath for 60 min C.100℃Water bath for 30 min D.100℃Steam for 30 minFig.5 Effect of different sterilization methods on the transfer rate of chlorogenic acid
2.3 稳定性试验
取2.2.4项下灭菌后的样品,于温度(40±2)℃、相对湿度(75±5)%环境下进行6个月加速试验,验证灭菌后样品的稳定性。结果见表1。可见,经0.1%苯甲酸钠+0.1%苯甲酸灭菌的样品在6个月加速试验后,其需氧菌总数超标;其他3种灭菌方式的需氧菌总数,霉菌、酵母菌总数,大肠埃希菌含量均符合检验标准。由图5可知,与其他2种灭菌方式相比,采用80℃水浴60 min方案灭菌,绿原酸转移率较高,水解和异构化程度均较轻,且灭菌后微生物限度检验合格,可更好保证灭菌后的药效。

表1 加速试验后不同灭菌方式微生物限度检查结果Tab.1 Microbial limit test results of different sterilization methods after the accelerated test
2.4 法定工艺与优化工艺绿原酸总转移率测定
取黄芩提取物1.8 kg,加水溶解,用8%NaOH溶液调pH至8.0,滤过,滤液备用;取样品(编号为04),依法制备金银花提取物供配液,与上述滤液混合,均分为法定工艺组和优化工艺组。优化工艺组采用优化工艺制备,均分为3份,每份分别用8% NaOH溶液调pH至6.0,煮沸30 min,滤过,加单糖浆适量,加饮用水适量,搅匀,用8% NaOH溶液调pH至7.2,补水至1 000 mL,滤过,灌封得100支样品,80℃水浴60 min灭菌;法定工艺组采用2015年版《中国药典(一部)》工艺制备,均分为3份,每份分别用8% NaOH溶液调pH至7.2,煮沸60 min,滤过,加单糖浆适量,加饮用水适量,搅匀,用8% NaOH溶液调pH至7.2,补水至1 000 mL,滤过,灌封得100支样品,100℃蒸汽灭菌30 min。分别测定每份药液调pH前和灭菌后的绿原酸含量。采用SPSS 24.0统计学软件分析,计数资料以率(%)表示,组间比较行t检验,P<0.05为差异有统计学意义。详见图6。可见,与法定工艺组比较,优化工艺组总转移率提高了24.95%,差异显著(P<0.05),表明优化工艺能有效抑制绿原酸的水解和异构化,提高银黄口服液中绿原酸的含量。

图6 法定工艺与优化工艺条件下的绿原酸转移率(n=3)Fig.6 The transfer rate of chlorogenic acid under the statutory process and optimal process conditions(n=3)
3 讨论
在3批金银花提取物制备过程中,供配液(样品编号为01)的绿原酸总含量略高于醇沉液,可能原因为部分新绿原酸和隐绿原酸逆转化为绿原酸。在煎煮和灭菌阶段,由于pH和温度升高,绿原酸除部分水解外,主要被氧化为还原性较弱的新绿原酸和隐绿原酸。与煎煮和灭菌前相比,绿原酸和总绿原酸转移率均减少,新绿原酸和隐绿原酸转移率均升高。故在银黄口服液制备过程中,适当调低药液pH,减少煎煮时间,可有效减少绿原酸的氧化;而适量加入抗坏血酸、酒石酸、L−半胱氨酸等还原性药品添加剂,以抑制绿原酸氧化和水解,提高绿原酸含量的可行性有待进一步研究。
绿原酸具有广谱抑菌效果,能有效抑制细菌及部分真菌的生长繁殖,其抑菌活性明显优于新绿原酸和隐绿原酸[11−12]。在样品制备过程中,绿原酸损失的主要原因为异构化,次要原因为在碱性环境下易水解。由图3至图5可知,在弱酸条件下,绿原酸的异构化反应程度较小;减少煎煮时间、采用温和且有效的灭菌方式,可抑制绿原酸的异构化反应。本研究中通过优化制备工艺,在抑制绿原酸异构化的同时也有效抑制了其水解,与法定工艺相比,绿原酸总转移率提高24.95%,有利于提高银黄口服液抗菌、消炎的功效。

